Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 презентация
Содержание
- 2. 1. Общая характеристика, гомологический ряд, номенклатура , изомерия. Алкенами называются алифатические углеводороды, содержащие в молекуле двойную
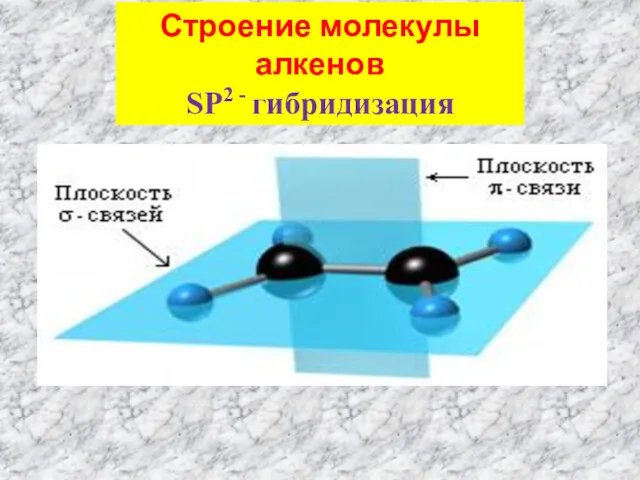
- 3. Строение молекулы алкенов SP2 - гибридизация
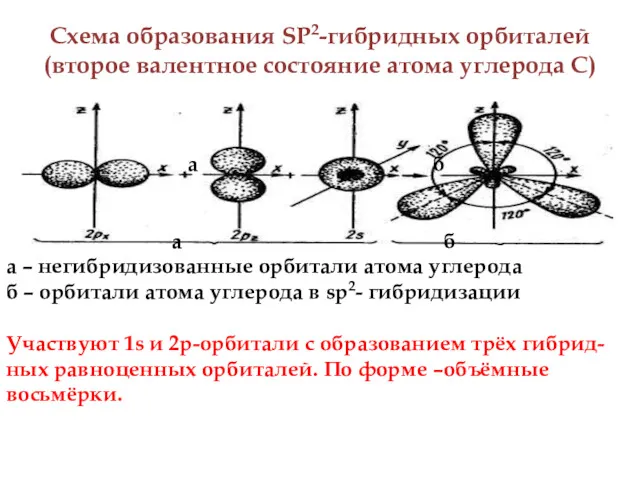
- 5. Схема образования SP2-гибридных орбиталей (второе валентное состояние атома углерода С) а б а б а –
- 6. Гомологический ряд алкенов Этен C2H4 Пропен C3H6 н-бутен C4H8 н-пентен C5H10 н-гексен C6H12 н-гептен C7H14 н-октен
- 7. Номенклатура 1.Систематическая (международная) номенклатура Выбираем цепочку с двойной связью. Нумеруем с того конца, где ближе двойная
- 8. 2.Рациональная номенклатура Выбираем 2 центральных атома, соединенных двойной связью. Отсекаем все связи, отходящие от центральных атомов.
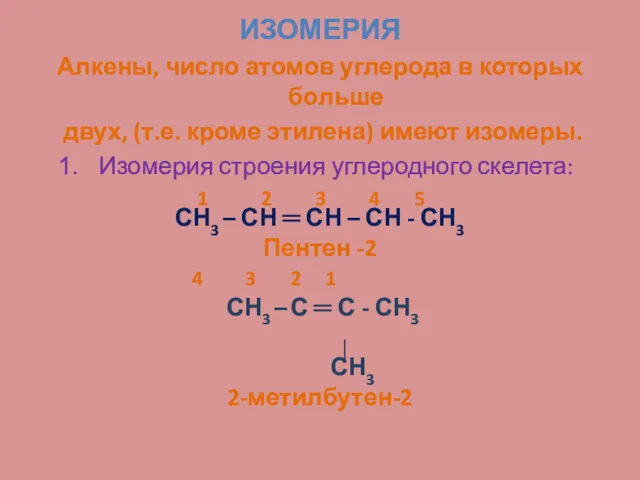
- 9. ИЗОМЕРИЯ Алкены, число атомов углерода в которых больше двух, (т.е. кроме этилена) имеют изомеры. Изомерия строения
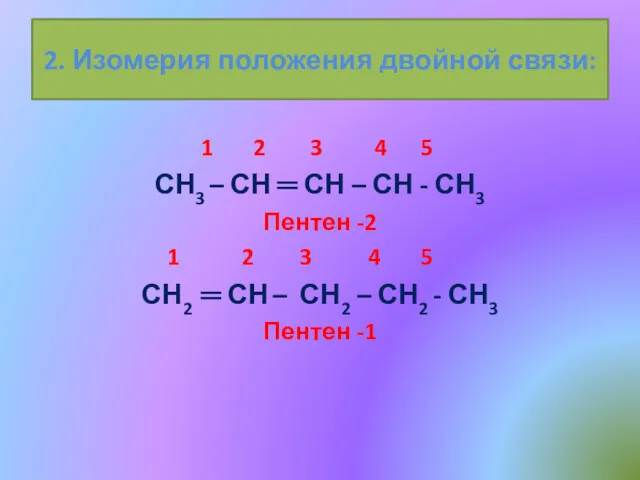
- 10. 2. Изомерия положения двойной связи: 1 2 3 4 5 СН3 – СН ═ СН –
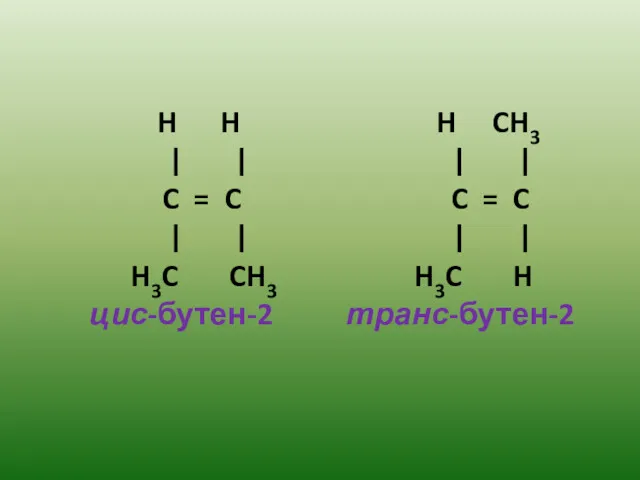
- 11. 3.Стереоизомерия Стереоизомерия – изомерия расположения атомов относительно двойной связи (пространственная). Цис – и транс – изомеры
- 12. H H H CH3 | | | | C = C C = C | |
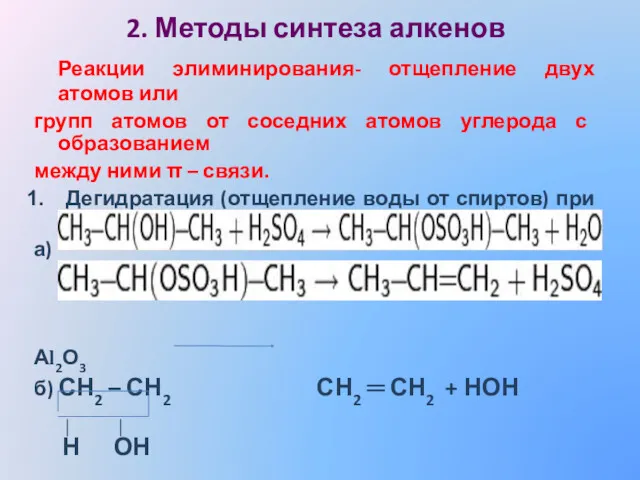
- 13. 2. Методы синтеза алкенов Реакции элиминирования- отщепление двух атомов или групп атомов от соседних атомов углерода
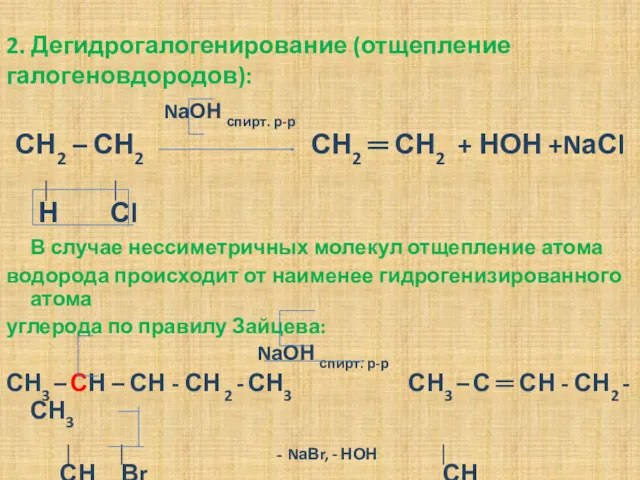
- 15. 2. Дегидрогалогенирование (отщепление галогеновдородов): NаОН спирт. р-р СН2 – СН2 СН2 ═ СН2 + НОН +NаСl
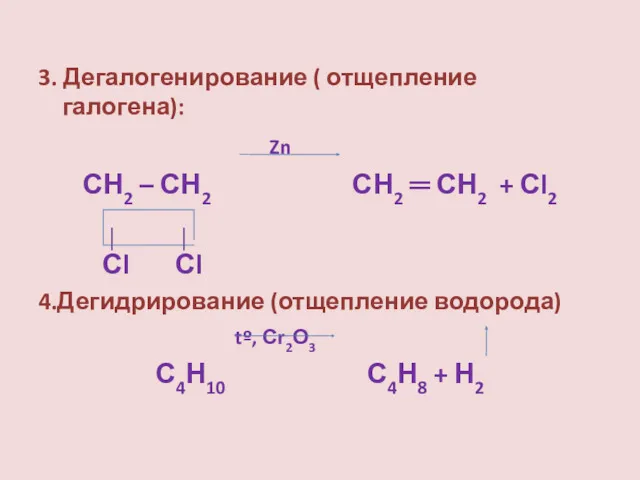
- 16. 3. Дегалогенирование ( отщепление галогена): Zn СН2 – СН2 СН2 ═ СН2 + Сl2 │ │
- 17. 3.Физические свойства Низшие гомологи С2 –С4 при нормальных условиях – газы; С5-С17 – жидкости; высшие гомологи
- 18. 4. Химические свойства Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее
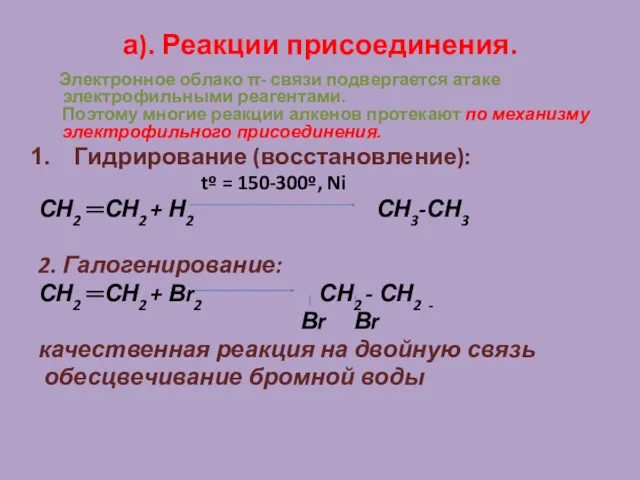
- 19. а). Реакции присоединения. Электронное облако π- связи подвергается атаке электрофильными реагентами. Поэтому многие реакции алкенов протекают
- 20. 3. Гидратация: СН2 ═СН2 + Н2 О Н+ СН3 - СН2 - ОН В реакциях несимметричных
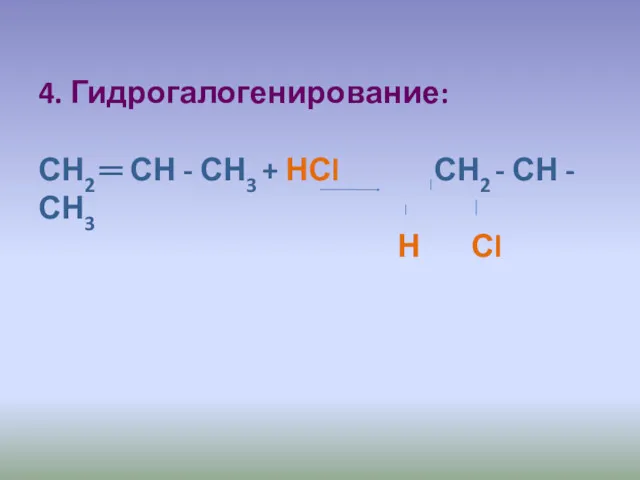
- 21. 4. Гидрогалогенирование: СН2 ═ СН - СН3 + НСl СН2 - СН - СН3 Н Сl
- 23. б). Реакции окисления 1. Окисление алкенов в мягких условиях (щелочная или нейтральная среда, холод, окислитель –
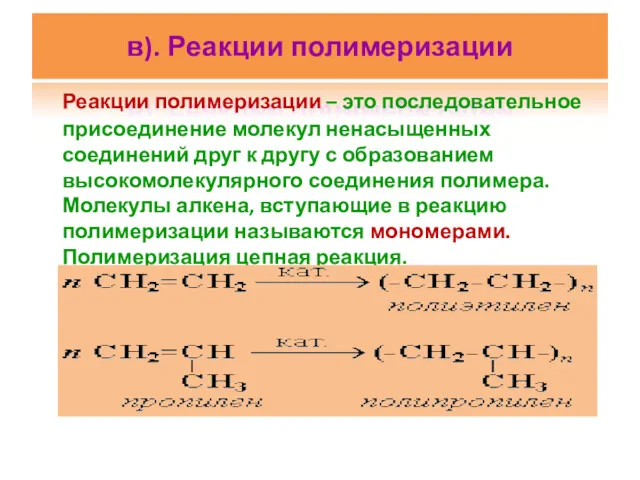
- 26. в). Реакции полимеризации Реакции полимеризации – это последовательное присоединение молекул ненасыщенных соединений друг к другу с
- 27. 5. Отдельные предствители 1.С2Н4 – этилен- газ со слабым чесночным запахом, горит, образуя копоть, мало растворим
- 28. 2.Пропен (пропилен) — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие. 3.Бутен-2 — вызывает
- 29. 4. Полиэтилен – получают полимеризацией этилена. Представляет собой бесцветный материал, имеющий низкую тепло- и электропроводность. Широко
- 31. Скачать презентацию
















 Классификация химических реакций
Классификация химических реакций Арены. Бензол
Арены. Бензол Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Применение гибридного биосорбента для очистки промышленных сточных вод от радиоактивных примесей
Применение гибридного биосорбента для очистки промышленных сточных вод от радиоактивных примесей Цветные металлы и сплавы
Цветные металлы и сплавы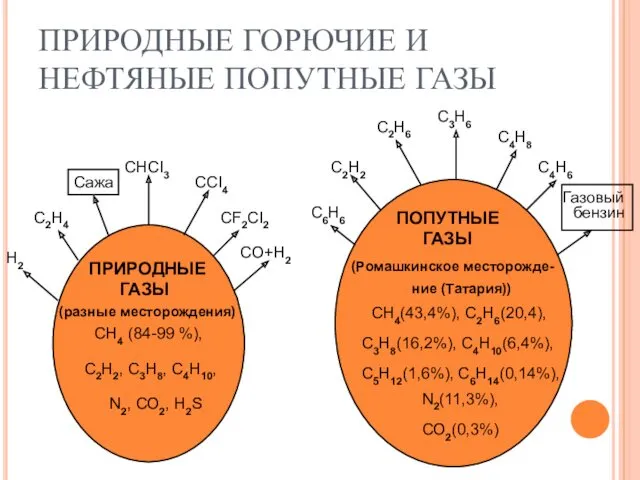 ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ Химические реакции. Классификация
Химические реакции. Классификация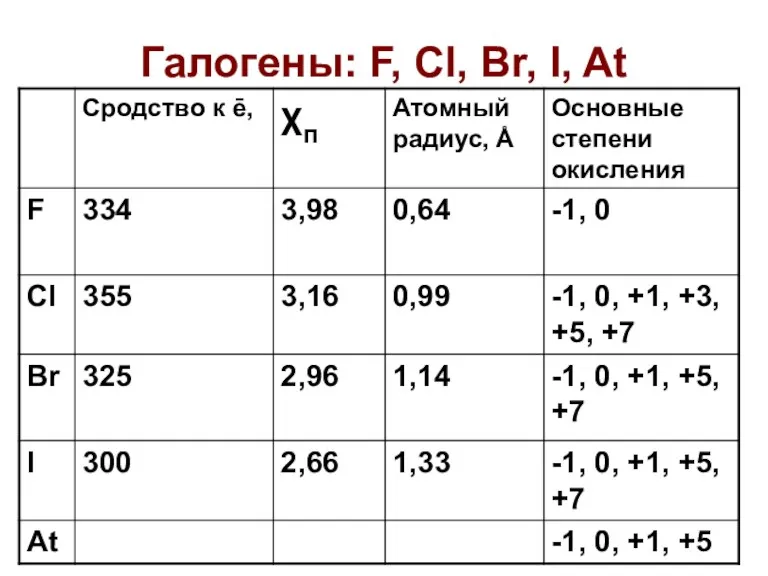 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Сульфиды. Занятие 7
Сульфиды. Занятие 7 Элементарные частицы вещества
Элементарные частицы вещества Чистые вещества и смеси
Чистые вещества и смеси Таланты известных химиков
Таланты известных химиков Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Степень окисления
Степень окисления Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Общая и неорганическая химия
Общая и неорганическая химия Водородный показатель
Водородный показатель Координационные комплексные соединения
Координационные комплексные соединения Оксиды. Химические свойства
Оксиды. Химические свойства Радиохимия
Радиохимия Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Электролитическая диссоциация
Электролитическая диссоциация Такой разный песок
Такой разный песок Платиновые металлы
Платиновые металлы Составление формул химических соединений
Составление формул химических соединений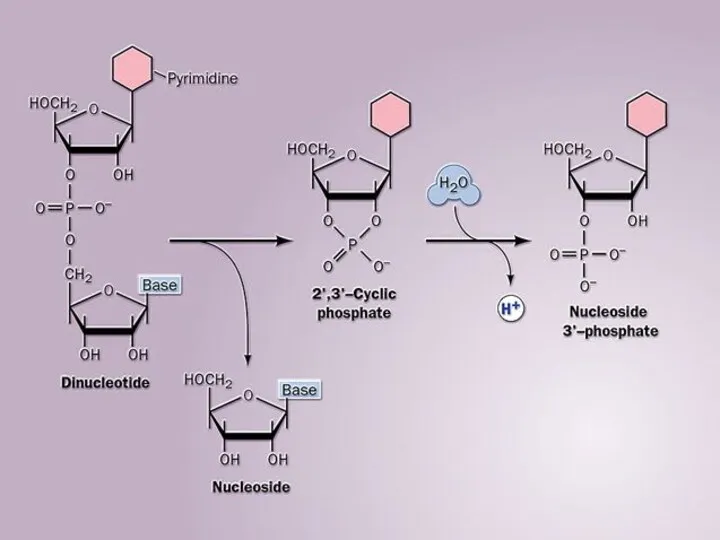 Functions of proteins
Functions of proteins