Содержание
- 2. МАЗМҰНЫ: Құрылысы Алу жолы. Зертханалық жолмен. Өнеркәсіптік жолмен Физикалық қасиеттері Химиялық қасиеттері. Басқа қышқылдармен ұқсастығы Химиялық
- 3. Құрылысы Оттегімен донорлы-акцепторлы байланыс арқылы байланысқан
- 4. HNO3 -ті алу жолдары Зертханалық жолмен : NaNO3 + H2SO4 t NaHSO4 + HNO3
- 5. 1) 4NH3 + 5O2 -> 4NO + 6H2O + Q 2) 2 NO + O2 ->
- 6. Физикалық қасиеттері Түссіз сұйықтық Ұшқыш- ауада түтінденеді Сумен кез-келген қатынаста араласады Tбал=-41,60C tқай=82,60C Физикалық қасиеттері
- 7. Химиялық қасиеттері Басқа қышқылдармен ұқсастығы: 1. Күшті электролит,суда иондарға диссоциацияланады. HNO3 -> H+ +NO3- Индикатордың түсін
- 8. Химиялық қасиеттері Өзіндік ерекшеліктері: 5. Жарықтың әсерінен ыдырайды,тұрақсыз 4HNO3 -> 2H2O +4NO2 + O2 6.Металдардың кернеу
- 9. №2 кесте P.S концентрлі HNO3 >60% сұйылтылған HNO3 = 30-60% көп мөлшерде сұйылтылған HNO3
- 10. Азот қышқылы тыңайтқыштар,дәрі-дәрмек,пластмассалар,қопарылғыш заттар,органикалық бояулар өндіруге қолданылады. ҚОЛДАНЫЛУЫ
- 12. Скачать презентацию
 Арены. Бензол
Арены. Бензол Ионная связь
Ионная связь Процессы и операции формообразования. Неметаллические материалы
Процессы и операции формообразования. Неметаллические материалы Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Спирти. Хімічні властивості
Спирти. Хімічні властивості Багатоатомні насичені спирти. Фізичні та хімічні властивості
Багатоатомні насичені спирти. Фізичні та хімічні властивості Кремний и его соединения
Кремний и его соединения Физико-химические свойства жиров
Физико-химические свойства жиров Чистые вещества и смеси
Чистые вещества и смеси Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды) Характеристика азота и фосфора. Физические и химические свойства
Характеристика азота и фосфора. Физические и химические свойства Геохимические методы исследований
Геохимические методы исследований Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Кислород и озон
Кислород и озон Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ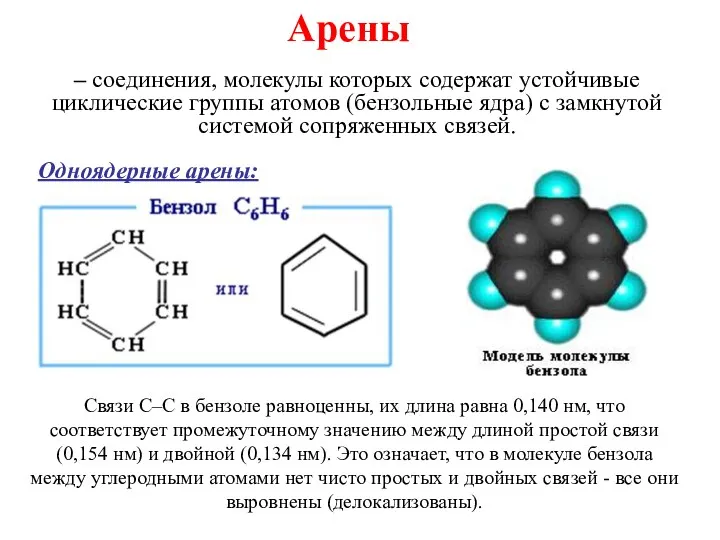 Ароматические углеводороды
Ароматические углеводороды Місце хімії серед наук про природу
Місце хімії серед наук про природу Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки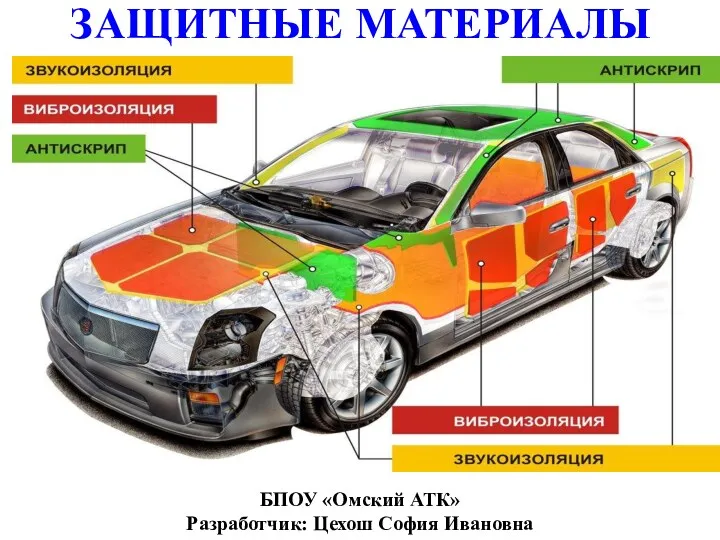 Защитные материалы
Защитные материалы Азот
Азот Способы получения металлов
Способы получения металлов История развитии химии
История развитии химии Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Этимология химических элементов
Этимология химических элементов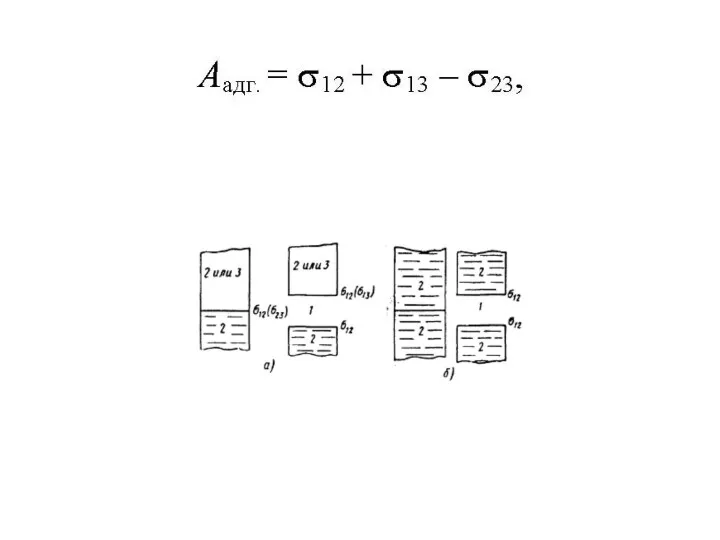 Характер затвердевания
Характер затвердевания Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография Азот қышқылы және нитраттар
Азот қышқылы және нитраттар Кремний. Физические свойства кремния
Кремний. Физические свойства кремния