Содержание
- 3. Элементы VIIА-группы (галогены) Общая электронная формула: […] ns 2 (n–1)d 10np 5 Ei ≈ 1700 кДж/моль
- 4. Элементы VIIА-группы (галогены)
- 5. Простые вещества: F2, Cl2, Br2, I2, At2 Иод Бром Фтор Хлор
- 6. Фтор: распространение в природе Кларк 0,03% Флюорит (плавиковый шпат) CaF2 Криолит Na3[AlF6] Фторапатит 3Ca3(PO4)2 · CaF2
- 7. Кристаллы флюорита
- 8. Фтор F2 т.пл. –220 °С, т.кип. –183 °С Э + F2 → Э+νFν–I (ν - высшая
- 9. Соединения фтора. Фтороводород Фтороводород HF : (HF)n т.кип. +19,5 °С, неограниченно растворим в воде Автопротолиз: H2F2
- 10. Фтороводород SiO2 + 4HF(г) = SiF4↑ + 2H2O (травление стекла) SiO2 + 6HF (изб.) = =H2[SiF6]
- 11. Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз смеси HF и KF)
- 12. Получение фтора и фтороводорода В промышленности: электролиз расплава KHF2 (т. пл. 239 °C) или KH2F3 (т.
- 13. Применение Водоподготовка (обеззараживание воды фторированием) Фторуглеродные соединения (фреоны, фторкаучуки, фторопласты (тефлоны) и т.п. HF: получение синтетического
- 14. Галогены в природе 11. Хлор (0,19%) 43. Бром 70. Иод 94. Астат Редкие рассеянные элементы Галит
- 15. Редкие минералы Бромаргирит AgBr Иодаргирит AgI Лаутарит Ca(IO3)2 Диэтзеит 7Ca(IO3)2·8CaCrO4
- 16. Хлор, бром, иод: физические свойства * при повышенном давлении; в обычных условиях иод склонен к сублимации.
- 17. Хлор, бром, иод: химические свойства Г2 MIA MГ Al AlГ3 Al2Cl6 AlI3 (кат.H2O) H2 HГ (Г-
- 18. Г2: Cl Br I (At) Примеры: I2 + конц.к-та → I+IClO4 I+INO3 I+IHSO4 Cl2 (Br2) +
- 19. 3. Взаимодействие с водой Г2 + n H2O ⮀ Г2 · n H2O (гидратация) Г2 ·
- 20. В р-ре KI: KI + I2 (т) = K[I(I)2] I– + I2 (т) = [I(I)2]– дииодоиодат(I)-ион
- 21. В растворах щелочей Br2 + 2KOH = KBr + KBrO + H2O (на холоду) Br2 +
- 22. В органических растворителях Органические растворители, не смешивающиеся с водой, используют для извлечения (экстракции) брома и иода.
- 23. Галогеноводороды НГ НГ(ж) – бесцв., маловязкие неэлектролиты, неактивны, не реагируют c МО, МCO3, МIA !!!
- 24. Водные растворы HГ (Г – Cl, Br, I) НГ + H2O = Г– + H3O+ сильная
- 25. HCl HBr HI HCl + H2SO4(к) ≠ 2HBr + H2SO4(к) = Br2 + SO2↑ + 2H2O
- 26. Получение НCl В промышл. – прямым синтезом: H2 + Cl2 = 2HCl В лаборатории: NaCl +
- 27. Получение НBr и HI В лаборатории и в промышл. усл. – синтез галогенидов фосфора с последующим
- 28. Оксиды галогенов
- 29. Кислородные кислоты
- 30. Взаимодействие с водой В водном растворе HClO, HClO2, HBrO и H5IO6 – слабые кислоты: HClO +
- 31. В щелочной среде – диспропорцио-нируют (дисмутация): 3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O Г2
- 33. Скачать презентацию
 Воздух и его состав
Воздух и его состав Хімія та їжа
Хімія та їжа Карбонильные соединения
Карбонильные соединения Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях 20230212_urok_ionnye_uravneniya
20230212_urok_ionnye_uravneniya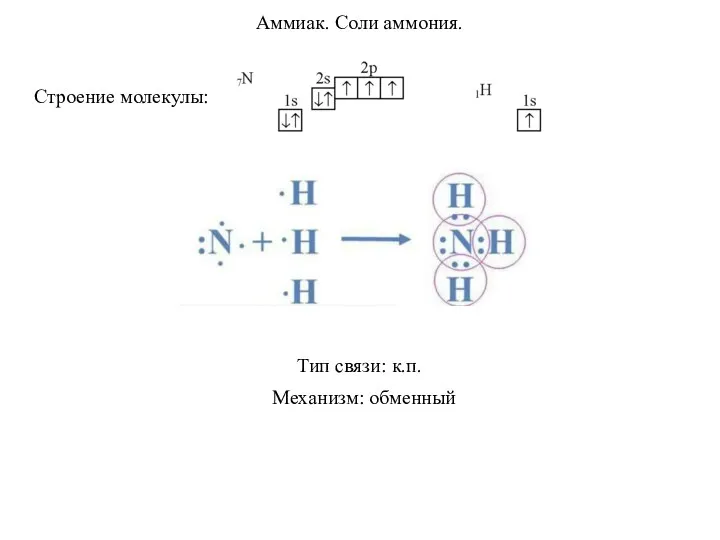 Аммиак. Соли аммония
Аммиак. Соли аммония ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Руды металлов
Руды металлов Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Карбоновые кислоты
Карбоновые кислоты Розділення неоднорідної суміші. Практична робота № 2
Розділення неоднорідної суміші. Практична робота № 2 Порівняльний аналіз методів відновлення свинцево-кислотних акумуляторів
Порівняльний аналіз методів відновлення свинцево-кислотних акумуляторів Тепловой эффект химических реакций
Тепловой эффект химических реакций Углеводы (сахариды)
Углеводы (сахариды) В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Atmospheric chemistry
Atmospheric chemistry Коррозия металлов
Коррозия металлов Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу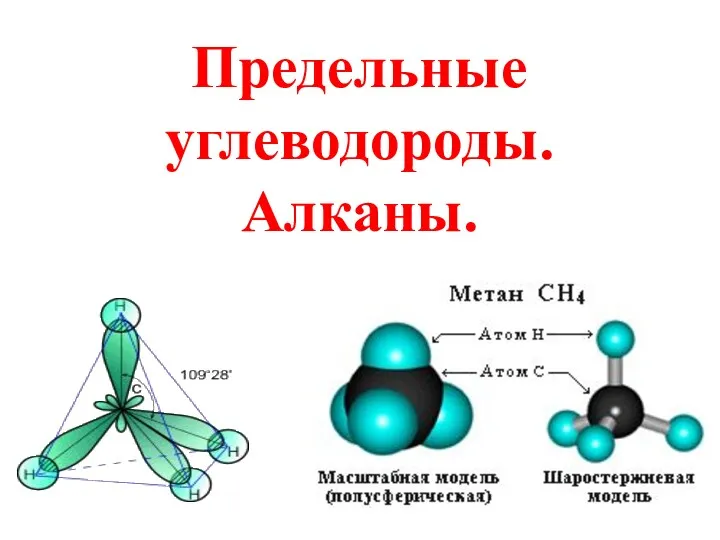 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Центрифугирование в цитологии
Центрифугирование в цитологии Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Азотная кислота и её соли
Азотная кислота и её соли Механизм реакции в органической химии
Механизм реакции в органической химии Соли, химические свойства, получения
Соли, химические свойства, получения Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас)
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас) Массообменные процессы
Массообменные процессы Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова