Содержание
- 2. История Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать
- 3. Заполните таблицу:
- 5. Сравнение фосфора и азота Еще один представитель главной подгруппы V группы периодической системы, Так как в
- 6. Нахождение в природе и организме В свободном состоянии в природе не встречаются вследствие легкой окисляемости фосфора.
- 7. Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мышцы 130 граммов Мозг
- 8. Получение фосфора Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при
- 9. Аллотропия- явление, когда один и то же химический элемент образует несколько простых веществ Химический элемент фосфор
- 10. белый красный черный Аллотропные модификации фосфора
- 11. Состоит из молекул P4. Белое мягкое кристаллическое вещество. Чесночный запах. t плавления 44 oC, самовоспламеняющийся порошок.
- 12. Черный фосфор: Похож на графит. Проводит электрический ток. t плавления 597 оС. Атомная кристаллическая решетка. Нерастворим
- 13. Химические свойства фосфора Химические свойства белого и красного фосфора близки, но белый фосфор химически более активен.
- 14. С неметаллами — восстановитель: 2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3. Сильные окислители
- 15. Фосфорсодержащие минералы и породы. Почва Растения Животные Круговорот фосфора в природе
- 17. Осуществите превращения: Осуществите превращения Ca3(PO4)2 1 P 2 P2O5 Ca3P2 3 PH3 4 P2O5 Для уравнений
- 19. Скачать презентацию
 Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Введение в органическую химию
Введение в органическую химию Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы История становления органической химии
История становления органической химии Реакционные аппараты
Реакционные аппараты Чистые вещества и смеси
Чистые вещества и смеси Растворы электролитов. Лекция №3
Растворы электролитов. Лекция №3 Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Реактор получения элементарной серы
Реактор получения элементарной серы Физическая химия. Химическая термодинамика
Физическая химия. Химическая термодинамика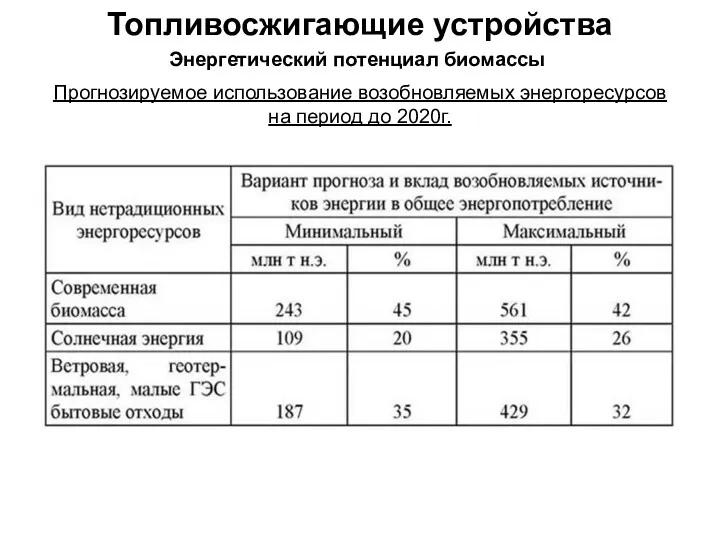 Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо
Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток
Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток Строение атомов. Понятие о квантовой механике
Строение атомов. Понятие о квантовой механике Номенклатура органических веществ
Номенклатура органических веществ Простые вещества. Аллотропия. Классификация простых веществ. Бинарные соединения. Оксиды
Простые вещества. Аллотропия. Классификация простых веществ. Бинарные соединения. Оксиды Соединения железа
Соединения железа Ферменти
Ферменти Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Химические свойства альдегидов
Химические свойства альдегидов Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии Коррозия металлов
Коррозия металлов Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Carbohydrates. Starch
Carbohydrates. Starch Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Вода - основа жизни
Вода - основа жизни Роль хімії у житті суспільства
Роль хімії у житті суспільства Семиполярлы байланыс
Семиполярлы байланыс Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс