Содержание
- 2. Оксид азота (I) N2O N2O – оксид азота (I), закись азота или «веселящий газ», возбуждающе действует
- 3. Оксид азота (II) NO – оксид азота (I I) бесцветный газ, термически устойчивый, плохо растворим в
- 4. Оксид азота (III) N2O3 – оксид азота (III) жидкость темно-синего цвета, термически неустойчивая, t кип.= 3,5
- 5. Оксид азота (IV) NO2 – оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в
- 6. Оксид азота (V) N2O5 – оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл.= 410С).
- 7. Азотная кислота. HNO3 Азотная кислота – бесцветная гигроскопичная жидкость, имеет резкий запах, «дымит» на воздухе, неограниченно
- 8. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 9. Азотная кислота (HNO3) Классификация наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая одноосновная
- 10. Получение азотной кислоты в промышленности NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2
- 11. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. Составьте уравнение
- 12. Химические свойства азотной кислоты 1. Типичные свойства кислот 2. Взаимодействие азотной кислоты с металлами 3. Взаимодействие
- 13. Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. Перечислите свойства характерные для кислот.
- 14. 2HNO3 + CuO = Cu(NO3)2 + H2O 1 2H+ + 2NO3– + CuO = Cu2+ +
- 15. 3 2HNO3 + (NH4)2CO3 = 2NH4NO3 + ↑CO2 + H2O 2H+ + 2NO3– + 2NH4+ +
- 16. Взаимодействие азотной кислоты с металлами Как реагируют металлы с растворами кислот? Металлы, стоящие в ряду активности
- 17. Составьте уравнение реакции взаимодействия концентрированной азотной кислоты с ртутью. Рассмотрите реакцию с т. зр. ОВР. 4HN+5O3
- 18. Допишите схемы реакций: Рассмотрите превращения в свете ОВР 1) HNO3(конц.) + Cu → Cu(NO3)2 + …
- 19. Взаимодействие азотной кислоты с неметаллами Окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 20. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 21. Соли азотной кислоты Как называются соли азотной кислоты? нитраты Нитраты K, Na, NH4+ называют селитрами Составьте
- 22. Нитрат калия (калиевая селитра) Бесцветные кристаллы Значительно менее гигроскопична по сравнению с натриевой, поэтому широко применя-ется
- 23. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение
- 24. При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.
- 26. Скачать презентацию
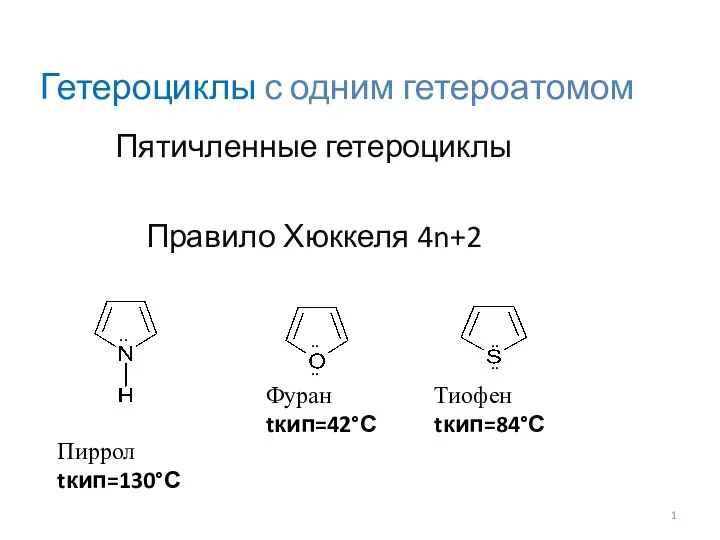 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Теория сплавов
Теория сплавов Crystal Defects and Noncrystalline Structure–Imperfection
Crystal Defects and Noncrystalline Structure–Imperfection Водородная связь
Водородная связь Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Теория электролитической диссоциации
Теория электролитической диссоциации Композиты и композиционные материалы
Композиты и композиционные материалы Железо и его соединения
Железо и его соединения Соли: карбонаты, галоиды, сульфаты
Соли: карбонаты, галоиды, сульфаты Құймалар. Механикалық қоспа
Құймалар. Механикалық қоспа Классификация химических реакций
Классификация химических реакций Диагностические свойства минералов. Занятие 3-4
Диагностические свойства минералов. Занятие 3-4 Основания. Обобщение
Основания. Обобщение Физические и химические свойства аренов
Физические и химические свойства аренов Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Вуглеводи. Лекція
Вуглеводи. Лекція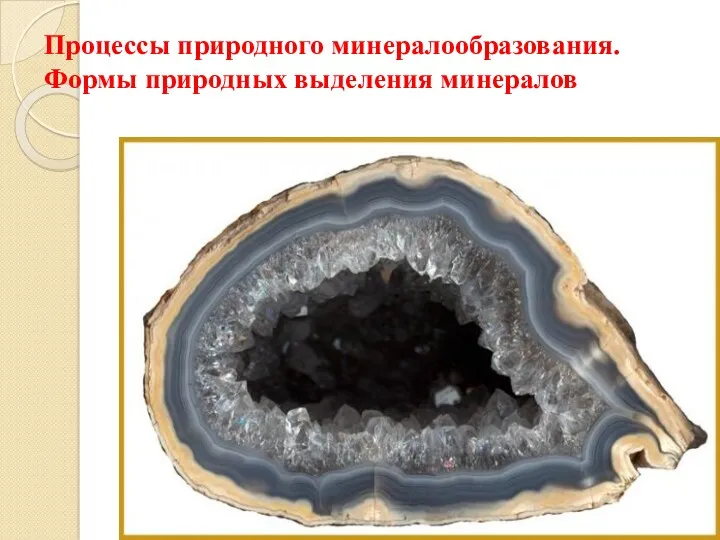 Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов Обмен липидов-1
Обмен липидов-1 Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Химическая кинетика и катализ механики. (Лекция 5)
Химическая кинетика и катализ механики. (Лекция 5) Анализ качества лекарственных и косметических лекарственных средств из группы галогенидов щелочных металлов
Анализ качества лекарственных и косметических лекарственных средств из группы галогенидов щелочных металлов Аминокислоты. Что нужно для настоящего атлета?
Аминокислоты. Что нужно для настоящего атлета? Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе
Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма
Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма Классификация химических реакций
Классификация химических реакций Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Основные понятия органической химии
Основные понятия органической химии