Содержание
- 2. КИСЛОТА это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
- 3. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 1. Действие кислот на индикаторы Водные растворы кислот изменяют окраску индикаторов. В кислой
- 4. 2. Взаимодействие кислот с металлами Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов левее водорода.
- 5. 3. Взаимодействие кислот с основными и амфотерными оксидами Кислоты реагируют с основными и амфотерными оксидами. В
- 6. 4. Взаимодействие кислот с основаниями и с амфотерными гидроксидами. Кислоты реагируют с основаниями и с амфотерными
- 7. 5. Взаимодействие кислот с растворимыми солями. Реакции обмена между кислотами и солями возможны, если в результате
- 8. АЗОТНАЯ КИСЛОТА Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого
- 9. Cвойства азотной кислоты Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же
- 10. - азотная кислота разбавленная: При взаимодействии с щелочно-земельными металлами, а также цинком (Zn), железом (Fe), она
- 11. Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях
- 13. Скачать презентацию
 Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Алкалоиды. Классификация алкалоидов:
Алкалоиды. Классификация алкалоидов: Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Неон (Ne)
Неон (Ne) Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь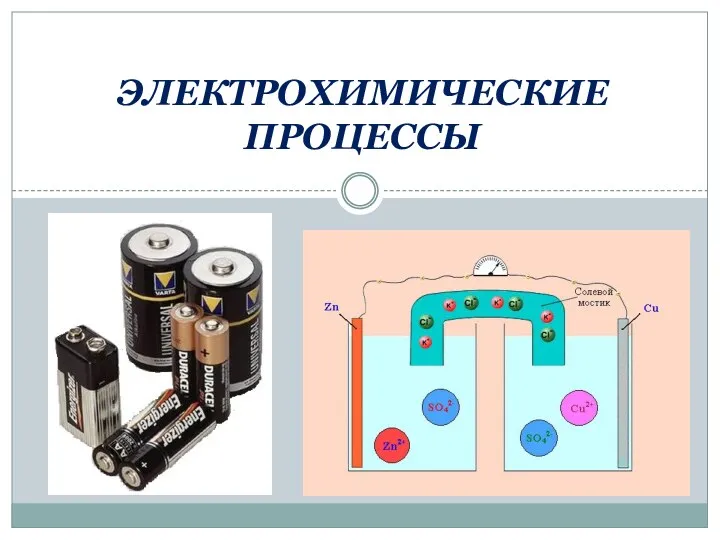 Электрохимические процессы
Электрохимические процессы Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Азот и его соединения
Азот и его соединения Купрум. Знаходження в періодичній системі
Купрум. Знаходження в періодичній системі Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Химические свойства альдегидов
Химические свойства альдегидов Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Теории химической кинетики Лекция 5
Теории химической кинетики Лекция 5 Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Подкласс Иносиликаты (цепочечные/ленточные силикаты)
Подкласс Иносиликаты (цепочечные/ленточные силикаты) Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Термический анализ
Термический анализ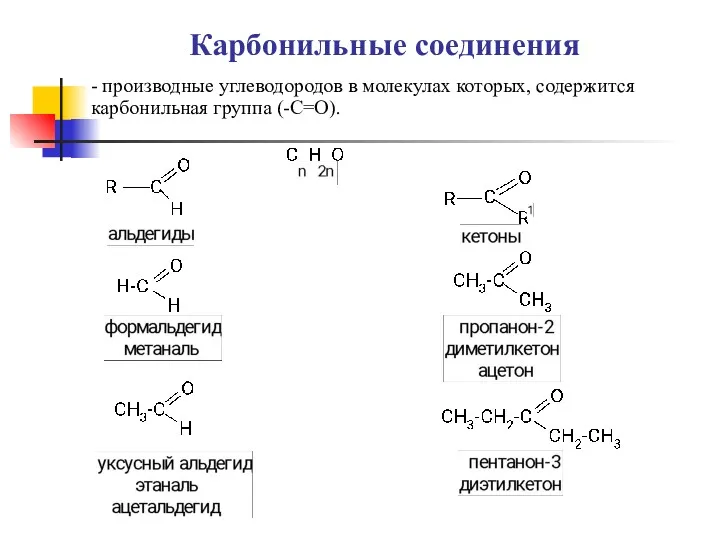 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды Накопление химических знаний в доисторические времена
Накопление химических знаний в доисторические времена Calcium and magnesium. Formation of calcareous.water hardness
Calcium and magnesium. Formation of calcareous.water hardness Изомеры и гомологи
Изомеры и гомологи Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами
Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Простые вещества неметаллы
Простые вещества неметаллы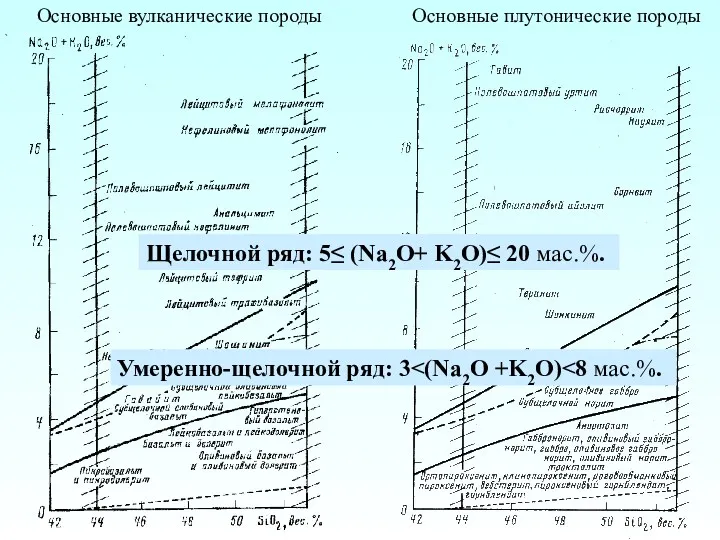 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы