Содержание
- 2. УЧЕБНЫЕ ВОПРОСЫ: 1. Химические структуры. Виды химических связей: металлическая, ионная, ковалентная. 2. Физические структуры. Межмолекулярные связи.
- 3. Литература Арзамасцев В.Б., А.Н. Волчков, В.А. Головин и др. Материаловедение и технология конструкционных материалов: учебник для
- 4. Химические структуры. Виды химических связей: металлическая, ионная, ковалентная Химическая структура вещества представляет собой взаимное расположение атомов
- 5. Ковалентная и ионная связь ковалентная связь, которая осуществляется парой электронов, общих для двух атомов, образующих связь.
- 6. Металлическая и координационная связь металлическая связь, которая проявляется при взаимодействии атомов элементов, имеющих избыток свободных валентных
- 7. Водородная связь и молекулярное взаимодействие электрической природы (взаимодействие Ван-лер-Ваальса) Водородная связь образуется в результате взаимодействия атома
- 8. Кристаллические структуры. Кристаллические решетки. Полиморфизм. Анизотропия. Аморфная структура Кристаллическая решетка — это воображаемый геометрический образ для
- 9. Виды кристаллических решёток у некоторых металлов Металлические кристаллические решетки: а) кубическая объемноцентрированная (Fe, V, Nb, Cr)
- 10. Молекулярные решётки Молекулярные кристаллические решетки: а) йод; б) лед/вода
- 11. Ионные решётки Примеры ионных кристаллических решеток: а) NaCl; б) CsCl
- 12. Полиморфизм. Анизотропия. Полиморфи́зм криста́ллов (от др.-греч. πολύμορφος «многообразный») - способность вещества существовать в различных кристаллических структурах,
- 13. Аморфная структура Аморфная структура является одним из физических состояний твердых тел, Аморфные вещества характеризуются двумя особенностями.
- 14. Дефектность материалов. Виды дефектов. Влияние дефектов на свойства материалов. Вакансии Дефекты замещения Дефекты внедрения Дислокации и
- 15. Деффекты в кристалличеких материалах (2) Вака́нсия (от лат. vacans — пустующий, свободный) — дефект кристалла, представляющий
- 16. Благодарю за внимание! tvernick@ mail.ru
- 19. Скачать презентацию
 Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Чистые вещества и смеси. Состав смесей. Разделение смесей
Чистые вещества и смеси. Состав смесей. Разделение смесей Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Алюминий и его соединения
Алюминий и его соединения Ізомери у природі
Ізомери у природі Хімічні властивості алканів
Хімічні властивості алканів Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Теории химической кинетики Лекция 5
Теории химической кинетики Лекция 5 Получение металлов. (9 класс)
Получение металлов. (9 класс) Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка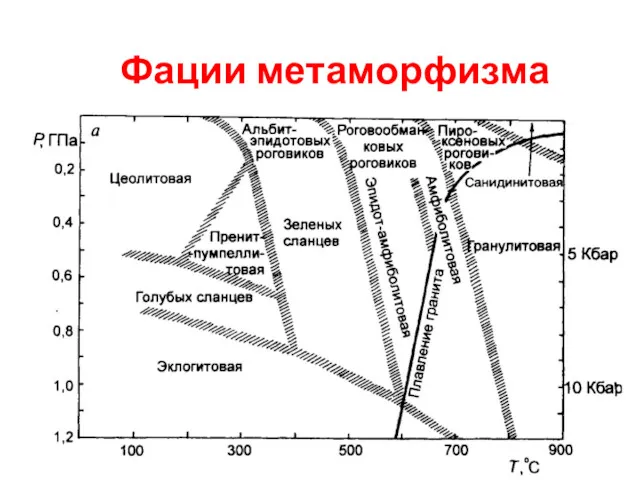 Фации метаморфизма
Фации метаморфизма Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Сложные эфиры
Сложные эфиры Комплексті қосылыстар және олардың биологиялық маңызы
Комплексті қосылыстар және олардың биологиялық маңызы Алкадиены
Алкадиены Решение задачи №10. Гидроксид рубидия. Команда Карбораны
Решение задачи №10. Гидроксид рубидия. Команда Карбораны Химическая промышленность
Химическая промышленность Кислород
Кислород Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3
Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3 Задача №5. Аккумулятор на основе железа
Задача №5. Аккумулятор на основе железа Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Химическая кинетика
Химическая кинетика Аналитическая химия. Количественный анализ
Аналитическая химия. Количественный анализ Фенол қосылыстары
Фенол қосылыстары Галогены
Галогены Азот, строение, свойства. Круговорот Азота в природе
Азот, строение, свойства. Круговорот Азота в природе