Слайд 2

Качественные реакции
в биохимии
Реакции на углеводы
Слайд 3

Качественная реакция на углеводы
(и все прочие гликоли)
Образование хелатных комплексов с медью-II
в щелочной среде (растворение осадка гидроксида и синее окрашивание)
Специфическая качественная реакция на крахмал – образование внутрикомплексного соединения с йодом
Слайд 4

Выявление восстанавливающих сахаров
Альдозы при смешении с щелочным раствором гидроксида меди-II дают
желтый, а затем оранжевый осадок (даже при стоянии раствора гликолята):
R-CHO + Cu(OH)2 + OH- = RCOOH + Cu(OH) + H2O
2 CuOH = Cu2O + H2O
Кетозы дают эту же реакцию при кипячении, а поли- и олигосахариды эту реакцию не дают.
Слайд 5

Гидролиз олиго- и полисахараидов
Сахароза и крахмал в кислой среде расщепляются при
нагревании до мономеров.
(C6H10O5)n + H2O H+ n C6H12O6
C12H22O11 + H2O = 2 C6H12O6
Доказательством наличия восстанавливающего сахара (глюкозы) в составе крахмала и сахарозы служит окислительно-восстановительная реакция с гидроксидом меди-II.
Слайд 6

Качественные реакции
в биохимии
Реакции на белки
Слайд 7
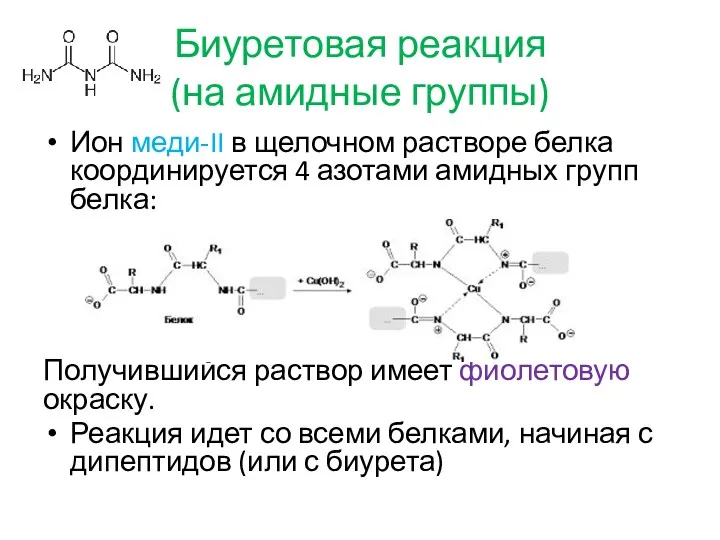
Биуретовая реакция
(на амидные группы)
Ион меди-II в щелочном растворе белка координируется
4 азотами амидных групп белка:
Получившийся раствор имеет фиолетовую окраску.
Реакция идет со всеми белками, начиная с дипептидов (или с биурета)
Слайд 8
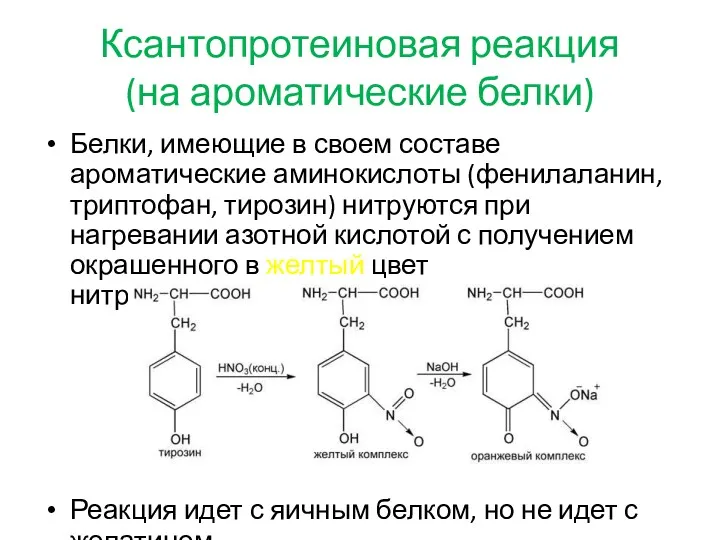
Ксантопротеиновая реакция
(на ароматические белки)
Белки, имеющие в своем составе ароматические аминокислоты
(фенилаланин, триптофан, тирозин) нитруются при нагревании азотной кислотой с получением окрашенного в желтый цвет нитропроизводного:
Реакция идет с яичным белком, но не идет с желатином.
Слайд 9

Выявление серосодержащих белков
Белки, в состав которых входят серосодержащие аминокислоты (цистеин, метионин),
при взаимодействии с щелочным раствором гидроксида свинца образуют сульфид свинца бурого цвета при нагревании:
(CH3COO)2Pb + 4 NaOH = CH3COONa + Na2[Pb(OH)4]
Na2S + Na2[Pb(OH)4] = 4 NaOH + PbS
Слайд 10

Осаждение белка
Белки осаждаются без денатурации в разных условиях:
При нагревании белка вблизи
изоэлектрической точки;
При добавлении сильных кислот;
При добавлении сильного электролита (соли) до насыщения (альбумины) или полунасыщения (глобулины).
Слайд 11

Качественные реакции
в органической химии
Различение органических кислот
Слайд 12

Различение органических кислот,
дающих нерастворимые осадки
Некоторые анионы органических кислоты способны давать нерастворимые
осадки с ионами металлов группы кальция (или с медью-II):
2NaOH + H2C2O4 = Na2C2O4 + 2H2O
BaCl2 + Na2C2O4 = BaC2O4 + 2NaCl
**Чистая щавелевая кислота - твердая
***Оксалат кальция ответственен за образование камней в почках и т.д.
Слайд 13

Окисление органических кислот гидроксидом меди-II
Муравьиная кислота является не только кислотой, но
и альдегидом. Потому ей тоже свойственна реакция «медного зеркала»:
HCOOH + NaOH = HCOONa + H2O
2 HCOONa + 4 Cu(OH)2 = Na2CO3 + 4 CuOH + CO2 + 3 H2O
2 CuOH = Cu2O + H2O
**Муравьиная кислота так сильно пахнет, что ее часто проще отличить по запаху
***Однако все же большинство кислот каких-то специфических реакций не имеют
Слайд 14

Качественные реакции
в органической химии
Проба на фенолы
Слайд 15

Бромирование фенолов
Растворы фенолов реагируют с бромной водой с образованием малорастворимых производных.
В случае с фенолом это белый трибромфенол, в случае же с гидрохиноном это тетрабромгидрохинон – игольчатые кристаллы цвета потемневшей латуни.
**Самый обычный фенол проще определить по запаху – он пахнет гуашью (точнее, наоборот – гуашь пахнет фенолом)
***Обычно для реакции требуются весьма концентрированные растворы, иной раз раствор стоит подогреть














 Алюминий. Строение
Алюминий. Строение Произведение растворимости. Строение комплексных соединений
Произведение растворимости. Строение комплексных соединений Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Виды химической связи
Виды химической связи Железо и его сплавы
Железо и его сплавы Карбоновые кислоты
Карбоновые кислоты Обмен липидов
Обмен липидов Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Реакции ионного обмена
Реакции ионного обмена Удивительный мир камня
Удивительный мир камня Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Коррозия каменных и бетонных строительных конструкций
Коррозия каменных и бетонных строительных конструкций Кислотно-основное титрование
Кислотно-основное титрование Химия в повседневной жизни человека
Химия в повседневной жизни человека Получение неметаллов
Получение неметаллов Химическая связь в кластерах
Химическая связь в кластерах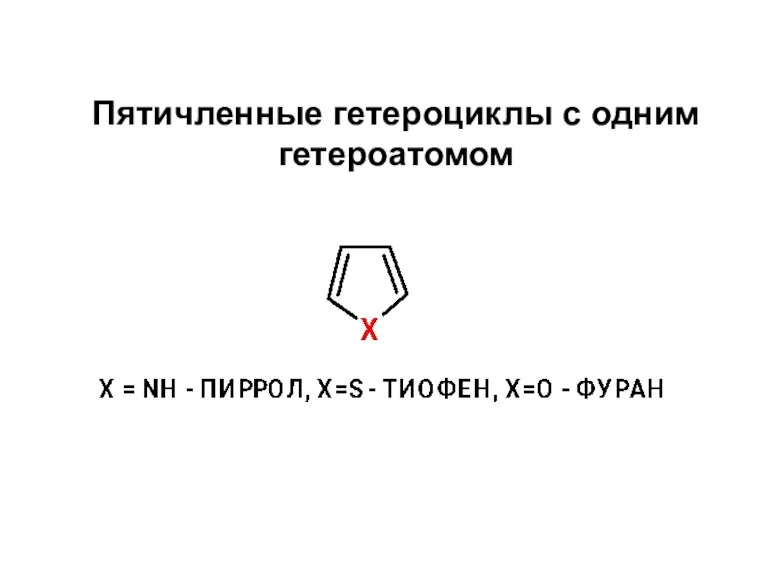 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Застосування солей і оксидів
Застосування солей і оксидів Строение атома. Электронные оболочки атома
Строение атома. Электронные оболочки атома 20230814_obobshchenie_po_teme_nemetally
20230814_obobshchenie_po_teme_nemetally Одноатомные и многоатомные спирты
Одноатомные и многоатомные спирты Металлические и неметаллические свойства химических элементов
Металлические и неметаллические свойства химических элементов Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Присадки. Механизм действия присадок
Присадки. Механизм действия присадок Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени