Содержание
- 2. Электронная оболочка Электронная оболочка - область пространства вероятного местонахождения электронов. Z = кол-во p = кол-во
- 3. Электронная оболочка Электроны различаются своей энергией и расположены от ядра на различном расстоянии. Чем ближе электроны
- 4. Электронный слой По мере удаления электрона от ядра атома запас энергии электрона увеличивается. Электронный слой -
- 5. Электронный слой Число заполняемых электронами слоев в атоме Номер периода (n) = Максимальное число электронов, находящихся
- 6. Распределение электронов по электронным уровням Н + 1 Не + 2 Li + 3 + 4
- 7. Схема распределения электронов в атоме ₊₁H⁰)₁ ₊₂He⁰)₂ ₊₃Li⁰)₂)₁ ₊₄Be⁰)₂)₂ ₊₅B⁰)₂)₃ ₊₆C⁰)₂)₄ ₊₇N⁰)₂)₅ ₊₈O⁰)₂)₆ ₊₉F⁰)₂)₇ ₊₁₀Ne⁰)₂)₈ ₊₁₁Na⁰)₂)₈)₁
- 8. Внешние и валентные электроны Внешние электроны принимают участие в образовании связи в первую очередь, т.к. при
- 9. Энергетические подуровни Электронное облако - пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона. =
- 10. Формы электронных облаков Сферическая форма s - электронное облако до 2 электронов Форма объемной восьмерки p
- 11. Энергетические подуровни
- 12. Принцип наименьшей энергии Электроны в атомах заполняют уровни и подуровни в порядке возрастания значения их энергии,
- 13. Заполнение электронами четвертого энергетического уровня 8 1 K Ca Sc Ti 2 9 10 Zn 18
- 15. Электронная формула атома и ее графическое изображение у элементов первого периода Н 1s1 Номер уровня Форма
- 16. Элементы второго периода Li 1s2 2s1 Be 1s2 2s2 B 1s2 2s2 2p1 C 1s2 2s2
- 17. Na Строение атома натрия 1 2 s s p s 3s1 Краткая электронная конфигурация
- 18. Электронная конфигурация атомов
- 20. Скачать презентацию
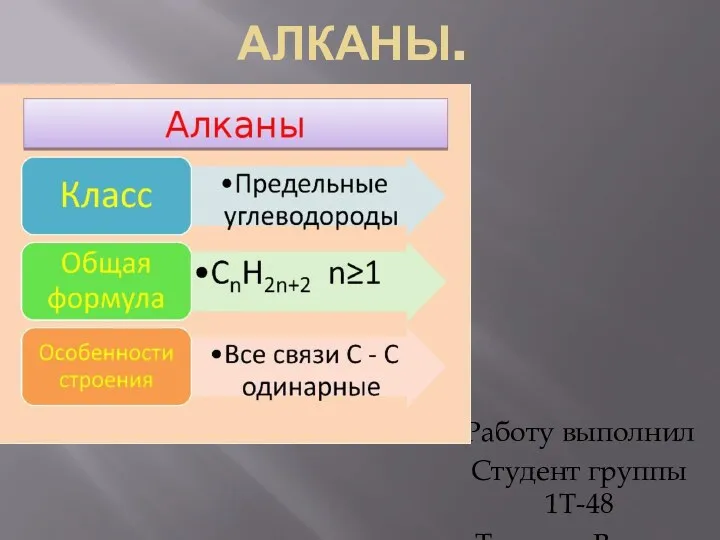 Алканы. Гомологический ряд и изомерия
Алканы. Гомологический ряд и изомерия Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Интеллектуальная физико-химическая игра
Интеллектуальная физико-химическая игра Химическая связь
Химическая связь Показатели жесткости воды
Показатели жесткости воды Білки та амінокислоти
Білки та амінокислоти Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Газовые смеси
Газовые смеси Растворы ВМС и их свойства
Растворы ВМС и их свойства Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Поняття про побутові хімікати
Поняття про побутові хімікати Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ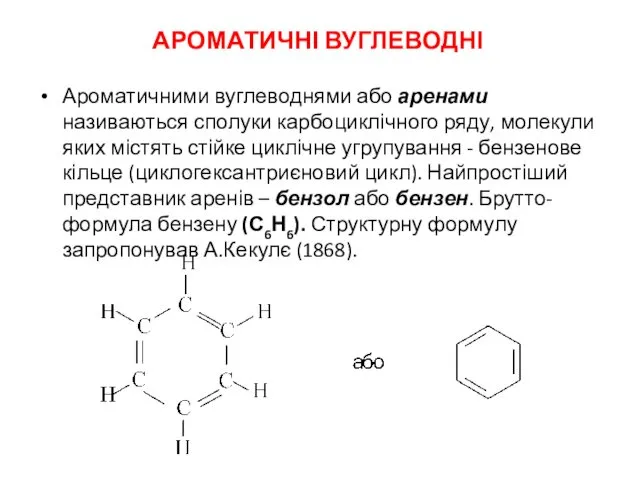 Ароматичні вуглеводні
Ароматичні вуглеводні Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння
Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Химические свойства металлов
Химические свойства металлов Электролитическая диссоциация. Положительно-заряженный электрод
Электролитическая диссоциация. Положительно-заряженный электрод Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Химическая промышленность
Химическая промышленность Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева
Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 Строение атома. 10 ен
Строение атома. 10 ен Химическая кинетика
Химическая кинетика Синтетические моющие средства
Синтетические моющие средства