Содержание
- 2. СТРОЕНИЕ АТОМА Развитие представлений о строении атома. Доквантовомеханические модели строения атома. Квантовомеханическая модель строения атома. Двойственная
- 3. Свидетельства сложного строения атома Открытия: явления фотоэффекта (А.Г. Столетов, 1889 г.); электрона при изучении катодных лучей
- 4. Модель строения атома по Дж. Томсону (1904 г.) + (модель «сливового пудинга») + + + +
- 5. Планетарные модели строения атома Б.Н. Чичерина Х. Нагаоки
- 6. ОПЫТЫ ЭРНЕСТА РЕЗЕРФОРДА (1889-1901 гг.)
- 7. Ядерная (планетарная) модель строения атома по Э. Резерфорду (1911 г.)
- 8. ПОСТУЛАТЫ НИЛЬСА БОРА Первый постулат Н. Бора: Электрон в изолированном атоме водорода находится (движется) на стационарных
- 9. Постулаты Нильса Бора Второй постулат Н. Бора: Энергия электрона E изменяется при переходе его с одной
- 10. МОДЕЛЬ СТРОЕНИЯ АТОМА ВОДОРОДА по Н. БОРУ (1913 г.) Излучение энергии в виде фотона hν Поглощение
- 11. КВАНТОВОМЕХАНИЧЕСКАЯ МОДЕЛЬ строения атома (1932 г.) Три положения квантовой механики: энергия электрона носит дискретный характер; электрон
- 12. Вόлны Луи де Бройля (1924 г.) Формула Планка: где с – скорость света, λ – длина
- 13. Вόлны Луи де Бройля где λБ – длина волны движущегося электрона, m и ν – масса
- 14. Принцип неопределенности В. Гейзенберга Для движущейся микрочастицы невозможно одновременно точно определить ее координату х (положение) и
- 15. Понятие волновой функции и атомной орбитали Волновая функция Ψ (пси-функция) – характеризует вероятность распределения электронной плотности
- 16. Понятие волновой функции и атомной орбитали Атомная орбиталь (АО) – это волновая функция Ψ, описывающая поведение
- 17. Волновое уравнение Э. Шредингера – основное уравнение квантовой механики; – показывает связь математической функции ψ(x, y,
- 18. КВАНТОВЫЕ ЧИСЛА – описывают состояние электрона в атоме; – решение уравнения Шредингера для электрона в атоме
- 19. КВАНТОВЫЕ ЧИСЛА μ – орбитальный момент количества движения (м.к.д.) электрона, меняется дискретно (квантуется); h – постоянная
- 20. КВАНТОВЫЕ ЧИСЛА Формы электронных облаков – орбиталей – индивидуальны, определяются значением орбитального квантового числа l. Орбитали
- 21. КВАНТОВЫЕ ЧИСЛА Форма электронных орбиталей в зависимости от l
- 22. КВАНТОВЫЕ ЧИСЛА Форма электронных орбиталей в зависимости от l
- 23. КВАНТОВЫЕ ЧИСЛА Форма электронных орбиталей в зависимости от l
- 24. КВАНТОВЫЕ ЧИСЛА 3. Магнитное квантовое число m характеризует расположение электронного облака (орбитали) в пространстве относительно направления
- 25. КВАНТОВЫЕ ЧИСЛА 4. Спиновое квантовое число s характеризует собственный (не орбитальный) магнитный момент электрона. Спиновое квантовое
- 26. КВАНТОВЫЕ ЧИСЛА Состояние каждого электрона в многоэлектронном атоме полностью определяется четырьмя квантовыми числами, три из которых
- 27. ПРИНЦИПЫ и ПРАВИЛА СОСТАВЛЕНИЯ ЭЛЕКТРОННЫХ КОНФИГУРАЦИЙ АТОМОВ Электроны в основном состоянии атома заполняют орбитали, подуровни, уровни
- 28. Относительная энергия атомных орбиталей и подуровней в многоэлектронных атомах и порядок заполнения их электронами (Е-диаграмма) Е
- 29. 2. Принцип В. Паули В атоме не может быть двух электронов, обладающих одинаковым набором всех четырех
- 30. 3. Правило Хунда В данном подуровне электрон стремится занять энергетические состояния таким образом, чтобы суммарный спин
- 31. Таблица Распределение электронов в многоэлектронных атомах по энергетическим уровням, подуровням, орбиталям
- 32. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО ЭНЕРГЕТИЧЕСКИМ УРОВНЯМ, ПОДУРОВНЯМ И ОРБИТАЛЯМ
- 33. СТРОЕНИЕ АТОМА
- 34. ОСОБЕННОСТИ СТРУКТУРЫ МНОГОЭЛЕКТРОННЫХ АТОМОВ 1. Отличие многоэлектронных атомов (Z >> +1) от атома водорода (Z =
- 35. СТРУКТУРА МНОГОЭЛЕКТРОННЫХ АТОМОВ Последовательность подуровней (АО) в порядке возрастания их энергии: 1s ˂ 6p Правило Клечковского:
- 36. СТРУКТУРА МНОГОЭЛЕКТРОННЫХ АТОМОВ Электронные оболочки многоэлектронных атомов имеют слоистую структуру: электроны с одинаковым n образуют один
- 37. СТРУКТУРА МНОГОЭЛЕКТРОННЫХ АТОМОВ Конфигурация электронной оболочки невозбуждённого атома определяется зарядом его ядра (+Z) Способы представления электронной
- 38. Электронные конфигурации атомов и ионов Примеры: 1) Распределение электронов по энергетическим уровням: 2) Распределение электронов по
- 39. Электронные конфигурации атомов и ионов б) для катиона Al3+: 1s22s22p63s03p0 – полная электронная формула [Ne] 3s03p0
- 40. Электронные конфигурации атомов и ионов 3) Е-диаграммы атомов и ионов: Е – – – – –
- 41. Электронные конфигурации атомов и ионов 4) Характеристика состояния электрона в атоме набором четырех квантовых чисел дает
- 42. Электронные конфигурации атомов и ионов Пример 2: Для всех валентных электронов атома фосфора (электронная формула: 1s22s22p6
- 43. Задание: Для атома Pb и иона Pb2+ в их основном состоянии: указать распределение электронов по квантовым
- 45. Скачать презентацию
 Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Понятие о спиртах
Понятие о спиртах Тепловой эффект химической реакции
Тепловой эффект химической реакции Чисті речовини і суміші
Чисті речовини і суміші Створення 3D моделей атомів й молекул елементів
Створення 3D моделей атомів й молекул елементів Ацидиметрия. Стандартизация
Ацидиметрия. Стандартизация Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Atmospheric chemistry
Atmospheric chemistry Сорбционные процессы
Сорбционные процессы Кремний и его соединения
Кремний и его соединения Сахароза
Сахароза Химические свойства кислот
Химические свойства кислот Комплексные соединения. Природа химической связи: метод молекулярных орбиталей
Комплексные соединения. Природа химической связи: метод молекулярных орбиталей Необоротні і оборотні хімічні процеси. Хімічна рівновага
Необоротні і оборотні хімічні процеси. Хімічна рівновага Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Физические свойства минералов
Физические свойства минералов Классификация химических реакций
Классификация химических реакций Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Цинк
Цинк Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Закон Авогадро. Молярный объем газов
Закон Авогадро. Молярный объем газов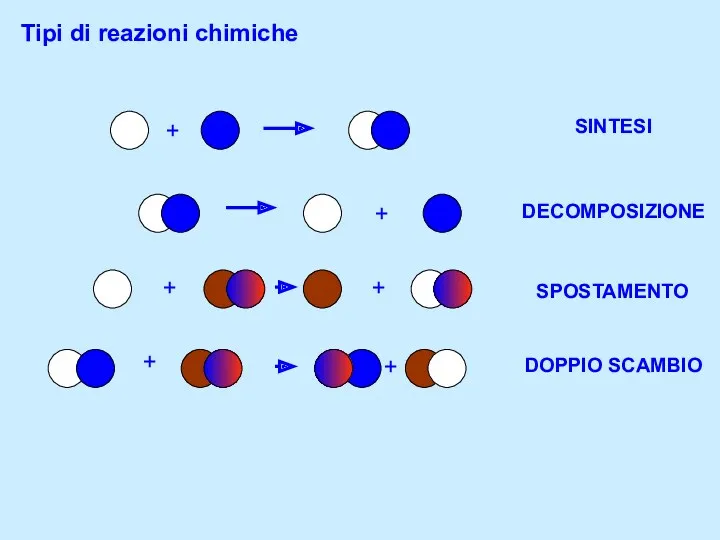 Tipi di reazioni chimiche
Tipi di reazioni chimiche Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции