Содержание
- 2. Алкани (насичені вуглеводні). Хімічні властивості алканів Вуглеводні – це найпростіші органічні сполуки, їх молекули містять лише
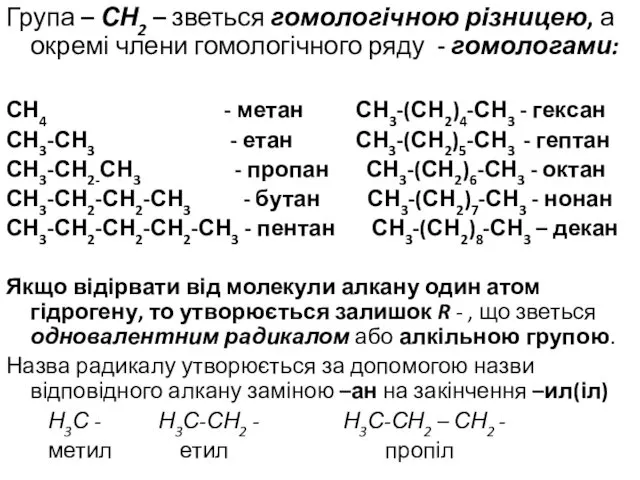
- 3. Група – СН2 – зветься гомологічною різницею, а окремі члени гомологічного ряду - гомологами: СН4 -
- 4. Алкани. Хімічні властивості. 1. Галогенування - це заміщення водневих атомів на атоми галогенів, є одною з
- 5. 2. Реакцій радикального заміщення алканів: а) Нітрування: За звичайної температури алкани не взаємодіють з концентрованою азотною
- 6. в) Сульфохлорування R – H + SO2 + Cl2 → R – SO2 – Cl +
- 7. 3. Горіння: При горінні всіх вуглеводнів утворюються диоксид вуглеводню і вода: СnH2n+2 + O2 → nCO2
- 8. Окремі представники алканів. Метан – (СН4) широко застосовується у промисловості як паливо. При частковій оксидації метану
- 9. Алкени. Хімічні властивості Ненасичені вуглеводні – це сполуки, що містять подвійні або потрійні (кратні) карбон -
- 10. Приєднання водню до ненасичених сполук називають гідруванням: Галогенірування (Реакційна здатність галогенів різко зменшується в ряду F2>Cl2>Br2>І2
- 11. 4. Алкени легко окиснюються водним розчином перманганату калію (Реакція Вагнера ): 5. При горінні алкенів також
- 12. Окремі представники алкенів Етилен (етен) – (СН2 = СН2) – безбарвний газ, у промисловості його добувають
- 13. Алкіни. Хімічні властивості Алкіни – це вуглеводні, що містять потрійний зв’язок С ≡С і мають загальну
- 14. 1.Реакції приєднання Приєднання відбувається в дві стадії. Спочатку утворюються сполуки етиленового ряду, а потім насичені вуглеводні
- 15. г)Приєднання нуклеофільних реагентів (Н2О, R – ОН, R СООН, НСN): реакція Кучерова (гідратація): - приєднання синильної
- 16. 2. Реакції заміщення: а) утворення ацетиленідів: б) галогенування:
- 17. 3. Полімеризація: Каталітичним окисенням поступово отримують бутадиин – 2,3 і т.д. аж до карбіну: НC ≡
- 18. Ароматичні вуглеводні Термін “ароматичні сполуки” виник ще на початку розвитку органічної хімії, коли органічні речовини поділяли
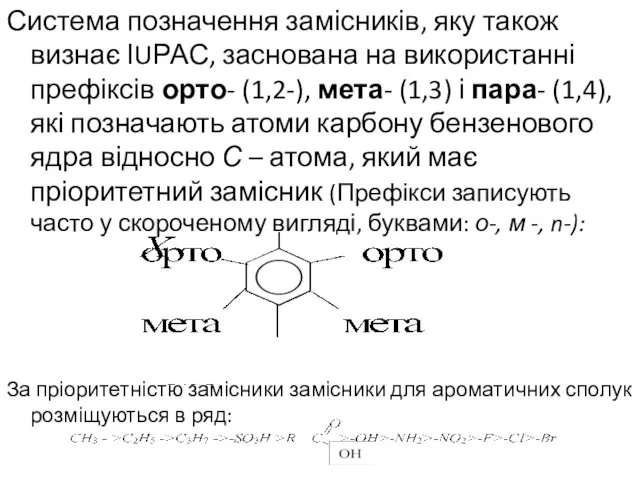
- 19. Система позначення замісників, яку також визнає ІUРАС, заснована на використанні префіксів орто- (1,2-), мета- (1,3) і
- 20. Розглянемо реакції електрофільного заміщення Алкілювання (реакція Фріделя-Крафтса): Нітрування: Сульфування (концентровану сірчану кислоту, олеум, оксид сірки (VI),
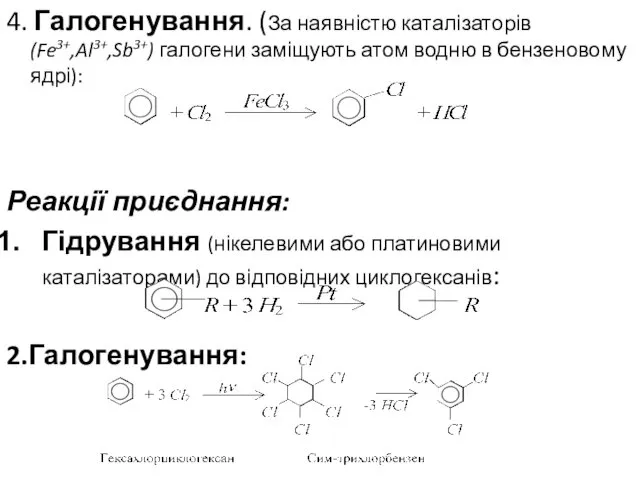
- 21. 4. Галогенування. (За наявністю каталізаторів (Fe3+,Al3+,Sb3+) галогени заміщують атом водню в бензеновому ядрі): Реакції приєднання: Гідрування
- 23. Скачать презентацию

















 Органічна хімія
Органічна хімія Аллотропные модификации углерода ( 8класс)
Аллотропные модификации углерода ( 8класс) Азотная кислота
Азотная кислота Типичные реакции органических соединений
Типичные реакции органических соединений Выдающиеся открытия в области химии
Выдающиеся открытия в области химии Общая химия
Общая химия Гидролиз солей
Гидролиз солей Галогены в Периодической системе Д.И. Менделеева
Галогены в Периодической системе Д.И. Менделеева Азот и его свойства
Азот и его свойства Генетическая классификация горных пород
Генетическая классификация горных пород Uses of chlorine and its compounds
Uses of chlorine and its compounds Atomic structure
Atomic structure Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Натуральный каучук
Натуральный каучук Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Роль ферментов в формировании потребительских свойств продовольственных товаров
Роль ферментов в формировании потребительских свойств продовольственных товаров Комплексні сполуки
Комплексні сполуки Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Предельные одноатомные спирты
Предельные одноатомные спирты Минерал хромдиопсид. Месторождения
Минерал хромдиопсид. Месторождения Основания. 8 класс
Основания. 8 класс Контроль качества лекарственных средств производных спиртов и альдегидов
Контроль качества лекарственных средств производных спиртов и альдегидов Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Предмет и история геохимии
Предмет и история геохимии Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Предмет органической химии
Предмет органической химии