Содержание
- 2. Количество вещества Вещество с количественной стороны можно охарактеризовать: с помощью массы 0,5 кг 3 кг с
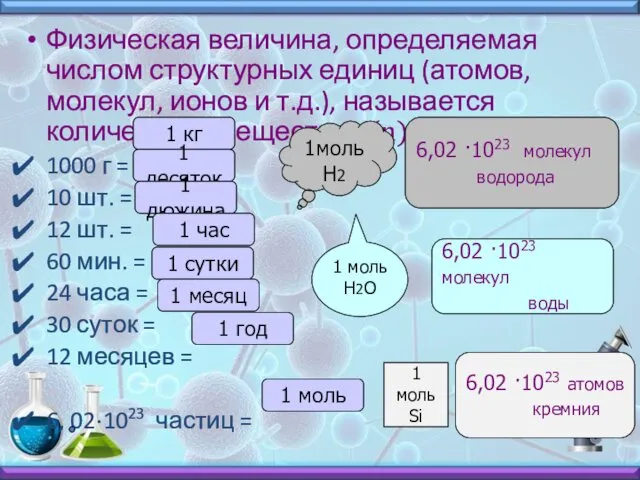
- 3. Физическая величина, определяемая числом структурных единиц (атомов, молекул, ионов и т.д.), называется количеством вещества ν(n). 1000
- 4. 1 моль любого вещества содержит 6,02 ·1023 частиц этого вещества 1 моль любого вещества = 6,02
- 5. 1 моль содержит 6,02 ·1023 частиц 2 моль = 6,02 ·10 23частиц ·2=12,04 ·10 23 частиц
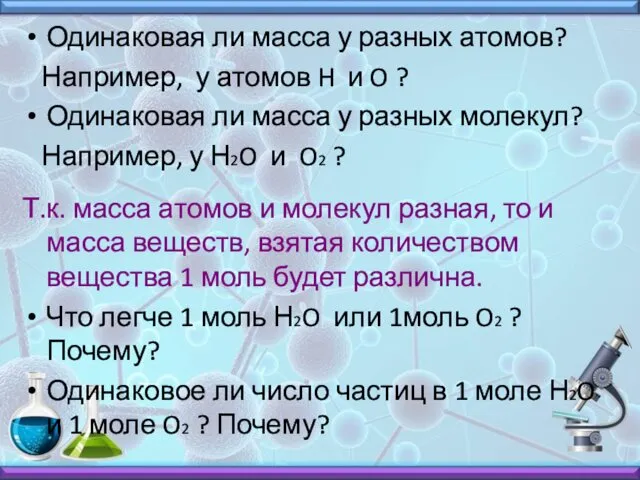
- 6. Одинаковая ли масса у разных атомов? Например, у атомов H и O ? Одинаковая ли масса
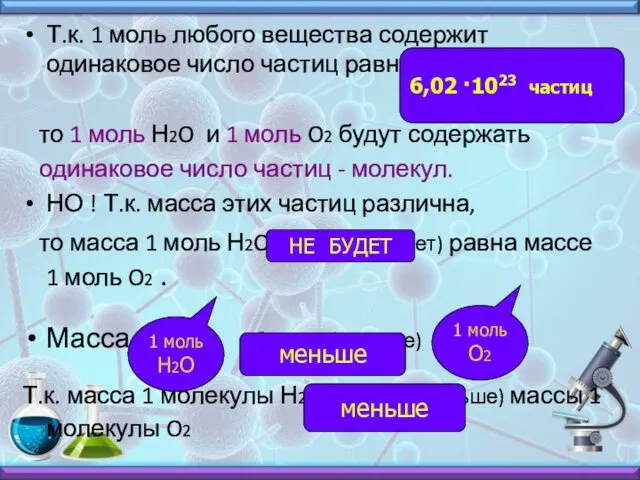
- 7. Т.к. 1 моль любого вещества содержит одинаковое число частиц равное (сколько?) , то 1 моль Н2O
- 8. Молярная масса вещества – это масса 1 моль вещества. Она численно совпадает с Mr – если
- 9. Упражнение №1 Какова масса магния, взятая количеством вещества 2 моль? Упражнение №2 Сколько атомов содержится в
- 10. Домашнее задание: прочитать § 36. Выполнить тестовые задания на стр. 122 и задания презентации 6-11. Упражнение
- 12. Скачать презентацию






 Презентация к уроку Технология 1 класс. Оригами.
Презентация к уроку Технология 1 класс. Оригами. Tema_2_Ponyatie_Chast_II
Tema_2_Ponyatie_Chast_II Устройство судна
Устройство судна Организация труда секретаря-референта в современной организации
Организация труда секретаря-референта в современной организации Алексей Николаевич Толстой 1882-1945гг
Алексей Николаевич Толстой 1882-1945гг Lapbook Templates
Lapbook Templates Развитие творческого потенциала у младших школьников корррекционной школы VIII вида
Развитие творческого потенциала у младших школьников корррекционной школы VIII вида ТЫЖ Программист
ТЫЖ Программист Расстройства местного кровообращения
Расстройства местного кровообращения Классный час на тему: Всемирный день защиты животных
Классный час на тему: Всемирный день защиты животных История фотоаппарата
История фотоаппарата Дорожные знаки. Художественное творчество (рисование) в подготовительной группе Добрые сердца
Дорожные знаки. Художественное творчество (рисование) в подготовительной группе Добрые сердца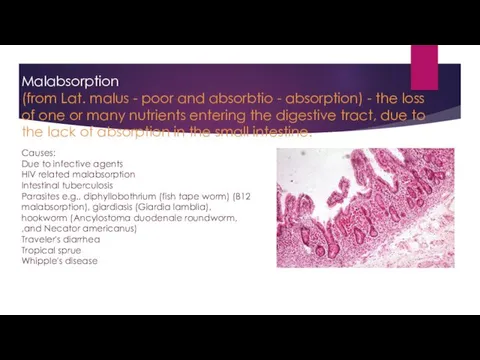 Malabsorption
Malabsorption Презентация Книжки-малышки
Презентация Книжки-малышки павлов
павлов день космонавтики
день космонавтики Все о возражениях и сомнениях клиента в настоящем периоде
Все о возражениях и сомнениях клиента в настоящем периоде Рахит. Этиология, патогенез, клиника, диагностика, лечение, профилактика
Рахит. Этиология, патогенез, клиника, диагностика, лечение, профилактика Writing an article
Writing an article Стоматологические индексы
Стоматологические индексы Излучение и спектры
Излучение и спектры Ориентирование подземных выработок
Ориентирование подземных выработок Урок географии по теме Воды суши. Реки.
Урок географии по теме Воды суши. Реки. консультация - презентация для родителей и педагогов Учимся произносить звук Р
консультация - презентация для родителей и педагогов Учимся произносить звук Р Последствия курения (кл.час)
Последствия курения (кл.час) Наполнение регионального репозитория образовательным контентом
Наполнение регионального репозитория образовательным контентом Викторина 8-б класс
Викторина 8-б класс Возрастные особенности третьеклассника
Возрастные особенности третьеклассника