Содержание
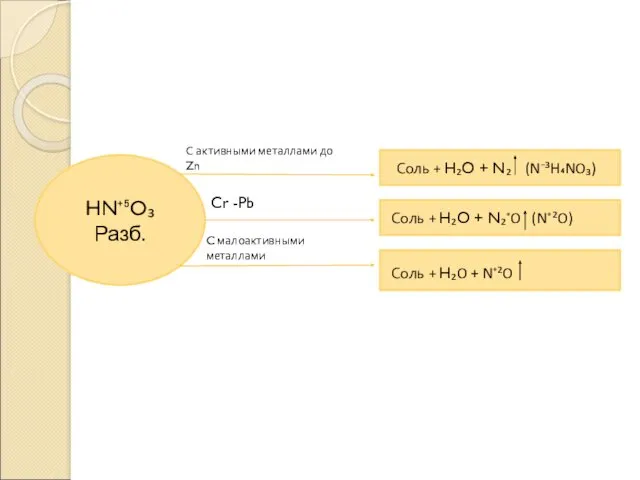
- 2. HN⁺⁵O₃ Разб. С активными металлами до Zn Cr -Pb C малоактивными металлами Соль + H₂O +
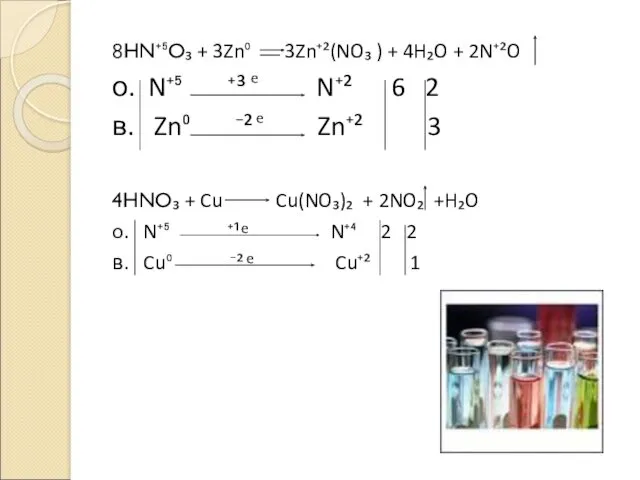
- 3. 8HN⁺⁵O₃ + 3Zn⁰ 3Zn⁺²(NO₃ ) + 4H₂O + 2N⁺²O о. N⁺⁵ ⁺³ N⁺² 6 2 в.
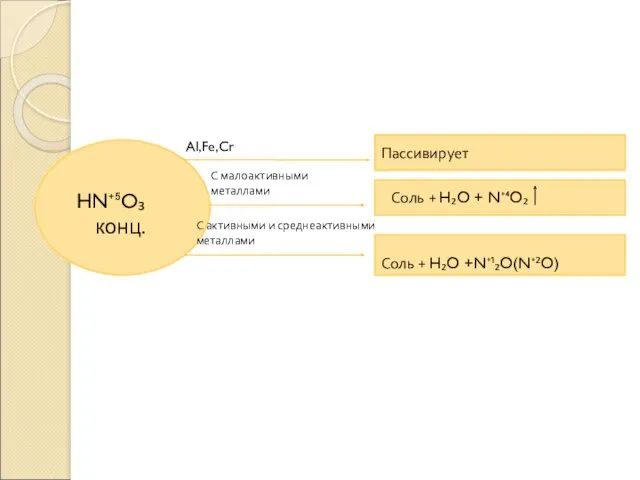
- 4. HN⁺⁵O₃ конц. Al,Fe,Cr С малоактивными металлами С активными и среднеактивными металлами Пассивирует Соль + H₂O +
- 5. Ag⁰ + HN⁺⁵O₃ Ag⁺¹NO₃ + H₂O + N⁺⁴O₂ в. Ag⁰ ⁻¹ Ag⁺¹ 1 1 о. N⁺⁵
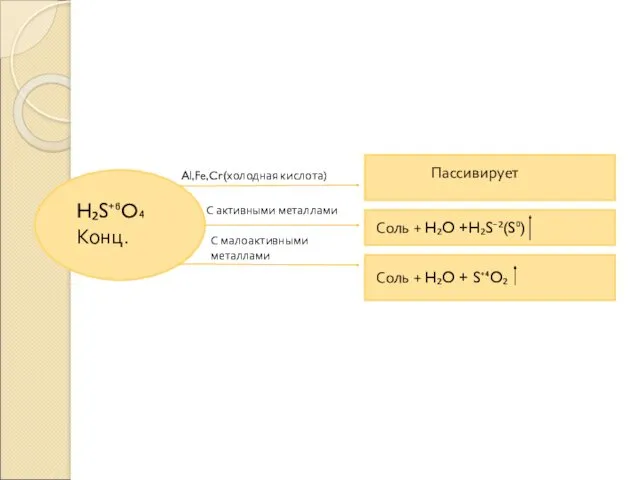
- 6. H₂S⁺⁶O₄ Конц. Al,Fe,Cr(холодная кислота) С активными металлами С малоактивными металлами Пассивирует Соль + H₂O +H₂S⁻²(S⁰) Соль
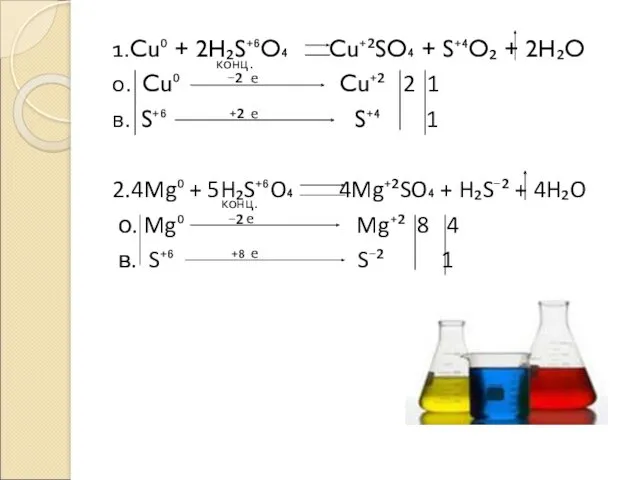
- 7. 1.Cu⁰ + 2H₂S⁺⁶O₄ Cu⁺²SO₄ + S⁺⁴O₂ + 2H₂O о. Cu⁰ ⁻² Cu⁺² 2 1 в. S⁺⁶
- 8. Вывод: Окислительные свойства HNO₃ и конц.H₂SO₄ объясняются тем, что восстанавливаются не ионы H⁺, а атомы N⁺⁵
- 10. Скачать презентацию


 Материки и части света. Урок путешествие для 5-х классов
Материки и части света. Урок путешествие для 5-х классов Организация работы отделения физиотерапии и восстановительного лечения
Организация работы отделения физиотерапии и восстановительного лечения Бездомные животные
Бездомные животные Общее Равновесие в Закрытой Экономике (модель IS-LM)
Общее Равновесие в Закрытой Экономике (модель IS-LM) Презентация к теме Азот и его соединения
Презентация к теме Азот и его соединения Основные определения
Основные определения Презентация для старших дошкольников День Победы.
Презентация для старших дошкольников День Победы. Военные поселения. Александр 1
Военные поселения. Александр 1 Врожденные пороки сердца у детей (ВПС)
Врожденные пороки сердца у детей (ВПС) Антисептика
Антисептика Системное моделирование психических процессов на примере формирования конструктивной психологической защиты
Системное моделирование психических процессов на примере формирования конструктивной психологической защиты Создание ситуации успеха
Создание ситуации успеха Основные положения теории налога
Основные положения теории налога Презентация к литературно-музыкальной композиции Поклонимся великим тем годам!
Презентация к литературно-музыкальной композиции Поклонимся великим тем годам! Розвиток радіо й телебачення
Розвиток радіо й телебачення Линейные системы авторегулирования с цифровым регулятором. (Лекция 5)
Линейные системы авторегулирования с цифровым регулятором. (Лекция 5) Совершенствование системы адаптации сотрудников и её влияние на устойчивость персонала ПАО МинБанк
Совершенствование системы адаптации сотрудников и её влияние на устойчивость персонала ПАО МинБанк Модифицированные битумы. (Тема 8)
Модифицированные битумы. (Тема 8) Животноводство
Животноводство Целевая ориентация управленческих решений
Целевая ориентация управленческих решений Лекция №6_Биполярные транзисторы ПВ1
Лекция №6_Биполярные транзисторы ПВ1 Биохимия крови-1. Функции крови
Биохимия крови-1. Функции крови Презентация Почему блин круглый
Презентация Почему блин круглый Города-герои
Города-герои Благородные металлы
Благородные металлы Лексический контент для детей старшего дошкольного возраста. Санкт-Петербург. Мосты северной столицы
Лексический контент для детей старшего дошкольного возраста. Санкт-Петербург. Мосты северной столицы Презентация Планирование образовательного процесса
Презентация Планирование образовательного процесса Упругий режим
Упругий режим