Содержание
- 2. Цель: Определить положение серы в периодической системе химических элементов Д.И. Менделеева; Рассмотреть строение атома серы, физические
- 3. «В древней магии присутствую при рождении огня, называют серой издавна меня»
- 4. Сера. Строение атома, аллотропия, свойства и применение серы.
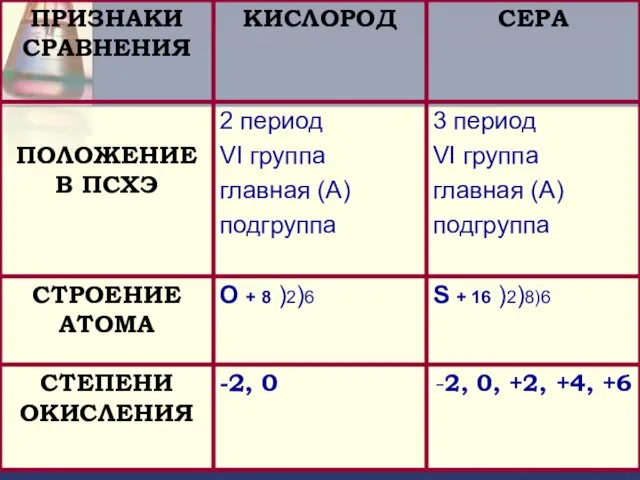
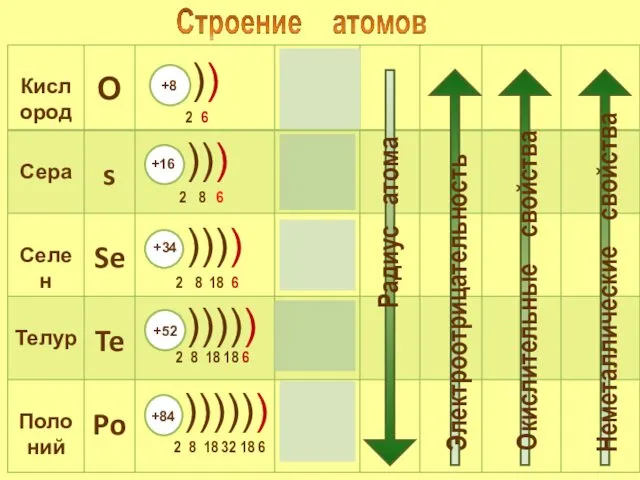
- 5. Визитка химического элемента. Химический знак - S Порядковый номер – 16 Аr - 32.066 Период -
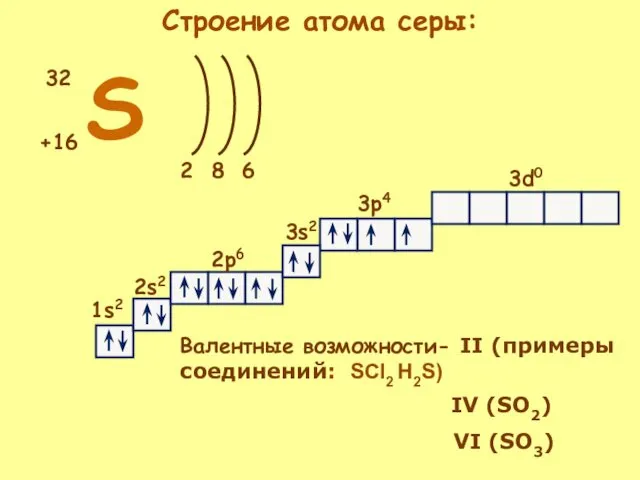
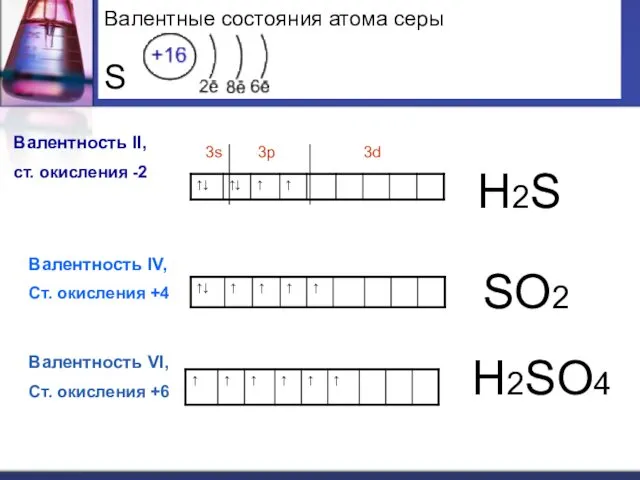
- 9. S +16 32 2 6 8 1s2 2s2 2p6 3s2 3p4 3d0 Валентные возможности- II (примеры
- 10. Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст.
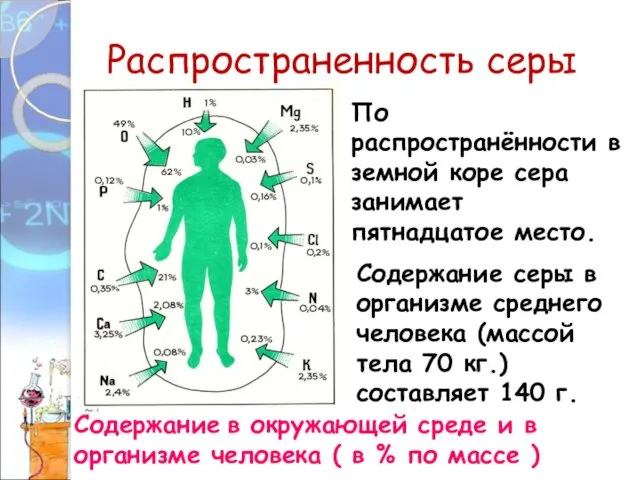
- 11. Распространенность серы Содержание в окружающей среде и в организме человека ( в % по массе )
- 12. Нахождение серы в природе. Сера в природе Самородная сера -S Сульфиды Пирит –FeS2 Сульфаты Гипс-СаSO4*2H2O Мирабилит
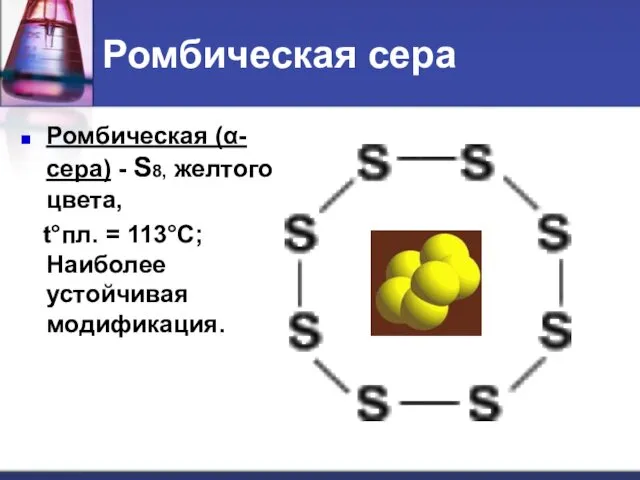
- 14. Ромбическая сера Ромбическая (α-сера) - S8, желтого цвета, t°пл. = 113°C; Наиболее устойчивая модификация.
- 15. Физические свойства серы Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (порошок серы
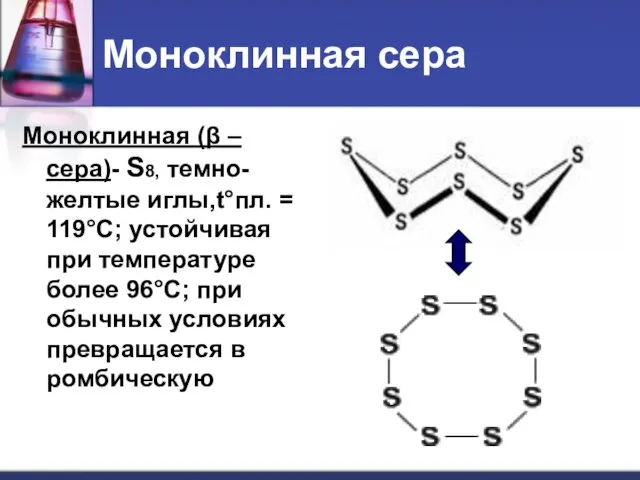
- 16. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы,t°пл. = 119°C; устойчивая при температуре более 96°С; при
- 17. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
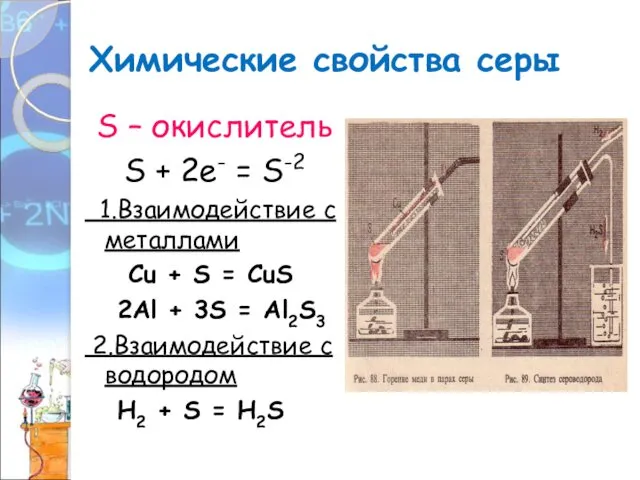
- 18. Химические свойства серы S – окислитель S + 2е- = S-2 1.Взаимодействие с металлами Сu +
- 19. Химические свойства серы. S – восстановитель S – 2e- = S+2 S - 4e- = S+4
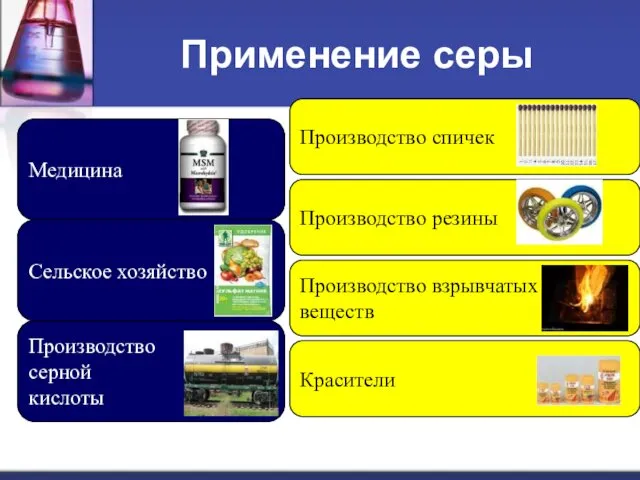
- 20. Применение серы Медицина Производство серной кислоты Сельское хозяйство Производство спичек Производство резины Производство взрывчатых веществ Красители
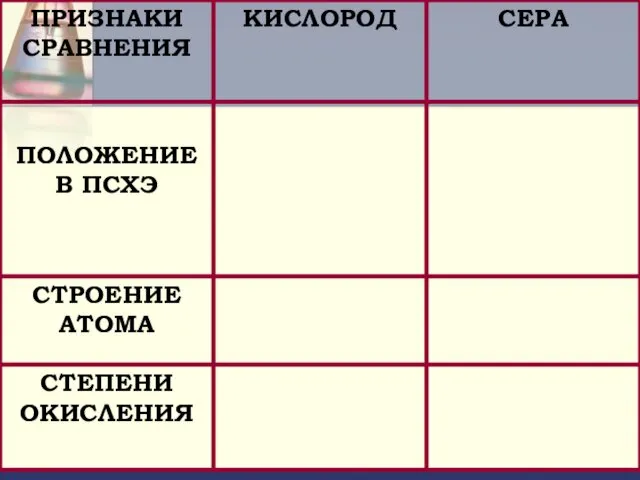
- 21. ОТВЕТЬТЕ НА ВОПРОСЫ: Охарактеризуйте положение серы в периодической системе химических элементов Д.И. Менделеева.
- 22. Выберите правильный ответ: В каком соединении сера проявляет степень окисления +4? А) H2S Б) H2SO3 В)
- 23. ОТВЕТЬТЕ НА ВОПРОСЫ: В каком виде сера находится в природе?
- 24. ОТВЕТЬТЕ НА ВОПРОСЫ: Охарактеризуйте физические свойства серы.
- 26. Скачать презентацию












 Материки и части света. Урок путешествие для 5-х классов
Материки и части света. Урок путешествие для 5-х классов Организация работы отделения физиотерапии и восстановительного лечения
Организация работы отделения физиотерапии и восстановительного лечения Бездомные животные
Бездомные животные Общее Равновесие в Закрытой Экономике (модель IS-LM)
Общее Равновесие в Закрытой Экономике (модель IS-LM) Презентация к теме Азот и его соединения
Презентация к теме Азот и его соединения Основные определения
Основные определения Презентация для старших дошкольников День Победы.
Презентация для старших дошкольников День Победы. Военные поселения. Александр 1
Военные поселения. Александр 1 Врожденные пороки сердца у детей (ВПС)
Врожденные пороки сердца у детей (ВПС) Антисептика
Антисептика Системное моделирование психических процессов на примере формирования конструктивной психологической защиты
Системное моделирование психических процессов на примере формирования конструктивной психологической защиты Создание ситуации успеха
Создание ситуации успеха Основные положения теории налога
Основные положения теории налога Презентация к литературно-музыкальной композиции Поклонимся великим тем годам!
Презентация к литературно-музыкальной композиции Поклонимся великим тем годам! Розвиток радіо й телебачення
Розвиток радіо й телебачення Линейные системы авторегулирования с цифровым регулятором. (Лекция 5)
Линейные системы авторегулирования с цифровым регулятором. (Лекция 5) Совершенствование системы адаптации сотрудников и её влияние на устойчивость персонала ПАО МинБанк
Совершенствование системы адаптации сотрудников и её влияние на устойчивость персонала ПАО МинБанк Модифицированные битумы. (Тема 8)
Модифицированные битумы. (Тема 8) Животноводство
Животноводство Целевая ориентация управленческих решений
Целевая ориентация управленческих решений Лекция №6_Биполярные транзисторы ПВ1
Лекция №6_Биполярные транзисторы ПВ1 Биохимия крови-1. Функции крови
Биохимия крови-1. Функции крови Презентация Почему блин круглый
Презентация Почему блин круглый Города-герои
Города-герои Благородные металлы
Благородные металлы Лексический контент для детей старшего дошкольного возраста. Санкт-Петербург. Мосты северной столицы
Лексический контент для детей старшего дошкольного возраста. Санкт-Петербург. Мосты северной столицы Презентация Планирование образовательного процесса
Презентация Планирование образовательного процесса Упругий режим
Упругий режим