Бор, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение презентация
Содержание
- 2. Бор Электронная формула 1s22s22p1. На внешнем электронном уровне 3 электрона, что и определяет валентность 3 Наличие
- 3. Общие сведения Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около
- 4. Mg2B3+HCl B2H6 + B4H10 + B5H9 + B5H11 + B6H10 + B10H14 2BCl3+ 3RMgX RBCl2 +
- 5. Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических
- 6. B2H6 + O2 B2O3 + 3H2O + 2033 кДж/моль Химические свойства По химическим свойствам бораны близки
- 7. Химические свойства Химические свойства эфиров борной кислоты во многом схожи со свойствами эфиров ортокремниевой, ортотитановой и
- 8. История открытия В начале XVII века из буры было получено вещество, которое позже стали называть борной
- 10. Скачать презентацию







 Поливинилхлорид
Поливинилхлорид Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Своя игра по химии
Своя игра по химии Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Азот
Азот Полимерные материалы. Пластические массы и строительные материалы на их основе
Полимерные материалы. Пластические массы и строительные материалы на их основе Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Спектроскопия лазерных кристаллов
Спектроскопия лазерных кристаллов Огнетушащие средства и механизмы прекращения горения ими. Тема-8
Огнетушащие средства и механизмы прекращения горения ими. Тема-8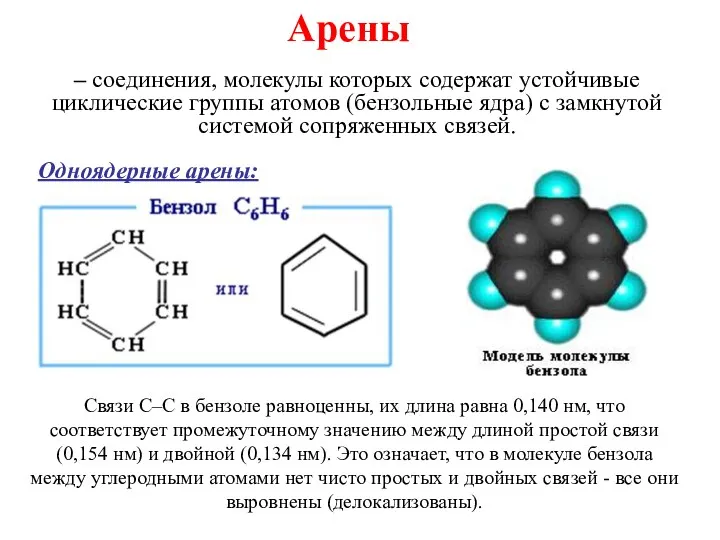 Ароматические углеводороды
Ароматические углеводороды Типы химических реакций
Типы химических реакций Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7)
Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7) Химия селена и теллурар
Химия селена и теллурар Характеристика хімічного елемента Hg
Характеристика хімічного елемента Hg Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Мембранное материаловедение
Мембранное материаловедение Коррозия металлов
Коррозия металлов Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Три кити нанохімії
Три кити нанохімії Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Щелочные металлы
Щелочные металлы Кислоты: названия, получение, свойства, применение
Кислоты: названия, получение, свойства, применение Химические свойства металлов
Химические свойства металлов Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу