Содержание
- 2. Ура, листок! 10 увлекательных задач Сдать до начала каникул За каждую не сданную задачу - 2
- 3. Однородные Кристаллизация Дистилляция Хроматография Выпаривание При нагревании растворитель испаряется, а растворённое вещество выпадает в осадок. Смеси
- 4. Однородные Кристаллизация Дистилляция Хроматография Выпаривание Часто вещество само кристаллизуется из раствора, без дополнительного выпаривания. Смеси
- 5. Однородные Кристаллизация Дистилляция Хроматография Выпаривание Дистилляция (перегонка) – метод разделения однородных смесей, основанный на их различающихся
- 6. Однородные Кристаллизация Хроматография Выпаривание Дистилляция Хромотография - метод разделения, анализа. Обычно основана на распределении исследуемого вещества
- 7. Привести 5 примеров веществ и 5 материалов. Попробуйте придумать что-нибудь интересное. Вы добавили в борщ слишком
- 8. Однородные Кристаллизация Хроматография Выпаривание Дистилляция Хромотография - метод разделения, анализа. Обычно основана на распределении исследуемого вещества
- 9. Хроматография
- 10. Явление - вообще всякое обнаруживаемое проявление чего-нибудь (Словарь Ожегова). Физическое явление – такие явления, при которых
- 11. Для химических реакций характерно следующие: Выделение теплоты и/или света Смешивание серной кислоты и воды Признаки химических
- 12. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание 2KMnO4 + H2O2
- 13. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание Появление запаха NH4OH-->
- 14. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание Появление запаха Образование
- 15. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание Появление запаха Образование
- 16. 1. Приведение веществ в тесное соприкосновение (измельчение, перемешивание, растворение) . 2. Нагревание веществ до определённой температуры.
- 17. 1. Приведение веществ в тесное соприкосновение (измельчение, перемешивание, растворение) . 2. Нагревание веществ до определённой температуры.
- 18. ХИМИЯ 8 класс Атомы и молекулы. Простые и сложные вещества. Мария Дмитриевна Смирнова Smirnova@sch2101.ru Vk.com/masha2101
- 19. Вещества бывают молекулярного и немолекулярного строения. Молекулярные соединения Немолекулярные соединения NaCl K2SO4 LiH CaO CH4 H2O
- 20. H2O, жидкость Mg2SiO2 Кристаллическое вещество Молекулярное вещество Молекулярные и немолекулярные вещества
- 21. H2O, жидкость H2O, лёд Кристаллическое вещество Молекулярное вещество Молекулярные и немолекулярные вещества
- 22. В твёрдых и жидких телах существует упорядоченность во взаимном расположении атомов или молекул. Упорядоченность на расстояниях,
- 23. Дальний порядок Ближний порядок Безпорядок Порядок
- 24. Простые и сложные вещества Состоит только из себя Является сочетанием
- 25. Если вещество можно разложить на другие вещества – оно является сложным. Сложные вещества – такие вещества,
- 26. Различие смесей и химических соединений
- 27. Химический элемент – определенный тип атомов. Химический элемент – это вид атомов с определённым зарядом ядра.
- 28. Почти все символы для химических элементов придумал Якоб Берцелиус. Он предложил присваивать символ по первой букве
- 29. Символы химических элементов Алхимические символы 1 — олово; 2 — свинец; 3 — золото; 4 —
- 30. Названия химических элементов
- 31. Названия химических элементов
- 32. Названия химических элементов
- 33. 8 22.09.2016 Символы химических элементов
- 34. Одной из характеристик атома является его масса. Только она очень мала, масса атома С – 1.99*10-23г.
- 35. С имеет массу 12 а.е.м. Давайте посчитаем, какая масса у Н и О в а.е.м. Мн=
- 36. Относительная атомная масса элемента Аr показывает, во сколько раз масса его атома больше двенадцатой части атома
- 37. Относительная атомная масса элемента Аr показывает, во сколько раз масса его атома больше двенадцатой части атома
- 38. 2H2 + O2 = 2H2O Массы водорода и кислорода должны относиться как 1:8 для задействование всего
- 39. H2O Эта формула означает, что на 1 атом кислорода приходится 2 атома кислорода. Относительная атомная масса
- 40. Получается, что в каких пропорциях ни возьми H и О образуется вода (Н2О). А значит химический
- 41. Определить массу серы, реагирующей без остатка с 5 г медных опилок, если медь и сера в
- 42. Если химическое вещество имеет постоянный состав, то его можно выразить через химическую формулу. Химическая формула –
- 43. 6Fe(OH)3 3 SnO2 10HNO3 Индексы Коэффициенты Химические формулы
- 45. Скачать презентацию










































 Химические свойства спиртов. Химические свойства предельных одноатомных спиртов
Химические свойства спиртов. Химические свойства предельных одноатомных спиртов Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Классификация химических реакций
Классификация химических реакций Чисті речовини і суміші
Чисті речовини і суміші Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Фторопласт-4 (тефлон, політетрафлуоретен)
Фторопласт-4 (тефлон, політетрафлуоретен) Электролитическая диссоциация
Электролитическая диссоциация Химическая связь
Химическая связь Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Технология лаков и красок
Технология лаков и красок Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Основы кристаллографии
Основы кристаллографии Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)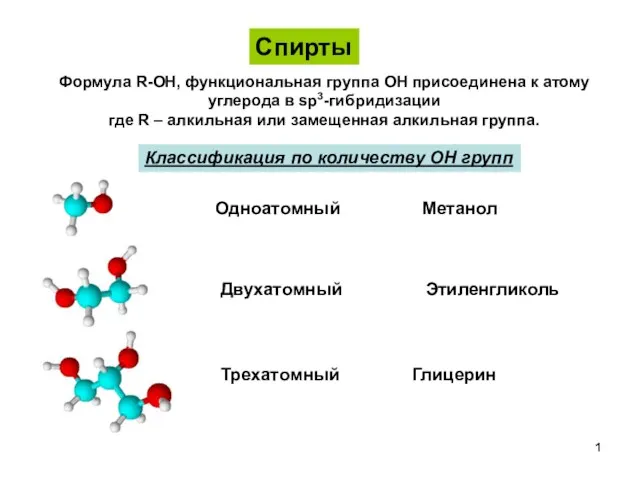 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Неметаллы. Занятие 20
Неметаллы. Занятие 20 Гидролиз солей
Гидролиз солей Хімічні явища у природі
Хімічні явища у природі Циклоалканы. Предельные углеводороды
Циклоалканы. Предельные углеводороды Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Ионоселективные электроды
Ионоселективные электроды