Содержание
- 2. Задачи урока: Закрепить умения применять понятие «степень окисления» на практике. Обобщить и дополнить знания об опорных
- 3. Окислитель и восстановитель Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. Восстановителем называют реагент,
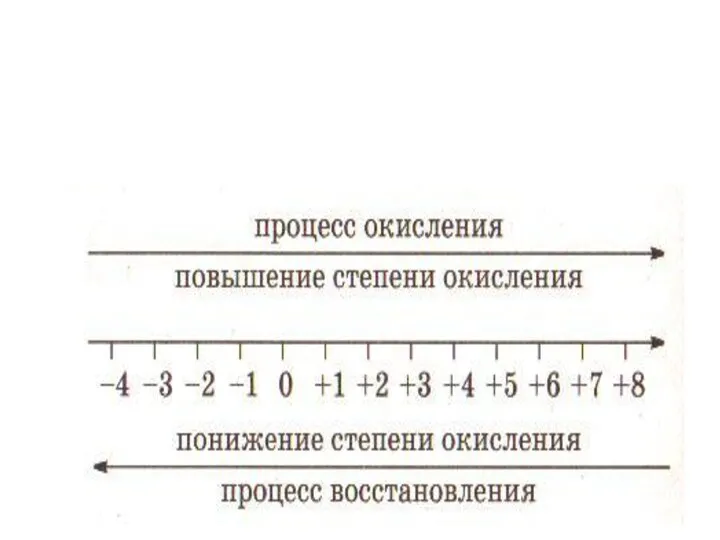
- 4. ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением
- 6. Какие из перечисленных ниже процессов представляют собой: окисление (0), какие – восстановление (В)?
- 8. Правила определения функции соединения в окислительно-восстановительных реакциях. 1. Если элемент проявляет в соединении высшую степень окисления,
- 9. 1.Установите соответствие между свойствами серы и уравнением ОВР, в котором она проявляет эти свойства. Свойства серы
- 10. Ответы: 1. 4312 2. 4652
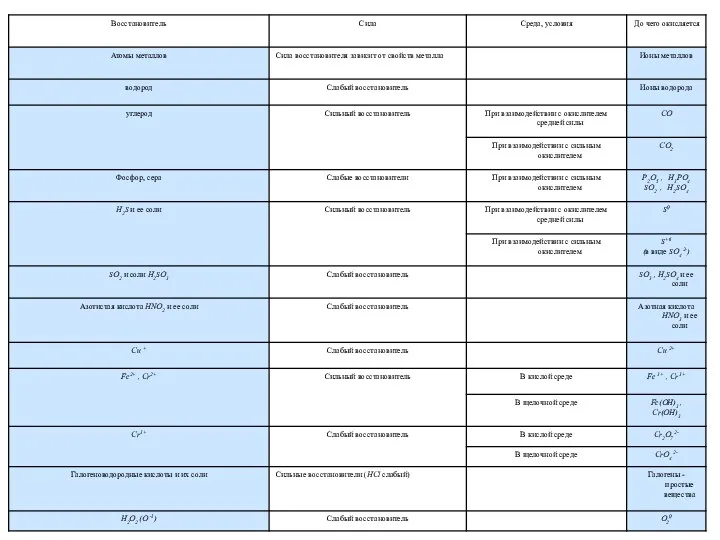
- 11. Основные окислители и восстановители
- 12. Основные окислители и восстановители
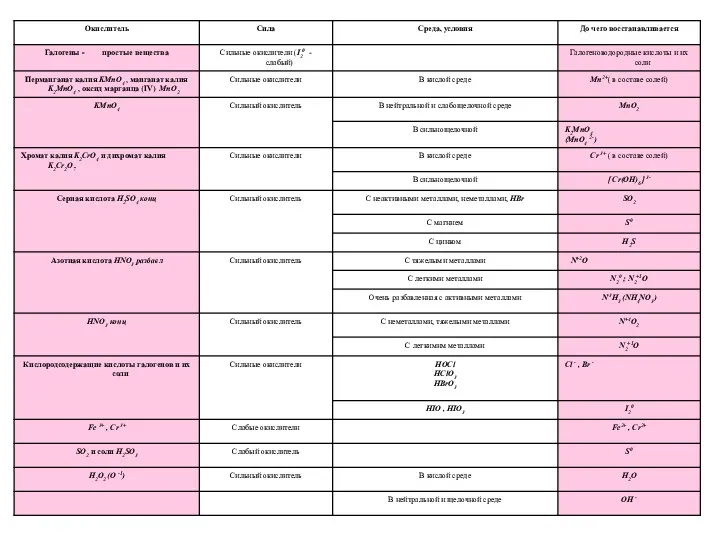
- 14. Сильным и достаточно распространенным окислителем является перманганат калия, который в различных средах восстанавливается до соединений марганца
- 15. Классификация ОВР 1 . Межмолекулярные реакции- реакции , которые идут с изменением степеней окисления атомов в
- 16. 2 . Внутримолекулярные реакции – реакции, в которых атомы, изменяющие свои степени окисления, находятся в одной
- 17. Реакции диспропорционирования (самоокисления-самовосстановления) –реакции , которые идут с изменением степени окисления атомов одного и того же
- 18. Реакции компропорционирования – те, в которых атомы одного и того же элемента в различных с.о. в
- 19. Межмолекулярные реакции: Частицы- доноры электронов (восстановители) – и частицы- акцепторы электронов (окислители) – находятся в разных
- 20. Внутримолекулярные реакции Донор электронов - восстановитель и акцептор электронов – окислитель – находятся в одном и
- 21. Реакции диспропорционирования (самоокисления-самовосстановления) Атомы одного и того же элемента в веществе выполняют одновременно функции и доноров
- 22. Составление окислительно-восстановительных реакций в заданиях ЕГЭ часть С1 Схемы с пропусками веществ 1)Ключевые вещества не пропущены
- 23. 1. Указаны формулы окислителя и восстановителя, а также формулы продуктов их восстановления и окисления. 2. Составление
- 24. Ответ: N+2 - 3ē → N+5 2 окисляется, N+2 - восстановитель Cl+1 + 2ē → Cl-1
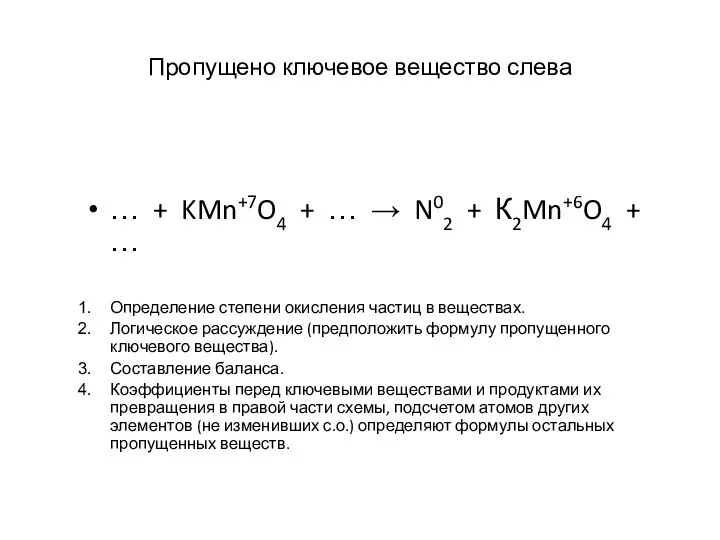
- 25. Пропущено ключевое вещество слева … + KMn+7O4 + … → N02 + К2Mn+6O4 + … Определение
- 26. Ответ: 2 N-3 - 6ē → N02 1 окисляется, N-3 - восстановитель Mn+7 + ē →
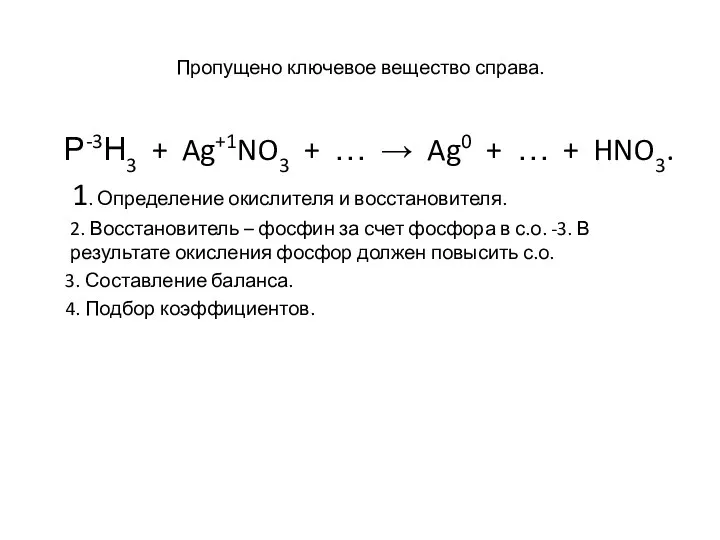
- 27. Пропущено ключевое вещество справа. Р-3Н3 + Ag+1NO3 + … → Ag0 + … + HNO3. 1.
- 28. Ответ: Р-3Н3 + Ag+1NO3 + … → Ag0 + Н3РО4 + HNO3. Р-3 - 8ē →
- 29. Задания для самостоятельной работы 1. Используя метод электронного баланса, составьте уравнение реакции: Pt + HNO3 +
- 30. Ответы: 1. Pt + HNO3 + HCl → PtCl4 + NO↑ + … 3 Pt +
- 32. Скачать презентацию
























 Номенклатура органических соединений
Номенклатура органических соединений Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі Иониты и цеолиты. Цеолитные катализаторы
Иониты и цеолиты. Цеолитные катализаторы Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Кислородные соединения азота
Кислородные соединения азота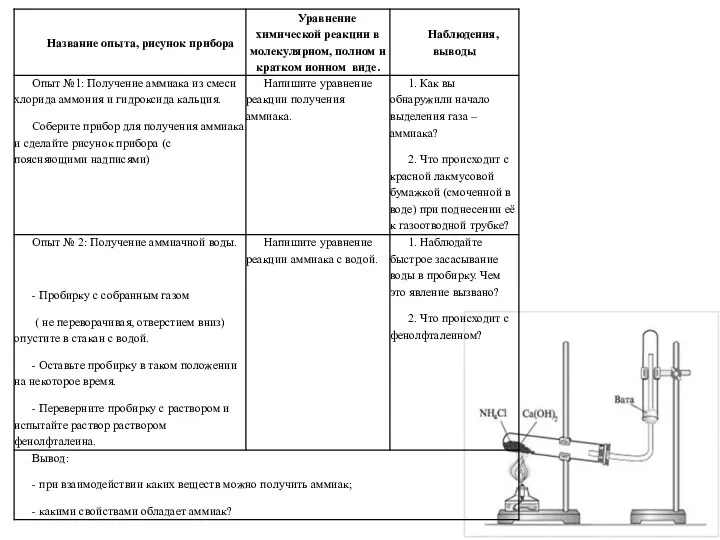 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Основи. Загальна формула основ
Основи. Загальна формула основ Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Химические источники тока. Электролиз
Химические источники тока. Электролиз Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) Основные понятия химии
Основные понятия химии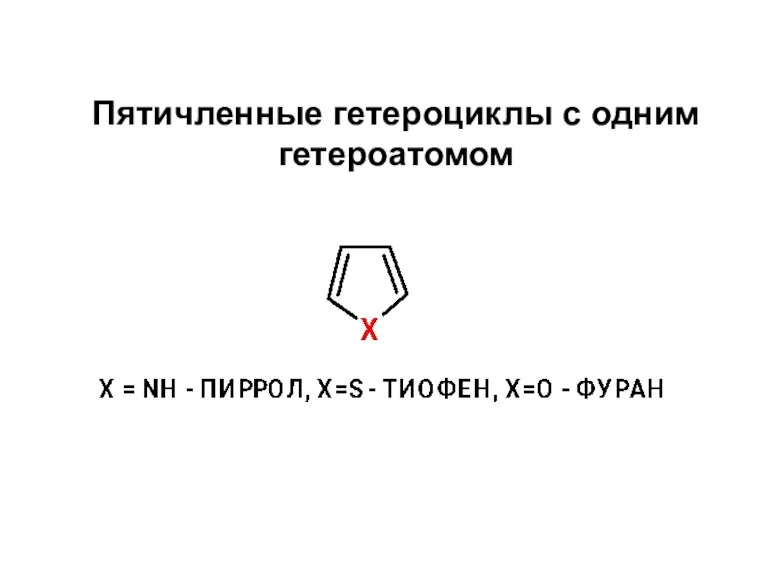 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Общая и неорганическая химия
Общая и неорганическая химия Bioorganic chemistry
Bioorganic chemistry Алкины. Характеристика тройной связи
Алкины. Характеристика тройной связи Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен
Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Introduction to Biochemistry
Introduction to Biochemistry Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Философы химии Кант и Гегель
Философы химии Кант и Гегель Урок 25
Урок 25 Классификация органических соединений
Классификация органических соединений