Содержание
- 2. Модели атома Модель атома Томсона Модель атома Резерфорда Модель атома Бора
- 3. Модель атома Томсона «Пудинг с изюмом» Джозеф Томсон (1856 -1940), английский учёный, в 1897г. открыл электрон,
- 4. Модель атома Резерфорда Так должно было происходить рассеяние α-частиц в атоме Томсона Такое рассеяние α-частиц наблюдал
- 5. - Сравнение размеров ядра и электрона Сравните соотношение размеров ядра и электрона в атоме
- 6. Модель атома Бора Построена на основе Планетарной модели Резерфорда, приправленной квантовыми постулатами: 1 постулат: Электрон может
- 7. Корпускулярно-волновые свойства микромира Элементарные частицы имеют ничтожно малые массы и размеры, поэтому обладают особыми свойствами. Квантовая
- 8. Протонно-нейтронная теория В 1932 г была разработана протонно-нейтронная теория строения атомного ядра. Итак: Ядро состоит из
- 9. Строение ядра Аr = 1 Аr = 4 Аr = 7 Протон – масса = 1,
- 10. Что произойдет, если изменится число протонов в ядре? Изменение числа протонов в ядре приведет к образованию
- 11. Что произойдет, если изменится число нейтронов в ядре атома? Изменение числа нейтронов в атоме приведет к
- 12. Изотопы Протий Дейтерий Тритий 1+ 3
- 13. Повторим Какие модели строения атома Вам известны? В чем их несостоятельность? Какие постулаты предложил Н. Бор?
- 14. СОСТОЯНИЕ ЭЛЕКТРОНА В АТОМЕ Квантовые числа. Принципы заполнения электронных оболочек атомов электронами.
- 15. Важнейшие понятия Состояние электрона в атоме - это совокупность информации об энергии определенного электрона и пространстве,
- 16. Электронное облако
- 17. Формы атомных орбиталей Сферическая форма (S – электронная орбиталь) Форма объемной восьмерки (p – электронная орбиталь)
- 18. Квантовые числа Совокупность сложных движений электрона в атоме характеризуются квантовыми числами. Различают: n – главное квантовое
- 19. Главное квантовое число (n) Характеризует общую энергию электрона данного энергетического уровня. Принимает целые значения: 1,2,3… Главное
- 20. Побочное квантовое число (l) Характеризует запас энергии электрона в пределах энергетического уровня. Принимает значения от 0
- 21. Магнитное квантовое число ml Характеризует распределение орбиталей в магнитном поле ядра. Зависит от побочного квантового числа.
- 22. Магнитное спиновое квантовое число (ms) Это собственный момент импульса электрона. Может принимать значения: -1/2 или +1/2
- 23. Задание Опишите состояние электронов в атоме химического элемента №8, используя все квантовые числа.
- 24. Принципы заполнения электронных оболочек Принцип наименьшей энергии. Принцип Паули. Правило Хунда Правило Клечковского. Задание: Напишите электронную
- 25. Принцип наименьшей энергии Электрон занимает тот энергетический уровень, тот подуровень, ту атомную орбиталь, которым соответствует минимальный
- 26. Принцип Паули В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором
- 27. Правило Хунда Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное спиновое
- 28. Спин электрона Вращение по часовой стрелке – положительный спин Вращение против часовой стрелки – отрицательный спин
- 29. Правило Клечковского Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантового
- 30. Электронная формула атома и ее графическое изображение у элементов первого периода Н 1S1 Номер уровня Форма
- 31. Элементы второго периода Li 1S2 2S1 Be 1S2 2S2 B 1S2 2S2 2p1 C 1S2 2S2
- 32. Na Строение атома натрия 2S2 2p6 3S1 1S2
- 34. Скачать презентацию































 Номенклатура органических соединений
Номенклатура органических соединений Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі Иониты и цеолиты. Цеолитные катализаторы
Иониты и цеолиты. Цеолитные катализаторы Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Кислородные соединения азота
Кислородные соединения азота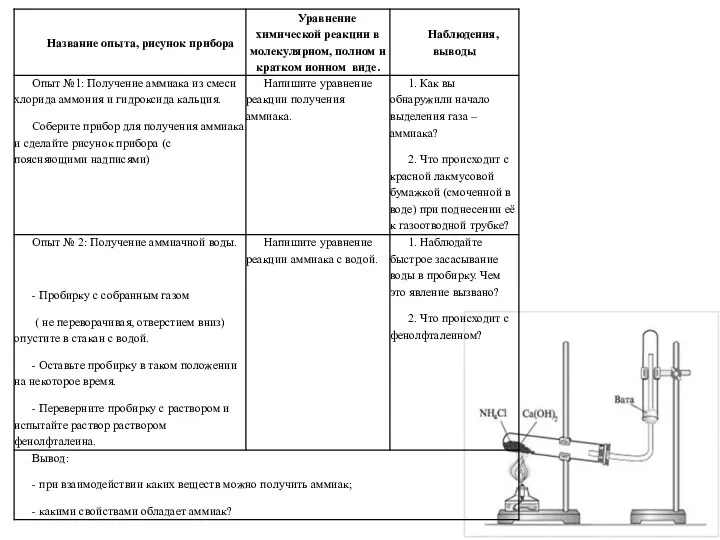 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Основи. Загальна формула основ
Основи. Загальна формула основ Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Химические источники тока. Электролиз
Химические источники тока. Электролиз Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) Основные понятия химии
Основные понятия химии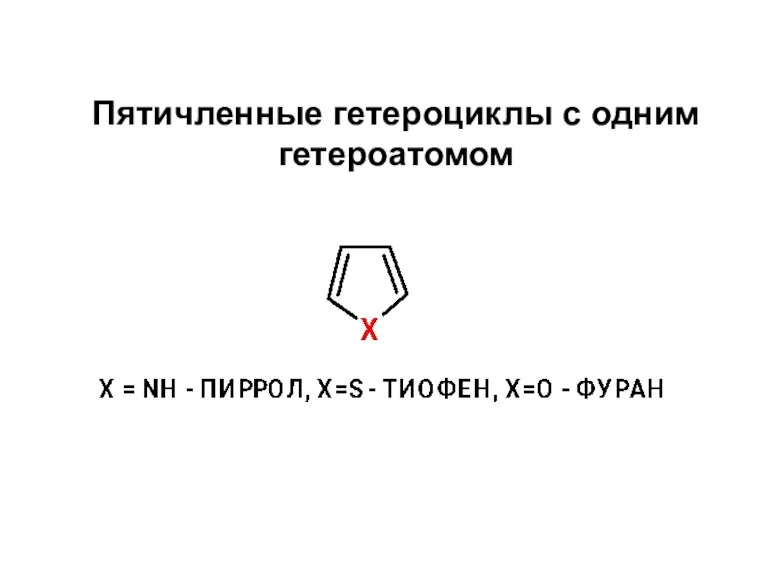 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Общая и неорганическая химия
Общая и неорганическая химия Bioorganic chemistry
Bioorganic chemistry Алкины. Характеристика тройной связи
Алкины. Характеристика тройной связи Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен
Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Introduction to Biochemistry
Introduction to Biochemistry Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Философы химии Кант и Гегель
Философы химии Кант и Гегель Урок 25
Урок 25 Классификация органических соединений
Классификация органических соединений