Содержание
- 2. Оглавление. Информация о докладчике. Введение Морфология микоплазм. Культуральные особенности. Особенности культивирования микоплазм. Микоплазменная среда. Методики. Постановка
- 3. Информация о докладчике. Киселев Иван Сергеевич – студент медико-биологического факультета ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздравсоцразвития
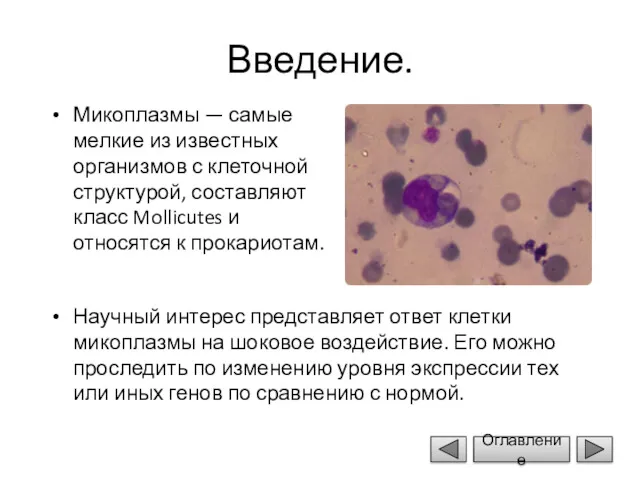
- 4. Введение. Микоплазмы — самые мелкие из известных организмов с клеточной структурой, составляют класс Mollicutes и относятся
- 5. Морфология микоплазм. Клетки микоплазм не ограничены клеточной стенкой, но обладают более стабильной плазматической мембраной, модифицированной холестерином.
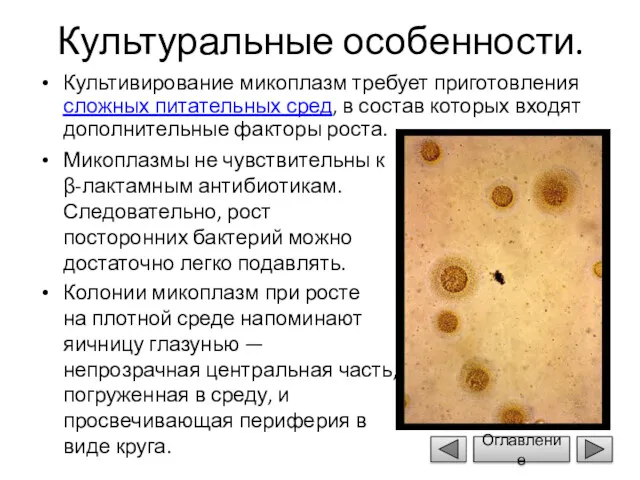
- 6. Культуральные особенности. Культивирование микоплазм требует приготовления сложных питательных сред, в состав которых входят дополнительные факторы роста.
- 7. Особенности культивирования микоплазм. Микоплазменная среда. Для приготовления 1л среды: Добавить агар до 0,4% (на жидкую среду).
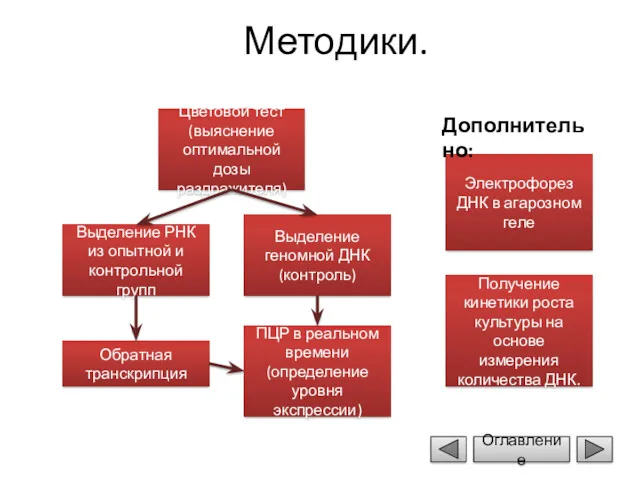
- 8. Методики. Цветовой тест (выяснение оптимальной дозы раздражителя) Выделение РНК из опытной и контрольной групп Выделение геномной
- 9. Постановка цветового теста. Готовят образцы: контроль и образцы, подвергнутые действию раздражителя в возрастающих количествах. Бактерии засевают
- 10. Выделение РНК из культуры. В пробирку вносят культуральную жидкость, добавляют TRIzol LS. Встряхивают пробирку. Вносят хлороформ.
- 11. Выделение геномной ДНК из культуры. В пробирку вносят культуральную жидкость и центрифугируют. Отобирают супернатант. Ресуспендируют осадок
- 12. Реакция обратной транскрипции. К раствору РНК приливают реакционную смесь для разрушения ДНК (см. приложение). Инкубировать 1,5
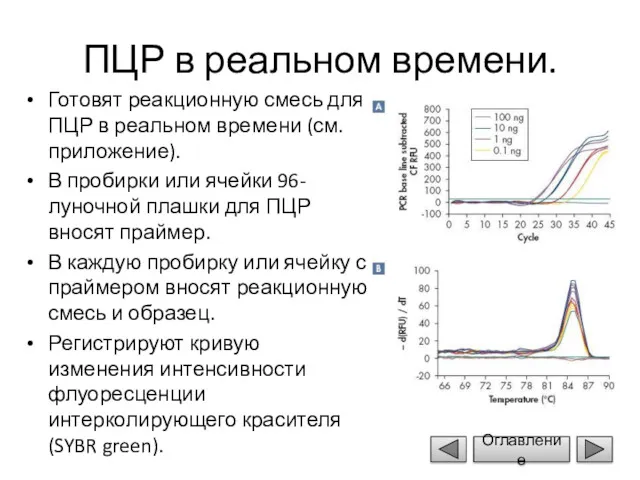
- 13. ПЦР в реальном времени. Готовят реакционную смесь для ПЦР в реальном времени (см. приложение). В пробирки
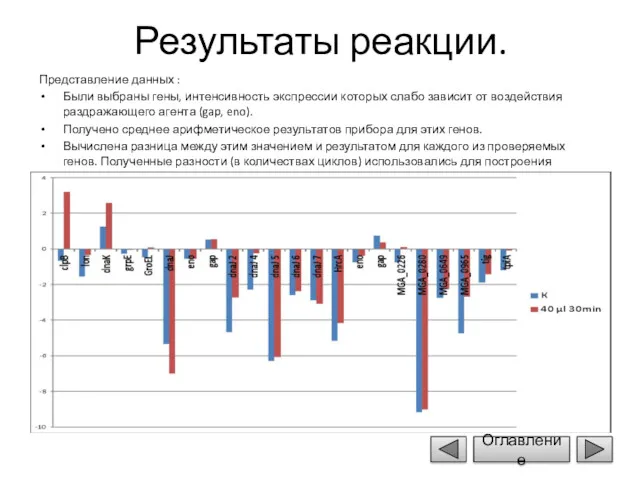
- 14. Результаты реакции. Представление данных : Были выбраны гены, интенсивность экспрессии которых слабо зависит от воздействия раздражающего
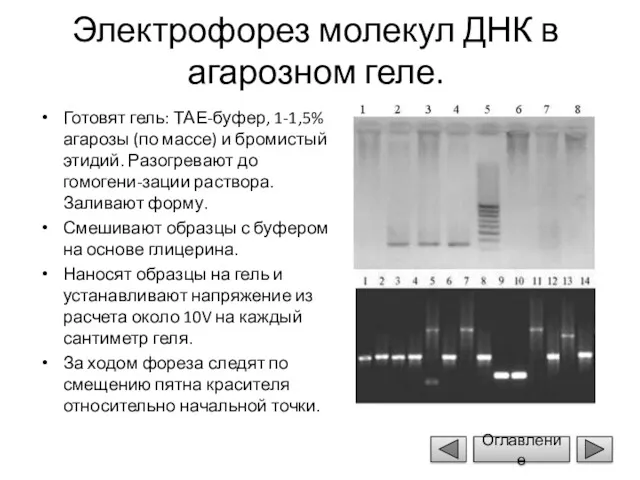
- 15. Электрофорез молекул ДНК в агарозном геле. Готовят гель: ТАЕ-буфер, 1-1,5% агарозы (по массе) и бромистый этидий.
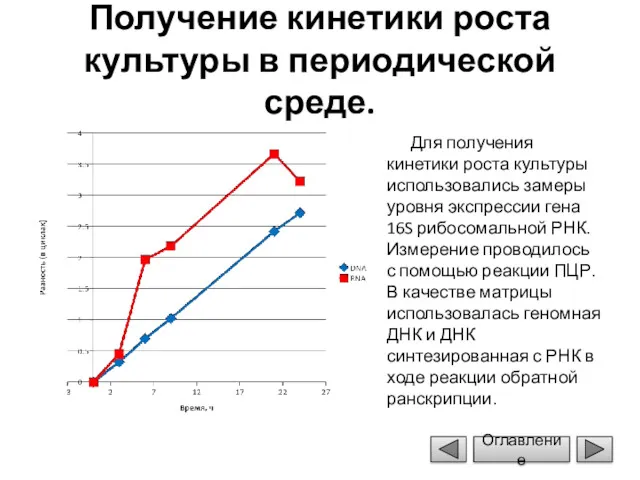
- 16. Получение кинетики роста культуры в периодической среде. Для получения кинетики роста культуры использовались замеры уровня экспрессии
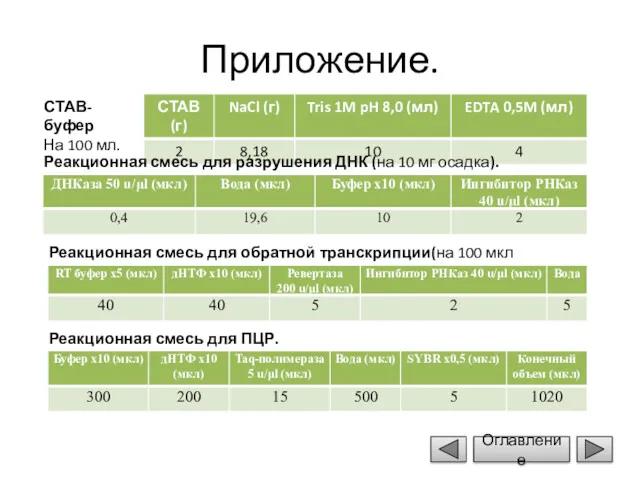
- 17. Приложение. СТАВ-буфер На 100 мл. Реакционная смесь для разрушения ДНК (на 10 мг осадка). Реакционная смесь
- 18. Использованная литература. Лабораторные методики, полученные от руководителя. http://ru.wikipedia.org/ Микробиология. Воробьев А.В., Быков А.С. 2003 г. Медицинская
- 20. Скачать презентацию









 Семейство лилейные, отдел цветковые или покрытосеменные
Семейство лилейные, отдел цветковые или покрытосеменные Комнатные растения (часть 2)
Комнатные растения (часть 2) Цитологические основы наследственности
Цитологические основы наследственности What is the engine of our body machine
What is the engine of our body machine Птицы
Птицы У Чёрного моря
У Чёрного моря Вредители питомников и молодняков. (Лекция 5)
Вредители питомников и молодняков. (Лекция 5) Ткани растений
Ткани растений Изучение биоритмов человека – их влияние на жизнедеятельность
Изучение биоритмов человека – их влияние на жизнедеятельность Кормовая и сахарная свёкла
Кормовая и сахарная свёкла Сана және өзіндік сана
Сана және өзіндік сана Растительный и животный мир Республики Удмуртия
Растительный и животный мир Республики Удмуртия Интересные растения
Интересные растения Жасуша ядросы
Жасуша ядросы Бидай. Бидайдың зиянкестері
Бидай. Бидайдың зиянкестері Значение бактерий в природе и жизни человека
Значение бактерий в природе и жизни человека Устройство речевого аппарата
Устройство речевого аппарата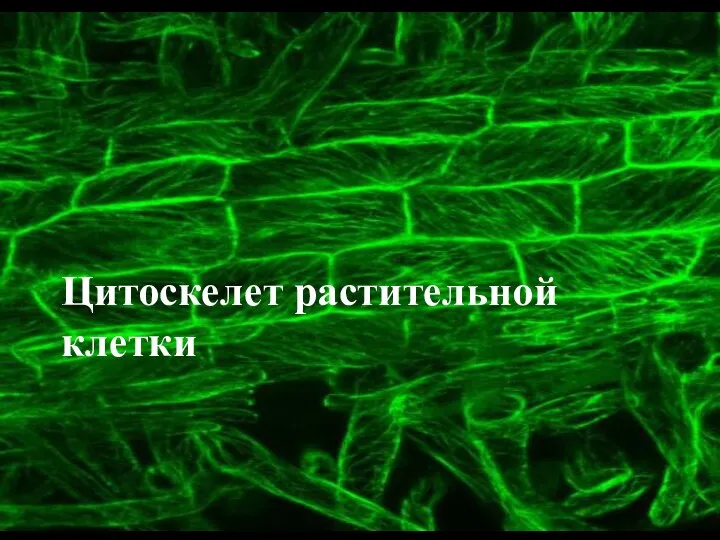 Цитоскелет растительной клетки
Цитоскелет растительной клетки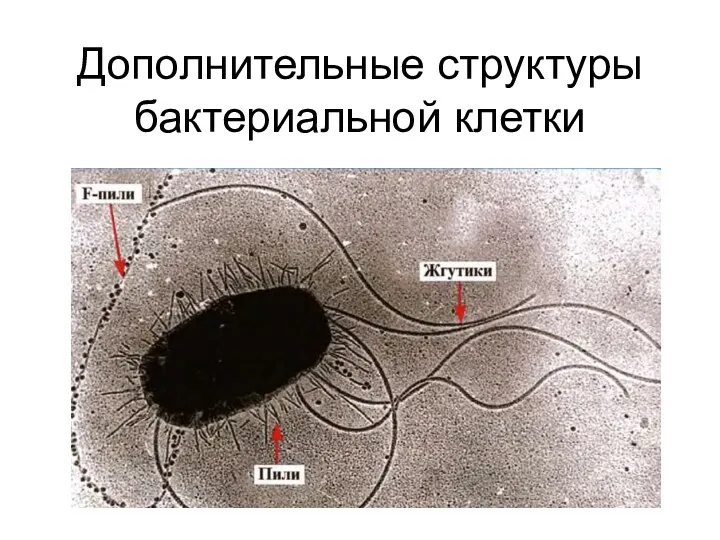 Дополнительные структуры бактериальной клетки
Дополнительные структуры бактериальной клетки Влияние факторов внешней среды на онтогенез
Влияние факторов внешней среды на онтогенез Морфология эпителиальной ткани
Морфология эпителиальной ткани Продолговатый мозг. Черепно-мозговые нервы (IX - XII)
Продолговатый мозг. Черепно-мозговые нервы (IX - XII) Сүт және сүт өнідерінің тағамдық биологиялық құндылығы мен қауіпсіздігі
Сүт және сүт өнідерінің тағамдық биологиялық құндылығы мен қауіпсіздігі Индивидуальное развитие цветковых растений
Индивидуальное развитие цветковых растений Генная инженерия: новые возможности и проблемы
Генная инженерия: новые возможности и проблемы Клонирование
Клонирование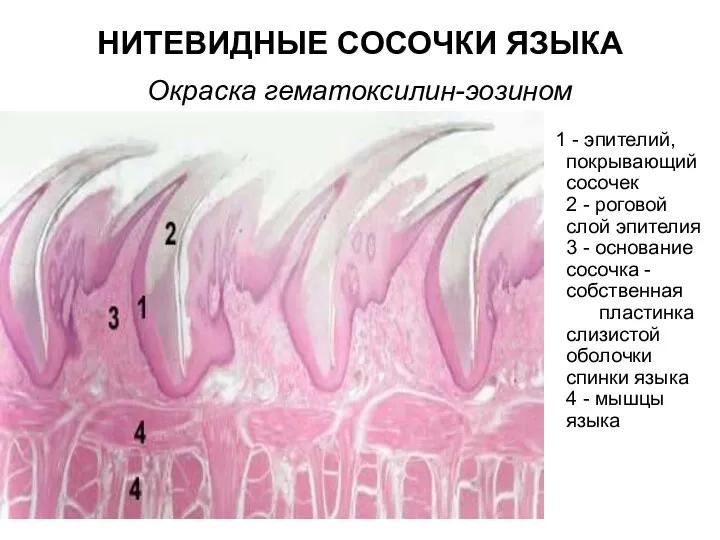 Нитевидные сосочки языка. Окраска гематоксилин-эозином
Нитевидные сосочки языка. Окраска гематоксилин-эозином Птицы Челябинской области
Птицы Челябинской области