Содержание
- 2. Белки (протеины) – важнейший класс БАВ Жизнь есть способ существования белковых тел Ф. Энгельс Белки –
- 3. Особенности белков Разнообразие структур и высокая видовая специфичность Способность к различным внутримолекулярным взаимодействиям ⇒ динамичность структур
- 4. Молекулярная масса белков. Форма белковых молекул (самостоятельно)
- 5. Аминокислотный состав белков (см. лабораторные и семинарские занятия)
- 6. Структурные элементы в белках – α-аминокислоты, отличающиеся друг от друга строением боковых групп (боковых цепей, радикалов)
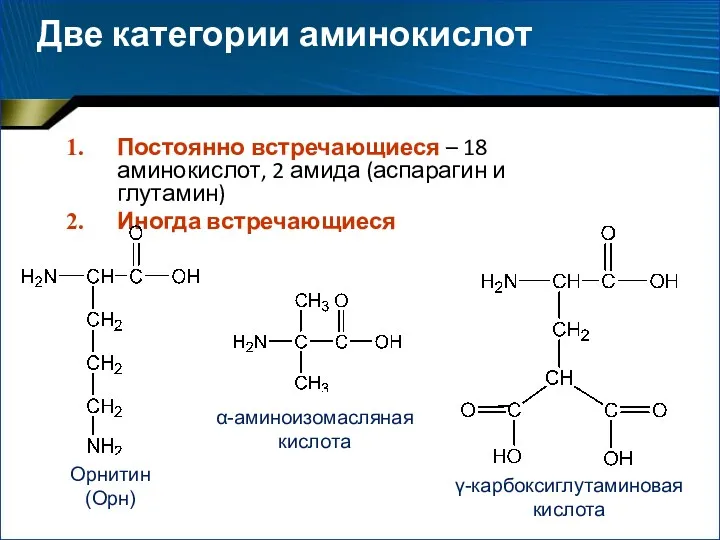
- 7. Две категории аминокислот Постоянно встречающиеся – 18 аминокислот, 2 амида (аспарагин и глутамин) Иногда встречающиеся Орнитин
- 8. Классификации α-аминокислот I. По химическому составу Алифатические Моноаминомонокарбоновые (нейтральные) – гли, ала, сер, цис, лей, иле,
- 9. Свойства аминокислот Важная особенность – оптическая активность (кроме гли) 7 аминокислот характеризуются правым (+) 10 –
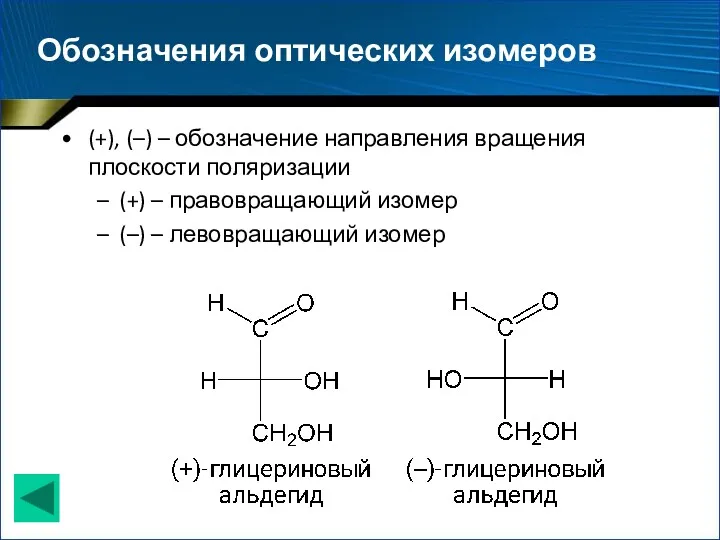
- 10. Обозначения оптических изомеров (+), (–) – обозначение направления вращения плоскости поляризации (+) – правовращающий изомер (–)
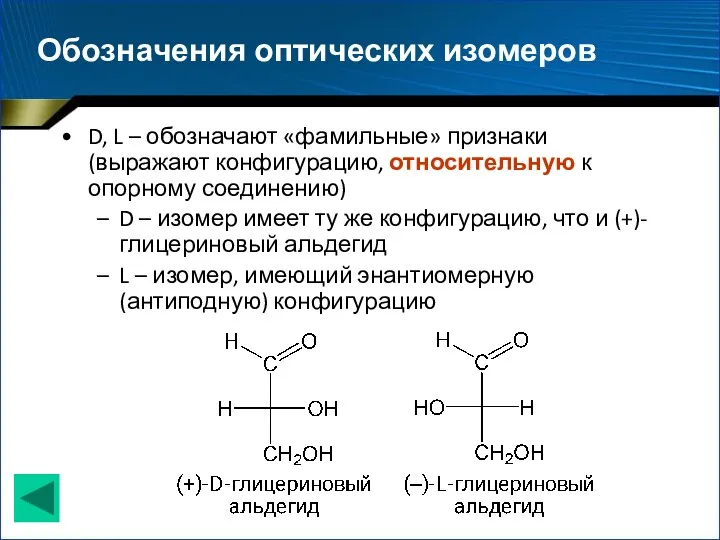
- 11. Обозначения оптических изомеров D, L – обозначают «фамильные» признаки (выражают конфигурацию, относительную к опорному соединению) D
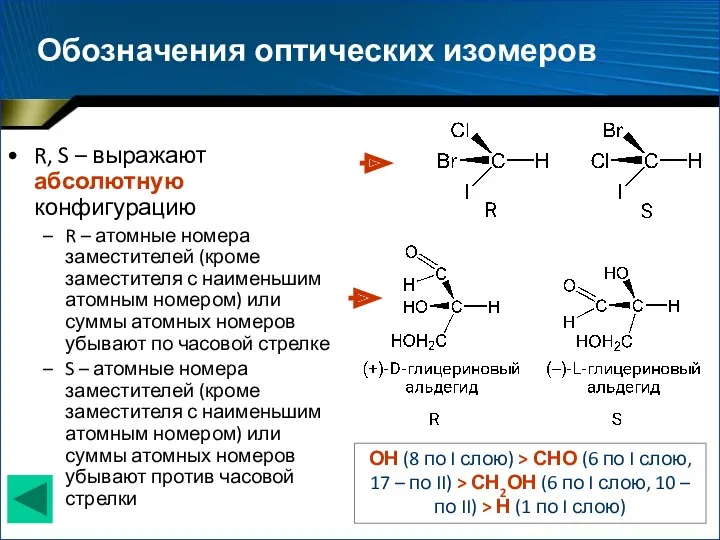
- 12. Обозначения оптических изомеров R, S – выражают абсолютную конфигурацию R – атомные номера заместителей (кроме заместителя
- 13. Радикалы аминокислот (длина, объем, взаимное расположение, химические свойства) определяют объем, форму, рельеф поверхности белковой частицы, степень
- 14. Общее число аминокислотных остатков в молекулах белков изменяется в широких пределах Мr,ср.(аминокислотного остатка) = 115 Коэффициент
- 15. Пептиды
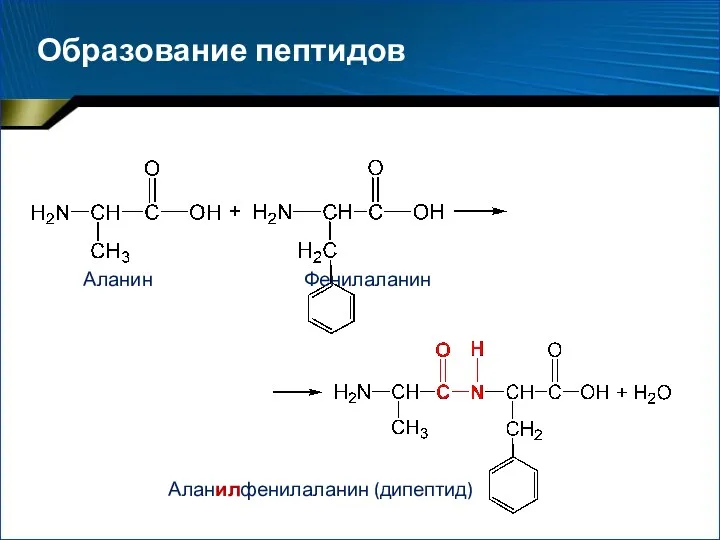
- 16. Образование пептидов Аланилфенилаланин (дипептид) Аланин Фенилаланин
- 17. Образование пептидных связей в воде термодинамически невыгодно ⇒ необходимость предварительной активации взаимодействующих групп при химическом синтезе
- 18. Природные пептиды
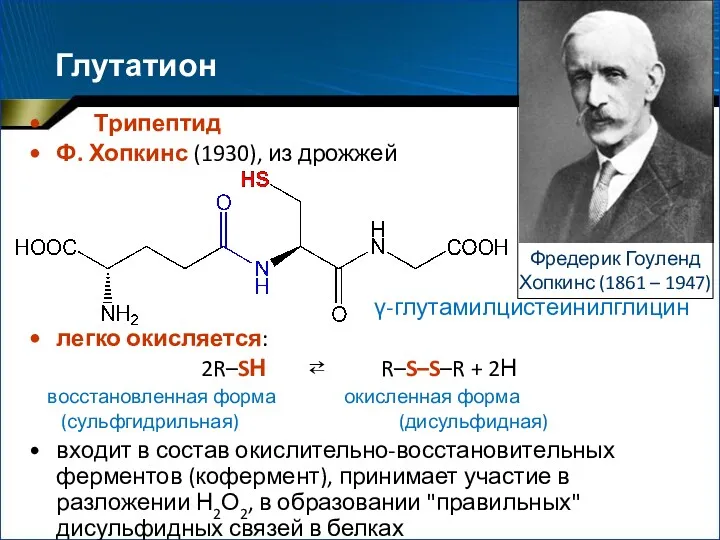
- 19. Глутатион Трипептид Ф. Хопкинс (1930), из дрожжей γ-глутамилцистеинилглицин легко окисляется: 2R–SН ⇄ R–S–S–R + 2Н восстановленная
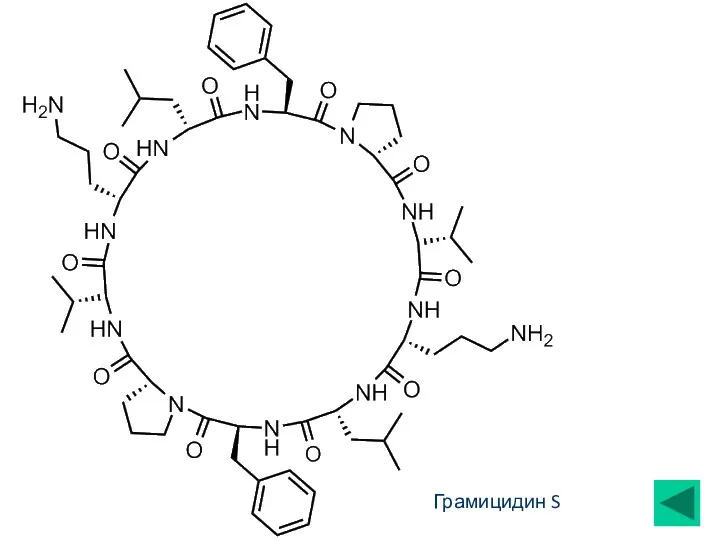
- 20. Пептидные антибиотики Многие циклопептиды Грамицидин Грамицидин S – циклодекапептид, молекула которого состоит из 2-х симметричных пентапептидов,
- 21. Грамицидин S
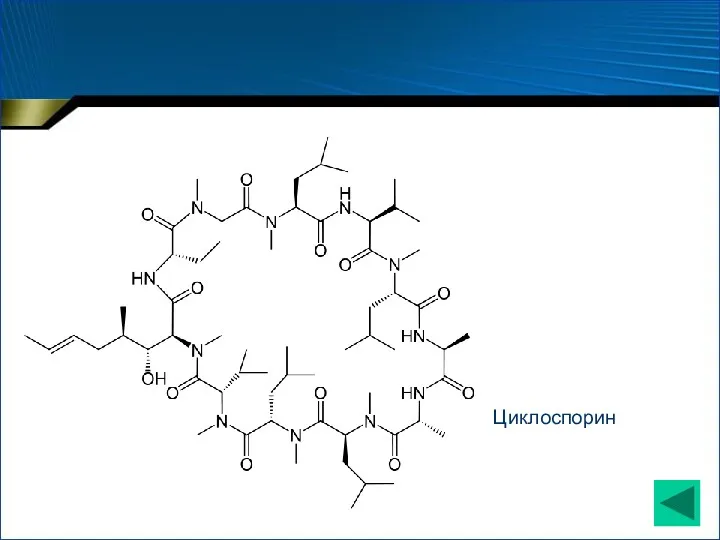
- 22. Циклоспорин
- 23. Нейропептиды Обнаружены в мозге и способны влиять на функции цнс энкефалины и эндорфины (опиоидные пептиды) способны
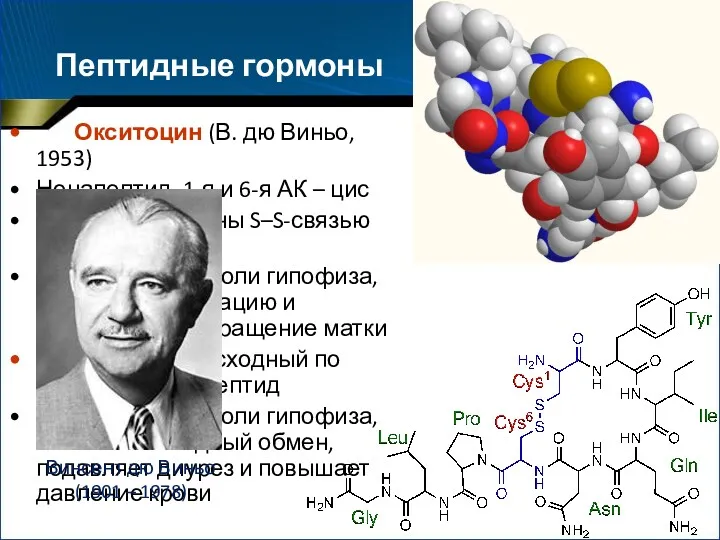
- 24. Пептидные гормоны Окситоцин (В. дю Виньо, 1953) Нонапептид, 1-я и 6-я АК – цис HS-группы связаны
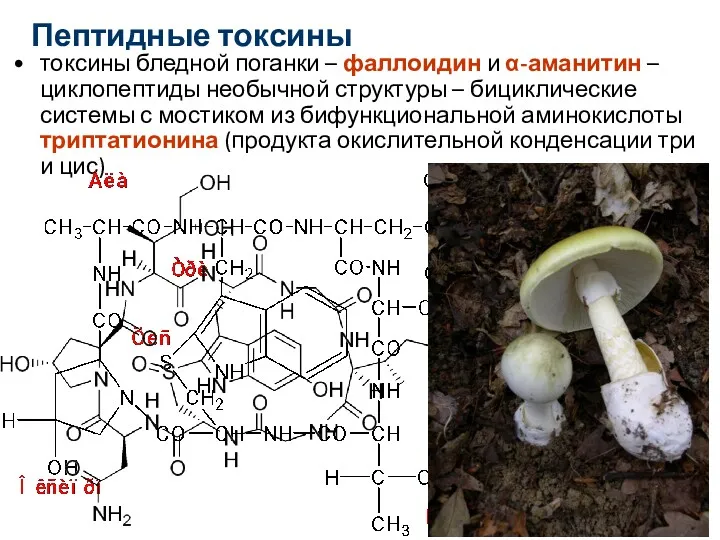
- 25. Пептидные токсины токсины бледной поганки – фаллоидин и α-аманитин – циклопептиды необычной структуры – бициклические системы
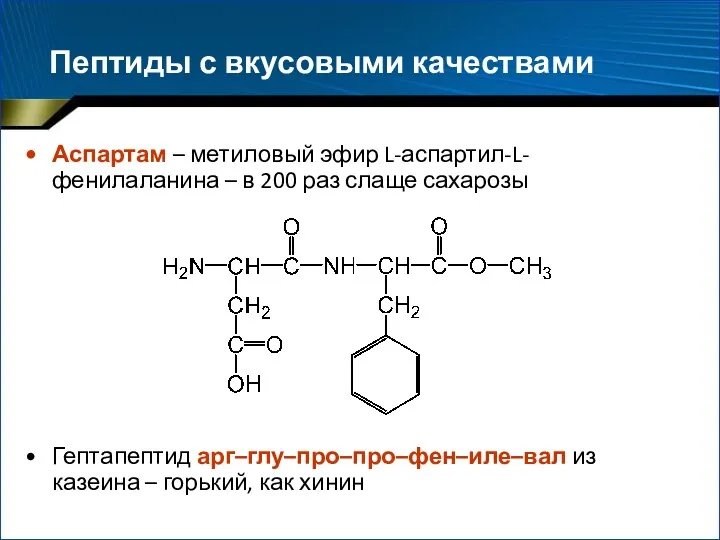
- 26. Пептиды с вкусовыми качествами Аспартам – метиловый эфир L-аспартил-L-фенилаланина – в 200 раз слаще сахарозы Гептапептид
- 27. Структура белковой молекулы
- 28. Полипептидная теория строения белка 1902 г., Э. Фишер Белки – сложные полипептиды, в которых отдельные аминокислоты
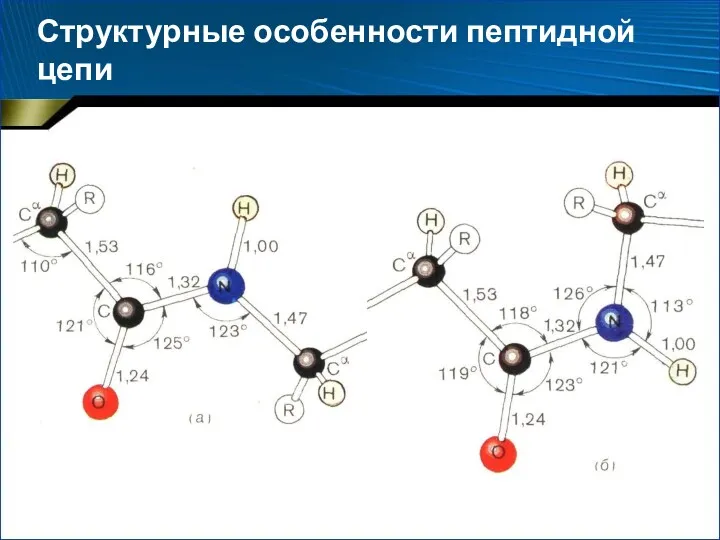
- 29. Структурные особенности пептидной цепи
- 30. Структурные особенности пептидной цепи Пептидная связь примерно на 10% короче связи –С–N– и имеет характер «частично
- 31. Структурные особенности пептидной цепи Транс-конфигурация Выгоднее цис-конфигурации на 2,6 ккал/моль (10,878 кДж/моль), т. к. сближение α-углеродных
- 32. Уровни организации белковой молекулы
- 33. К. У. Линдерстрем-Ланг 4 уровня организации белковых молекул Первичная Вторичная Третичная Четвертичная с т р у
- 34. Первичная структура белка
- 35. Первичная структура белка последовательность аминокислотных остатков в полипептидной цепи кодируется структурным геном данного белка содержит все
- 36. определение вторичной и третичной структур выяснение расположения функциональных групп в активном центре, механизма его функционирования выяснение
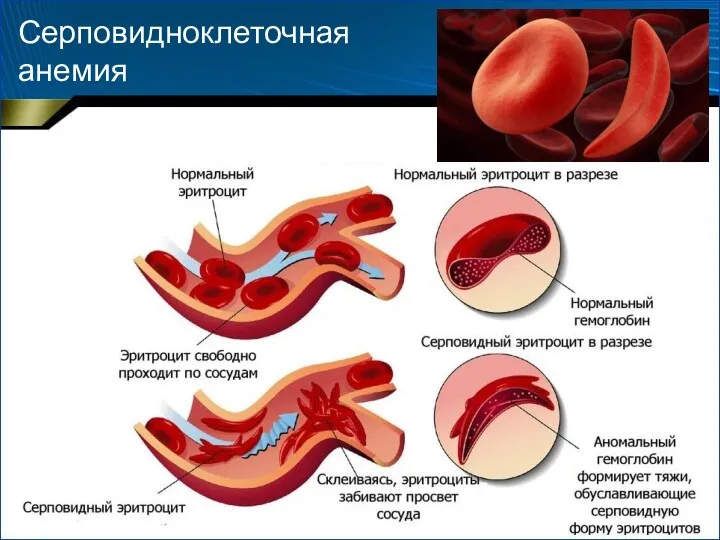
- 37. Серповидноклеточная анемия
- 38. определение вторичной и третичной структур выяснение расположения функциональных групп в активном центре, механизма его функционирования выяснение
- 39. Невалентные взаимодействия в пептидной цепи
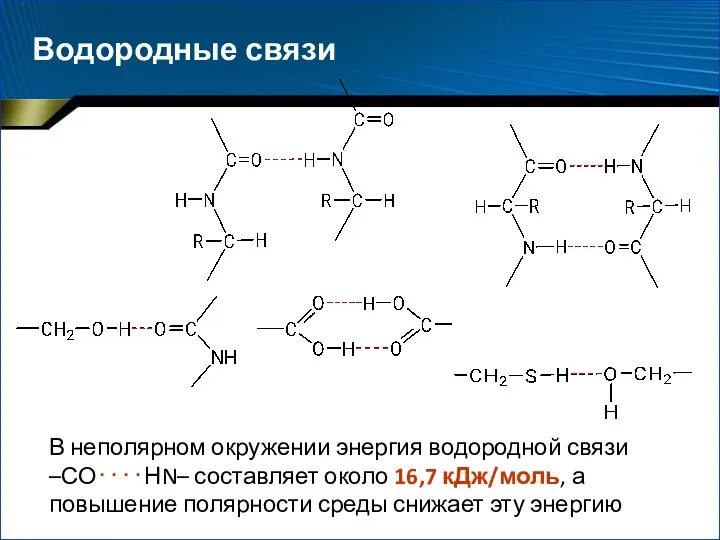
- 40. Водородные связи В неполярном окружении энергия водородной связи –СО⋅⋅⋅⋅НN– составляет около 16,7 кДж/моль, а повышение полярности
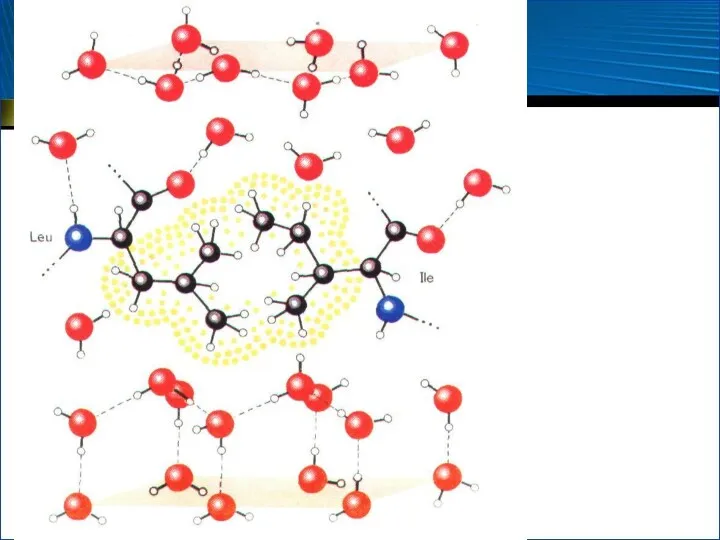
- 41. Гидрофобные взаимодействия Энтропийная природа Неполярные заместители «выталкиваются» из воды и стремятся ограничить свой контакт с ней
- 43. Ван-дер-ваальсовы взаимодействия Дисперсионные силы притяжения атомов и Силы взаимного отталкивания их электронных оболочек Энергетический вклад каждого
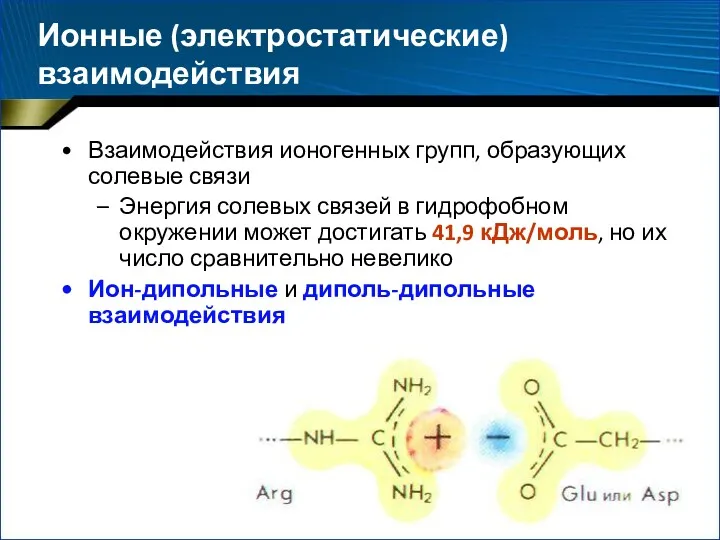
- 44. Ионные (электростатические) взаимодействия Взаимодействия ионогенных групп, образующих солевые связи Энергия солевых связей в гидрофобном окружении может
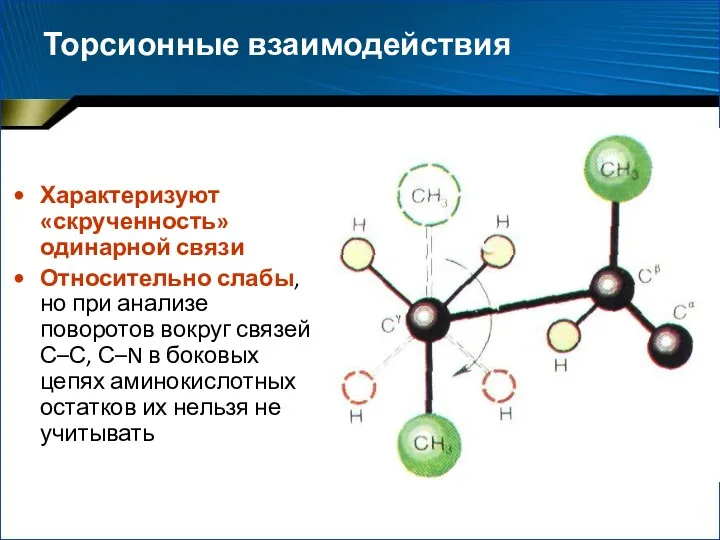
- 45. Торсионные взаимодействия Характеризуют «скрученность» одинарной связи Относительно слабы, но при анализе поворотов вокруг связей С–С, С–N
- 46. Вторичная структура белков
- 47. Вторичная структура белка… пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов
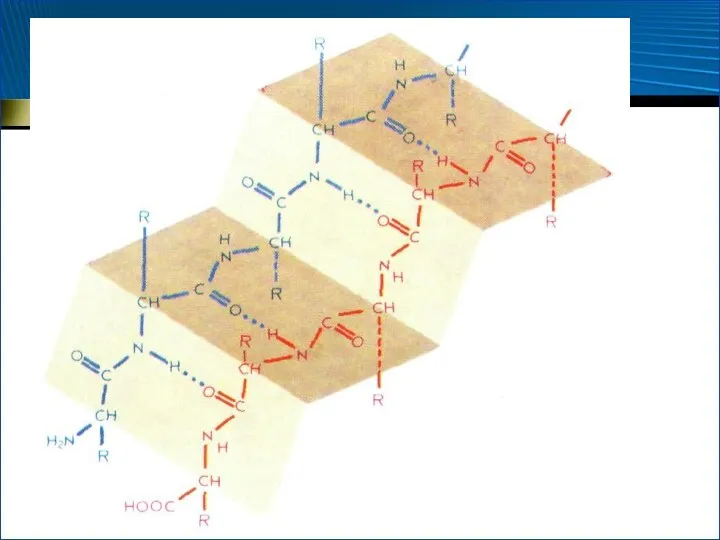
- 48. Стабилизация вторичной структуры за счет водородной связи Влияние окружающей белок воды Влияние воды снижается при формировании
- 49. α-Спираль 50-е годы ХХ в. Л. Полинг и Р. Кори Лайнус Карл Полинг (1901 – 1994)
- 50. α-Спираль Радикалы аминокислотных остатков – на периферии образованного спиралью цилиндра и могут обеспечивать гидрофобную или гидрофильную
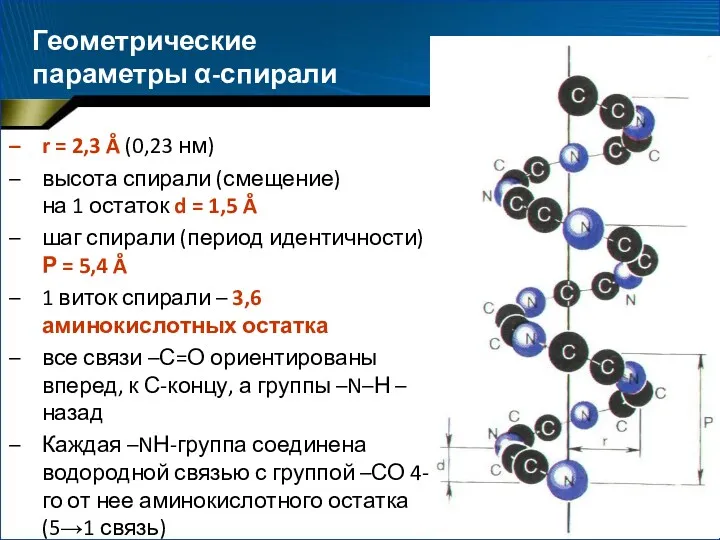
- 51. Геометрические параметры α-спирали r = 2,3 Å (0,23 нм) высота спирали (смещение) на 1 остаток d
- 52. α-Спираль Длина α-спиральных участков в глобулярных белках относительно невелика (5–15 аминокислотных остатков, 3–4 витка спирали) в
- 53. β-Структура У. Т. Астбери, 1941 г. 1951 г., Л. Полинг и Р. Кори установили, что β-структура,
- 55. β-Структура Число аминокислотных остатков в отрезке пептидной цепи, образующем β-структуру, обычно 3 – 8 Протяженная β-структура
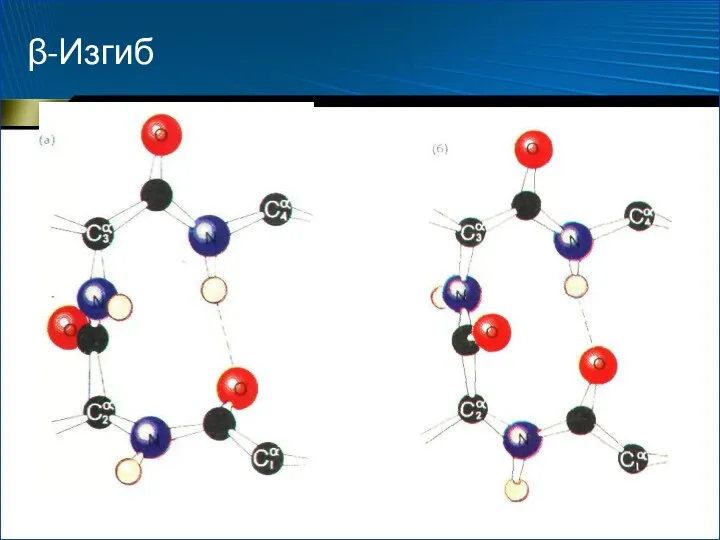
- 56. β-Изгиб Петли, позволяющие изменить направление пептидной цепи Наиболее экономно – β-изгиб Стабилизируется одной водородной связью Практически
- 57. β-Изгиб
- 58. Вторичная структура белков Зависимость от аминокислотной последовательности
- 59. Способ укладки молекулы белка определяется его аминокислотной последовательностью α-спираль – ала, лей, глу β-структура – мет,
- 60. Сверхвторичная (надвторичная) структура белков
- 61. Сверхвторичная (надвторичная) структура белков Пространственное строение ансамблей взаимодействующих между собой вторичных структур
- 62. Сверхвторичная (надвторичная) структура белков Типы сверхвторичных структур
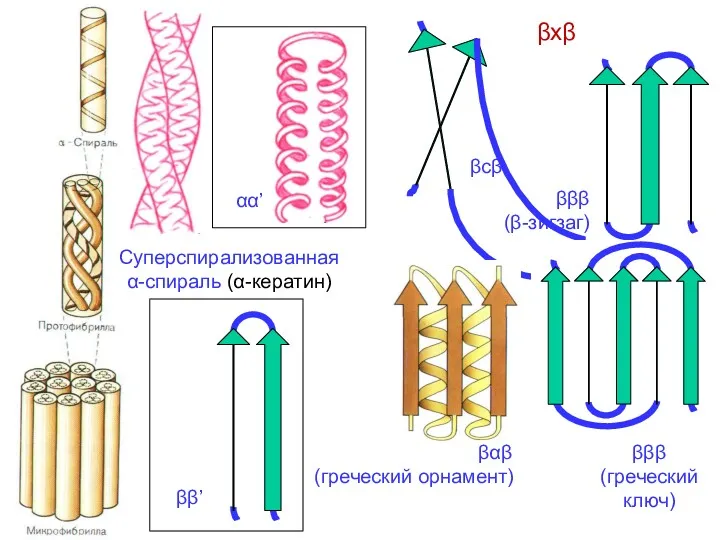
- 63. Суперспирализованная α-спираль (α-кератин) αα’ ββ’ βxβ βcβ βαβ (греческий орнамент) βββ (β-зигзаг) βββ (греческий ключ)
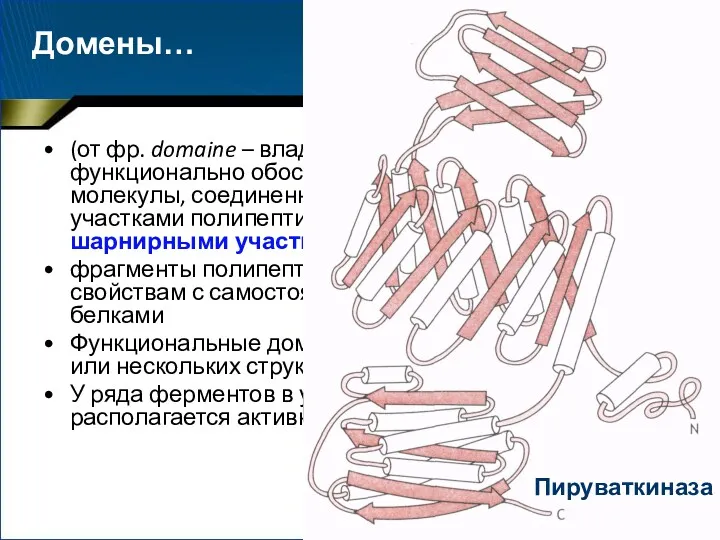
- 64. Домены
- 65. Домены… (от фр. domaine – владение) – структурно и функционально обособленные области (субобласти) молекулы, соединенные друг
- 66. Домены Классификация структурных доменов и белков по организации пространственной структуры полипептидной цепи
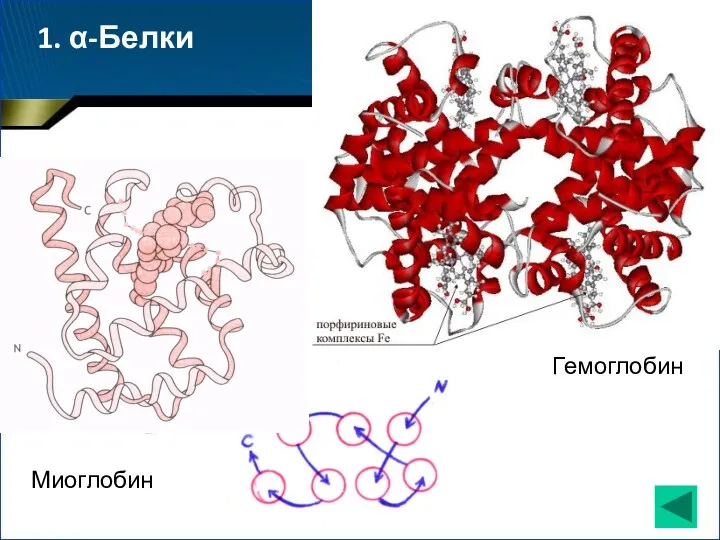
- 67. 1. α-Белки Миоглобин Гемоглобин
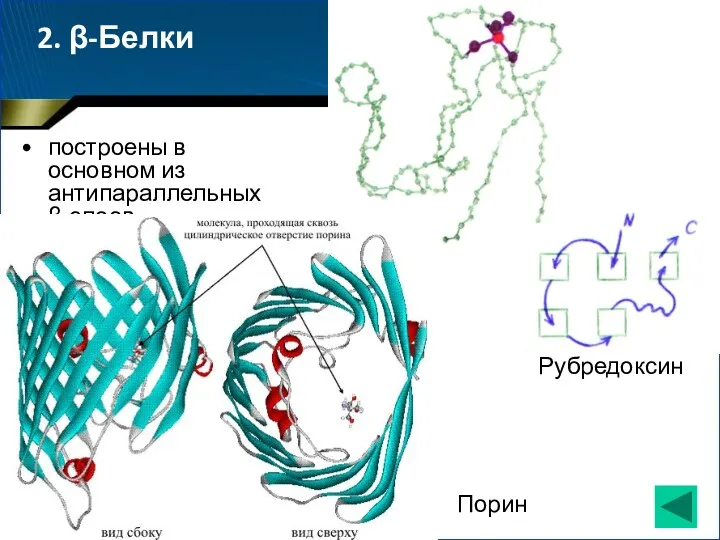
- 68. 2. β-Белки построены в основном из антипараллельных β-слоев Порин Рубредоксин
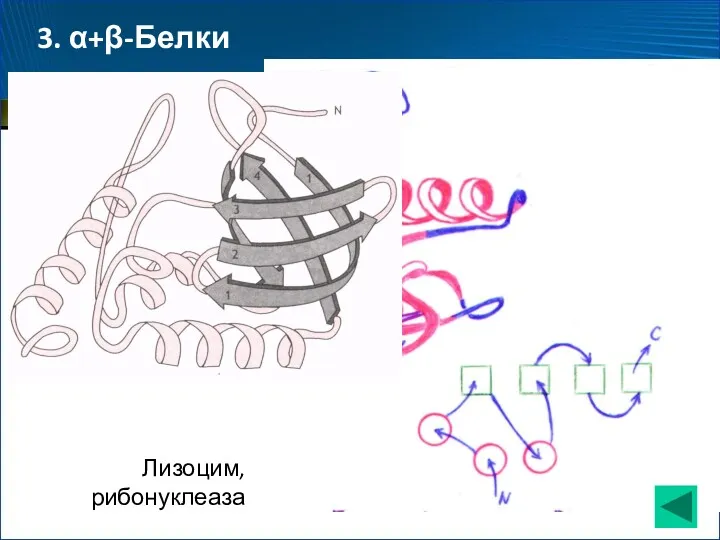
- 69. Лизоцим, рибонуклеаза 3. α+β-Белки
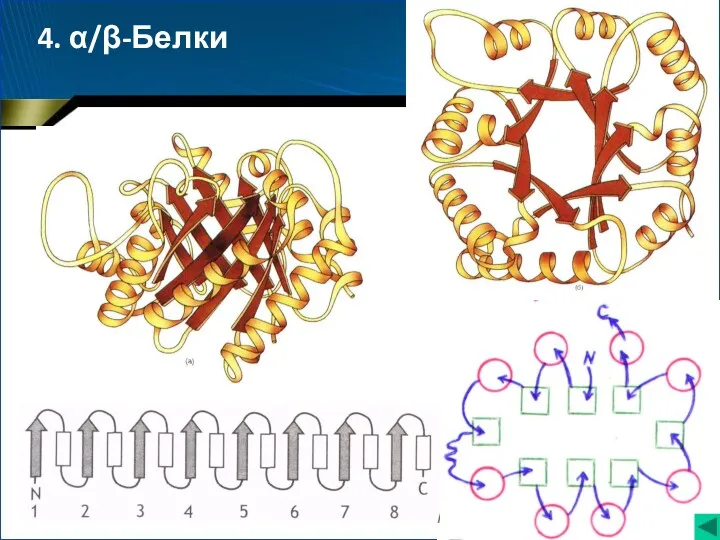
- 70. Триозофосфатизомераза 4. α/β-Белки
- 71. 5. Домены и белки без выраженной вторичной структуры
- 72. Третичная структура белка
- 73. Третичная структура белка… характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое
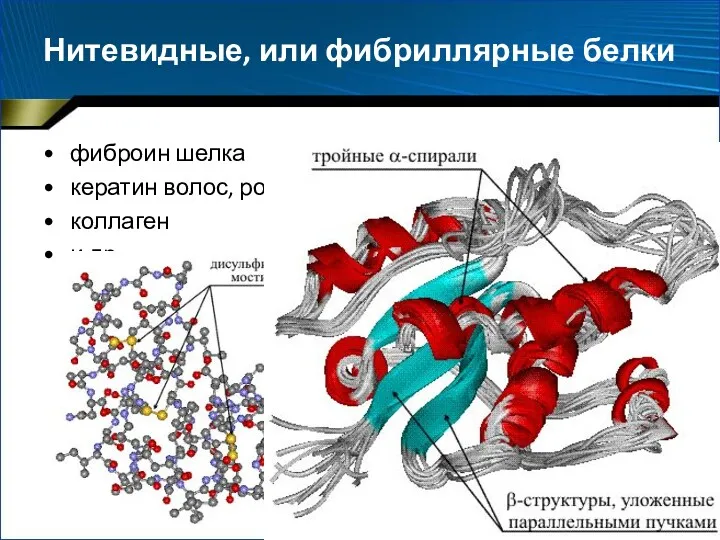
- 74. Нитевидные, или фибриллярные белки фиброин шелка кератин волос, рогов, копыт коллаген и др.
- 75. Шаровидные, или глобулярные белки
- 76. Третичная структура белка основа функциональности белка, которая требует точной пространственной организации больших ансамблей, построенных из множества
- 77. Четвертичная структура белка
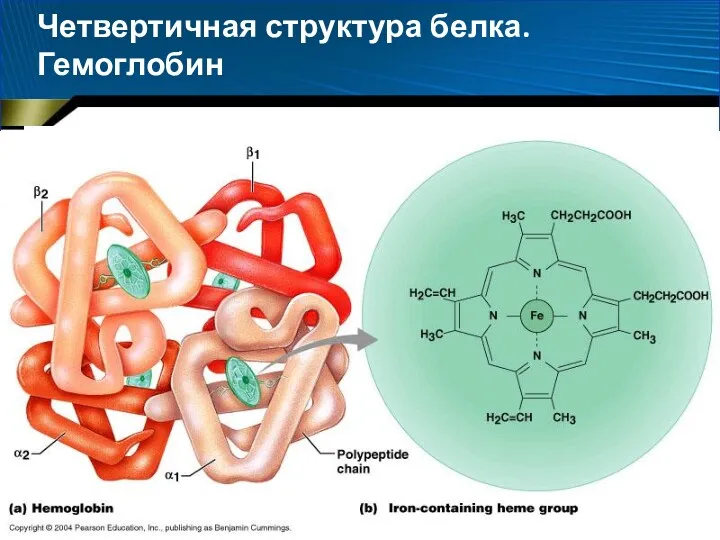
- 78. Четвертичная структура белка… Олигомерные белки Четвертичная структура – размещение в пространстве взаимодействующих между собой субъединиц, образованных
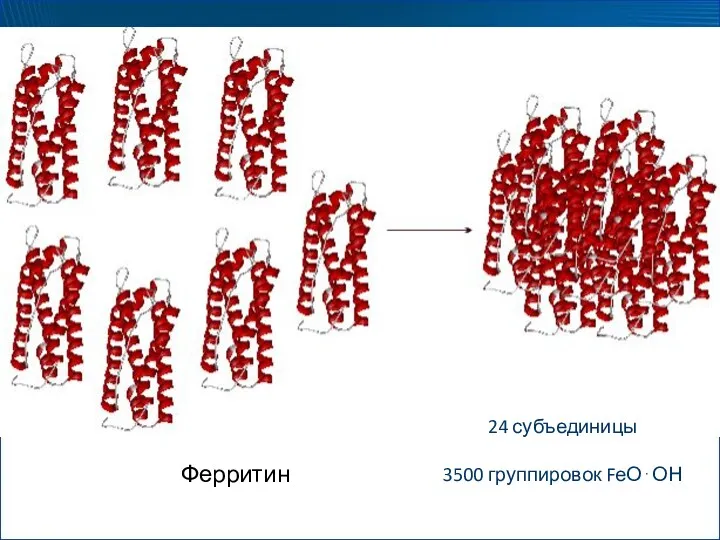
- 79. Ферритин 24 субъединицы 3500 группировок FеО⋅ОН
- 80. Четвертичная структура белка гомомерные белки гетеромерные белки Объединение в одной структуре нескольких взаимосвязанных функций, создание полифункциональной
- 81. Четвертичная структура белка Межсубъединичные контакты – система нековалентных взаимодействий гидрофобные взаимодействия (контактные площадки) водородные связи электростатические
- 82. Четвертичная структура белка Функциональное значение
- 83. Функции четвертичной структуры Объединение нескольких взаимосвязанных функций в единой структуре Архитектурная функция Формирование пространственных образований весьма
- 84. Функции четвертичной структуры Обеспечение множественных взаимодействий белка с протяженными структурами ДНК-связывающие белки – димеры (?) Регуляторная
- 85. Четвертичная структура белка. Гемоглобин
- 86. Каждый индивидуальный белок характеризуется уникальной структурой, обеспечивающей уникальность его функций Поэтому выяснение структуры разнообразных белков может
- 87. Свойства белков (см. лабораторные занятия)
- 88. Классификация белков
- 89. По степени сложности простые белки (протеины) дают при гидролизе только аминокислоты Альбумины Глобулины Проламины Глютелины Гистоны
- 90. По степени сложности сложные белки (протеиды) = протеин + добавочная группа: Хромопротеины (гемоглобин, цитохромы, каталаза, хлорофилл)
- 91. По форме частиц фибриллярные (волокнистые) белки (фиброин шелка, кератин волос, коллаген кожи) глобулярные (корпускулярные) белки
- 92. По растворимости протеиноиды (склеропротеины) – нерастворимы в обычных растворителях – почти все фибриллярные белки альбумины –
- 93. По аминокислотному составу протамины – содержат 80–90% арг, простейшие белки, растворяются в слабых кислотах – белки
- 94. По выполняемым функциям структурные белки – компоненты клеточных мембран, органелл; коллаген соединительной ткани; кератин волос, ногтей;
- 95. По выполняемым функциям защитные белки: антитела (иммуноглобулины); белки системы свертывания крови (фибриноген, тромбин, фибрин, факторы свертывания);
- 96. По выполняемым функциям резервные белки (овальбумины яиц, белки молока – казеин) рецепторные белки: рецептор ацетилхолина; фоторецепторный
- 97. По выполняемым функциям Все белки выполняют энергетическую функцию: при окислении 1 г белка выделяется 17,2 кДж
- 99. Скачать презентацию



































































 Зайчишка-трусишка, или заяц - хитрец, удалой молодец?
Зайчишка-трусишка, или заяц - хитрец, удалой молодец? Видоизменения корней
Видоизменения корней Отравление животных гербицидами
Отравление животных гербицидами Неклеточные формы жизни. Вирусы и бактериофаги.
Неклеточные формы жизни. Вирусы и бактериофаги. Движение крови в организме
Движение крови в организме Абиотические факторы среды
Абиотические факторы среды Презентация к уроку биологии в 9 классе Формы размножения организмов
Презентация к уроку биологии в 9 классе Формы размножения организмов Ферменты. Тема 2
Ферменты. Тема 2 Топографічна анатомія шиї
Топографічна анатомія шиї Выращивание из семян растения мушмула
Выращивание из семян растения мушмула Синэкология, биоценоз, биогеоценоз
Синэкология, биоценоз, биогеоценоз Птичьи посиделки
Птичьи посиделки Кастрация поросят
Кастрация поросят Суцвіття. Процеси запилення та запліднення квіткових рослин
Суцвіття. Процеси запилення та запліднення квіткових рослин Дикие животные леса. Дидактическая игра
Дикие животные леса. Дидактическая игра Молекулалық генетика негіздері. Ген негіздері. Гендердің интроиды, экзонды орналасуы. Прокориоттардың тұқым қуалауының
Молекулалық генетика негіздері. Ген негіздері. Гендердің интроиды, экзонды орналасуы. Прокориоттардың тұқым қуалауының презентация к уроку биологии 7 класс
презентация к уроку биологии 7 класс презентация к уроку Ветер
презентация к уроку Ветер Анатомия крысы
Анатомия крысы растения огэ
растения огэ Съедобные и ядовитые грибы Красноярского края
Съедобные и ядовитые грибы Красноярского края Анатомия черепа
Анатомия черепа Биотические взаимоотношения организмов
Биотические взаимоотношения организмов Дуб - царь деревьев
Дуб - царь деревьев Функции тонкого и толстого кишечника. Всасывание. Барьерная роль печени. Аппендицит
Функции тонкого и толстого кишечника. Всасывание. Барьерная роль печени. Аппендицит Приспособленность растений к условиям жизни в лесном биогеоценозе.Лабораторная работа.
Приспособленность растений к условиям жизни в лесном биогеоценозе.Лабораторная работа. Муравьиная ферма - Формикарий в домашних условиях
Муравьиная ферма - Формикарий в домашних условиях Механизмы половой дифференцировки
Механизмы половой дифференцировки