Содержание
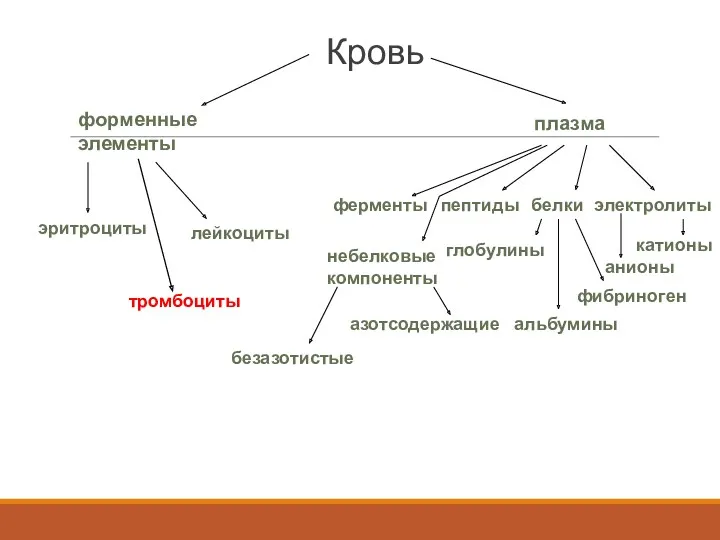
- 2. азотнесодержащие Кровь форменные элементы плазма эритроциты лейкоциты электролиты белки пептиды ферменты катионы анионы фибриноген глобулины альбумины
- 3. Белки плазмы крови Плазма крови здорового человека содержит более 200 различных белков Функции: поддержание коллоидно-осмотического (онкотического)
- 4. Плазма образуется при оседании форменных элементов, при этом кровь не свертывается – добавлен антикоагулянт! Сыворотка образуется
- 5. Кровь = плазма + форменные элементы крови Эр. Лейк. Тромб. 44% 1% ПЛАЗМА - ФИБРИНОГЕН =
- 6. Основные представители фракций белков плазмы крови
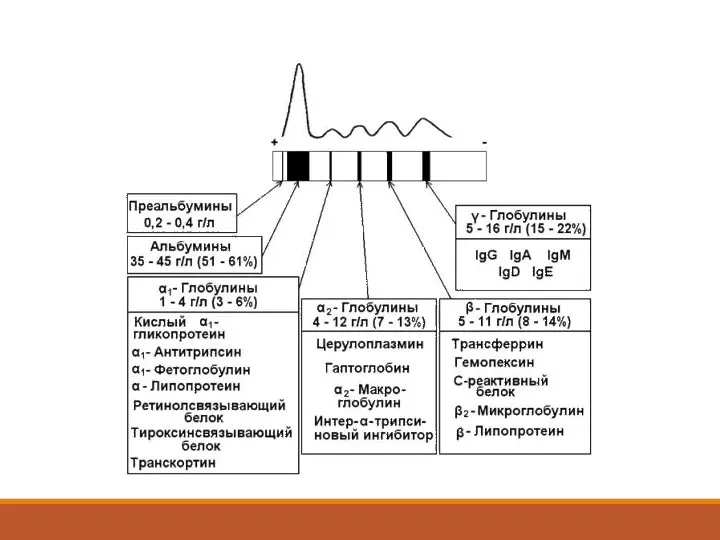
- 7. Протеинограмма БЕЛОК ОБЩИЙ --------------------------- 65-85 г/л БЕЛКОВЫЕ ФРАКЦИИ: Альбумины --------------------------------- 50-70% Глобулины ---------------------------------- 30-50% α1 ---------------------------------------------
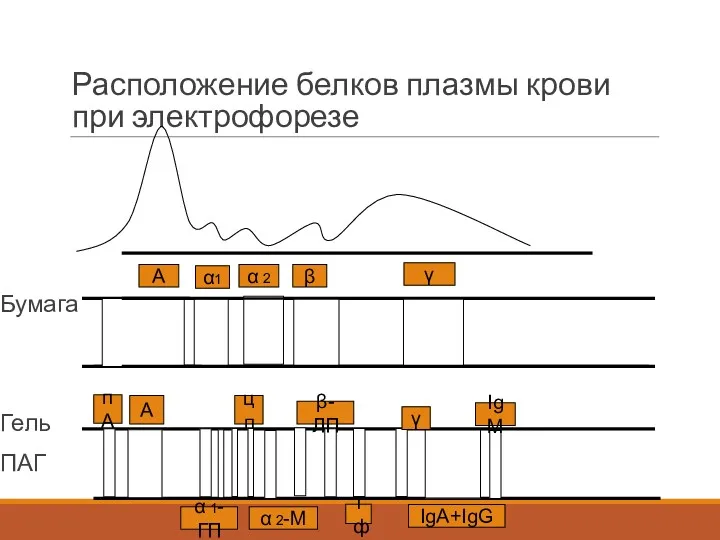
- 9. Расположение белков плазмы крови при электрофорезе Бумага Гель ПАГ А α1 α 2 β γ пA
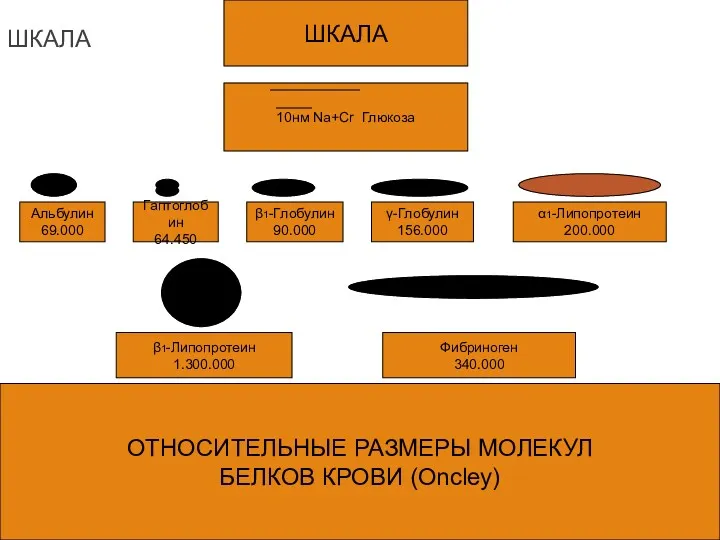
- 10. ШКАЛА 10нм Na+Cr Глюкоза Альбулин 69.000 Гаптоглобин 64.450 β1-Глобулин 90.000 γ-Глобулин 156.000 α1-Липопротеин 200.000 β1-Липопротеин 1.300.000
- 11. Преальбумин - Мм 50-60 кДа, изоэлектрическая точка pI=4,7. - 4 полипептидные цепи по 127 аминокислотных остатков.
- 12. Ретинолсвязывающий белок (витамин-А-транспортирующий белок) – М.м. - 21-22 кДа, pI=4,4-4,8. В крови может находиться в связанной
- 13. Альбумин – М.м. 66 кДа, рI=4,7-5,5. - 17 дисульфидных мостиков, - образовывание димеров и полимеров, сшитых
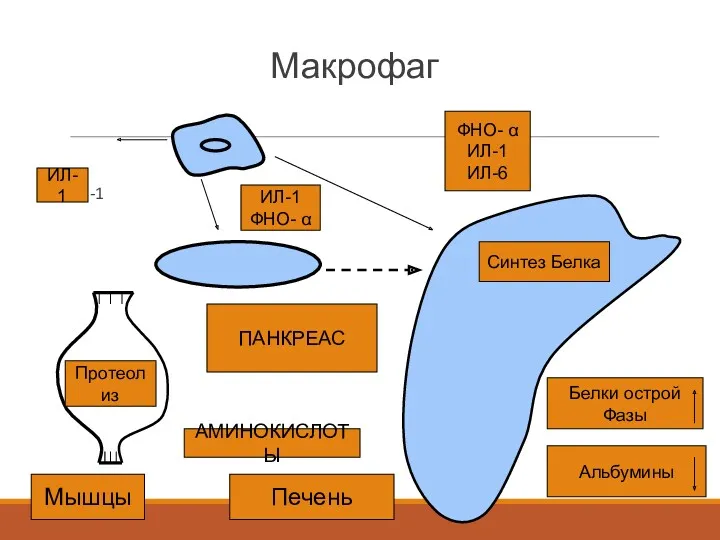
- 14. Макрофаг ИЛ-1 Протеолиз Синтез Белка Белки острой Фазы Альбумины ПАНКРЕАС АМИНОКИСЛОТЫ ФНО- α ИЛ-1 ИЛ-6 ИЛ-1
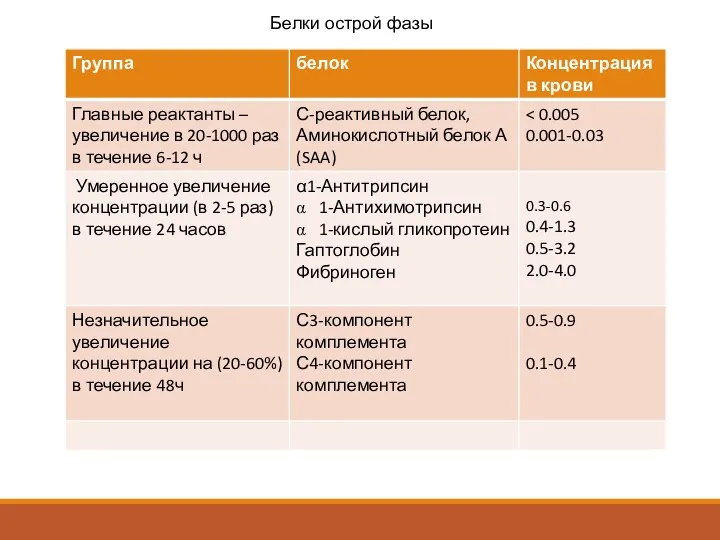
- 15. Белки острой фазы
- 16. α1-антитрипсин (α1-ингибитор протеаз, α1-гликопротеин) М.м. 45-55 кДа, изоэлектрическая точка pI=4,0-4,8. 394 аминокислот. синтезируется в печени. Время
- 17. α1-антихимотрипсин – М.м. - 68 кДа. Специфически связывается с химотрипсином, ингибирует активность лейкоцитарного катепсина G. Концентрация
- 18. α1-кислый гликопротеин (орозомукоид) – М.м. 40-44 кДа, изоэлектрическая точка рI=2,7-3,5. Концентрация в крови - 0,2-0,4 г/л.
- 19. α1-микроглобулин – М.м. 24-31 кДа. Концентрация в крови ~ 54 мг/л. Почки ежесуточно выделяют около 9
- 20. Тироксинсвязывающий глобулин М.м. 54-64 кДа, изоэлектрическая точка pl=6,9-8,4. Концентрация в крови 15 мг/л. Функция - транспорт
- 21. α2-макроглобулин – М.м. 625-820 кДа, изоэлектрическая точка - pI=5,4. Синтез - печень. Концентрация в крови у
- 22. Церулоплазмин - медьсодержащий гликопротеин крови, обладающий оксидазной активностью. (Антиоксидант) М.м. около 134 кДа, изоэлектрическая точка pI=4,4.
- 23. Гаптоглобин - гликопротеин плазмы крови, специфически связывающий гемоглобин. Различают 3 основные формы гаптоглобина: 1-1, 2-1 и
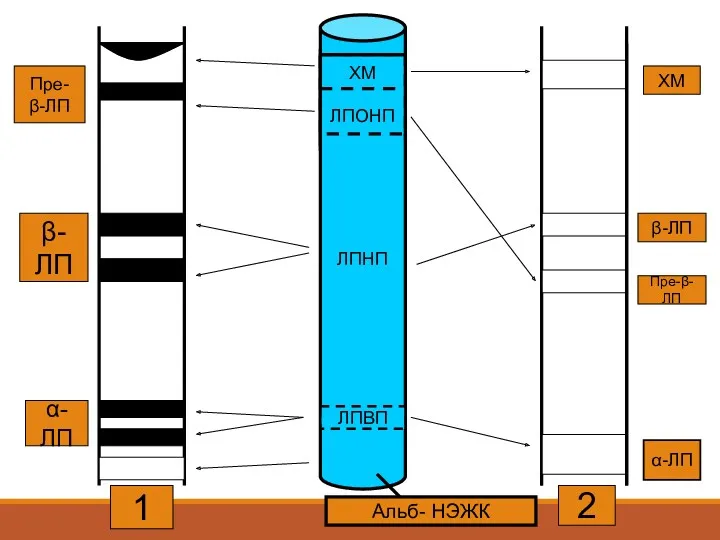
- 24. Альб- НЭЖК ЛПНП ХМ β-ЛП Пре-β-ЛП α-ЛП 2 1 α-ЛП β-ЛП Пре- β-ЛП ЛПВП ХМ ЛПОНП
- 25. Тип I – гиперхиломикронемия. Характеризуется высоким содержанием хиломикронов (ХМ), нормальным или слегка повышенным содержанием ЛПОНП, резким
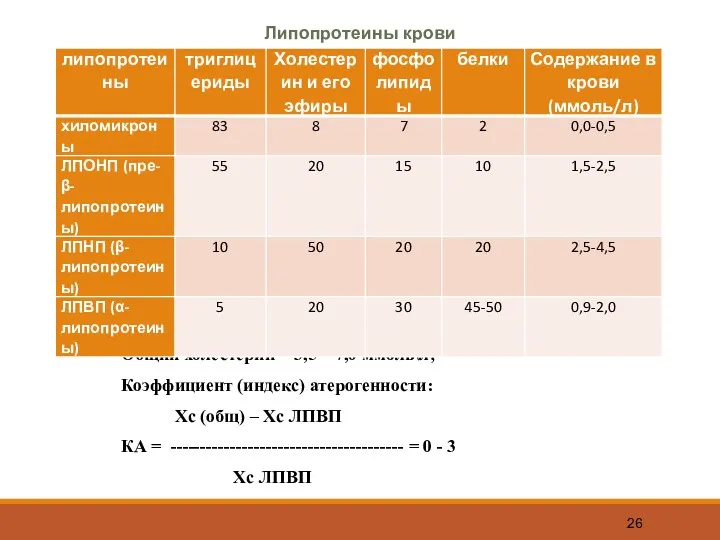
- 26. Липопротеины крови Повышение ЛПОНП, ЛПНП и понижение ЛПВП ведут к ишемической болезни сердца. Общий холестерин =
- 27. Трансферрин - β-гликопротеин крови с м.м. 76-77 кДа, pI= 5,5-5,9. содержание в крови - 1,8-3,8 г/л.
- 28. Повышение содержания трансферрина с одновременным снижением уровня железа в плазме крови. Подобное состояние наблюдается при железодефицитных
- 29. β2-микроглобулин - одно-цепочечная молекула из 100 аминокислот, мм - 11,8 кДа. Содержание в крови 1,0-2,6 мг/л.
- 30. Гемопексин (гемсвязывающий β-глобулин) - β-гликопротеин с мм 57 кДа, одна поли-пептидная цепь. Содержание в крови ~
- 31. Витамин-D-связывающий белок – мм. 52-53 кДа, pI=4,8. Содержание в крови у мужчин 0,56 + 0,02 г/л,
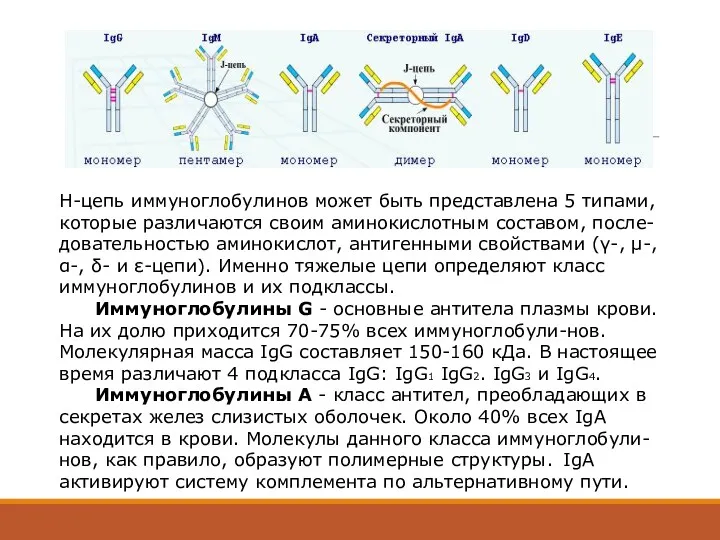
- 32. Иммуноглобулины G -------------------- 8-18 г/л A -------------------- 0.9-4.5 г/л М -------------------- 0.6-2.5 г/л D -------------------- 0.05
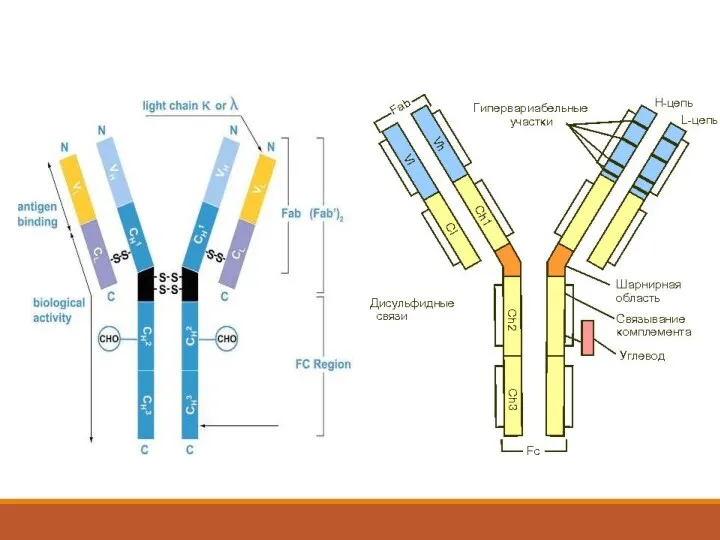
- 33. Иммуноглобулины - гликопротеины плазмы крови, образующиеся в ответ на введение в организм чужеродных веществ. 5 классов:
- 35. Н-цепь иммуноглобулинов может быть представлена 5 типами, которые различаются своим аминокислотным составом, после-довательностью аминокислот, антигенными свойствами
- 36. Они участвуют в образовании ревматоидных факторов, соеди-няются с альбуминами, гликопротеинами, взаимодействуют только с нейтрофилами, не дают
- 37. С-реактивный белок - белок, получивший свое название в результате способности вступать в реакцию преципитации с С-полисахаридом
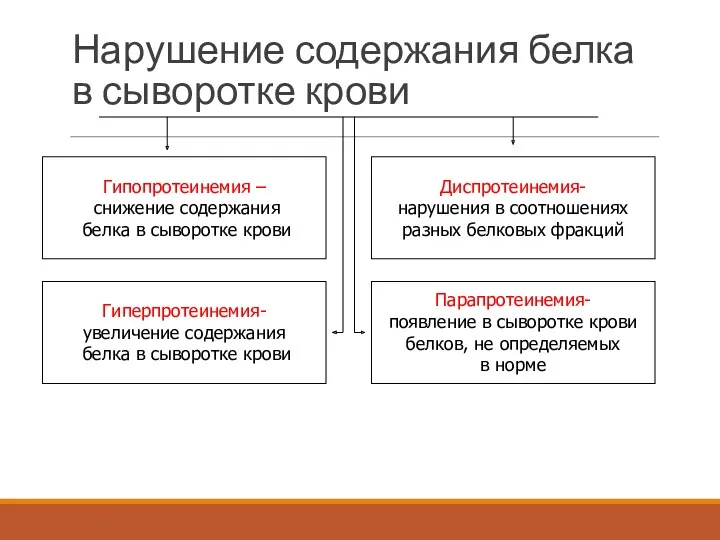
- 38. Нарушение содержания белка в сыворотке крови Гипопротеинемия – снижение содержания белка в сыворотке крови Гиперпротеинемия- увеличение
- 39. Изменения концентрации общего белка могут быть как абсолютными, так и относительными. Относительные наблюдаются при из- менении
- 40. Наиболее частыми причинами развития абсолютной гипопро- теинемии являются следующие состояния: недостаточное поступление белков с пищей; нарушение
- 41. Абсолютная гиперпротеинемия (до 120 г/л и более) – наблюдается при миеломной болезни (белки Бенс-Джонса), макроглобулинемии, хронических
- 42. Дис- и парапротеинемии определяются с помощью различных видов электрофореза (на бумаге, ацетатцеллюлозной пленке, полиакриламидном геле и
- 43. Острое воспаление – альбумины ά1 ά2 - глобулины Хрон. процессы – β-глобулины АЛЬБУМИНЫ α 1 α
- 44. Соответствующий острым воспалительным процессам. Характеризуется значительным уменьшением содержания альбуминов и большой выраженностью фракций α1- и α2-глобулинов;
- 45. Характерной особенностью хронического воспалительного процесса является некоторое снижение альбуминовой и, возможно, β-глобулиновой фракций на фоне увеличения
- 46. Гепатиты. Повреждения паренхимы печени, как правило, приводят к снижению продукции специфических белков и уменьшению площади всех
- 47. Парапротеинемии – состояния, характеризующиеся появлением в сыворотке крови белков, не определяемых в норме. Примеры: обнаружение белков
- 48. α1-фетопротеин - гликопротеин Мм 69 кДа, рI=5,08. Содержание в плазме 1,5-16,5 мкг/л. Он может частично возмещать
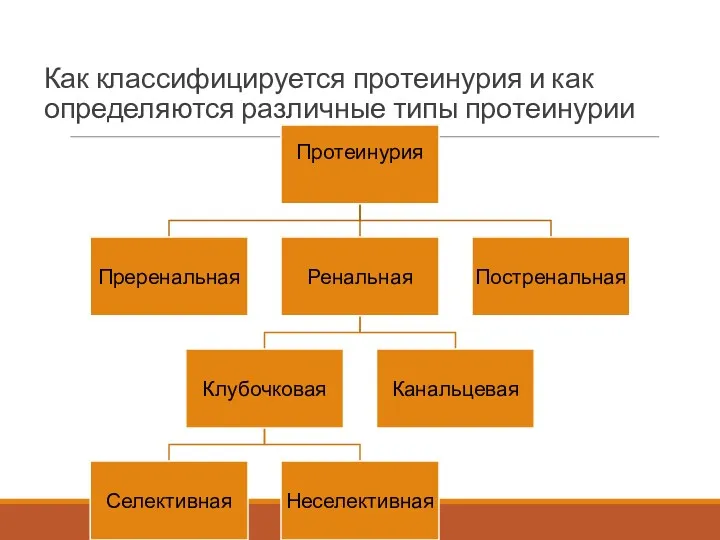
- 49. Как классифицируется протеинурия и как определяются различные типы протеинурии
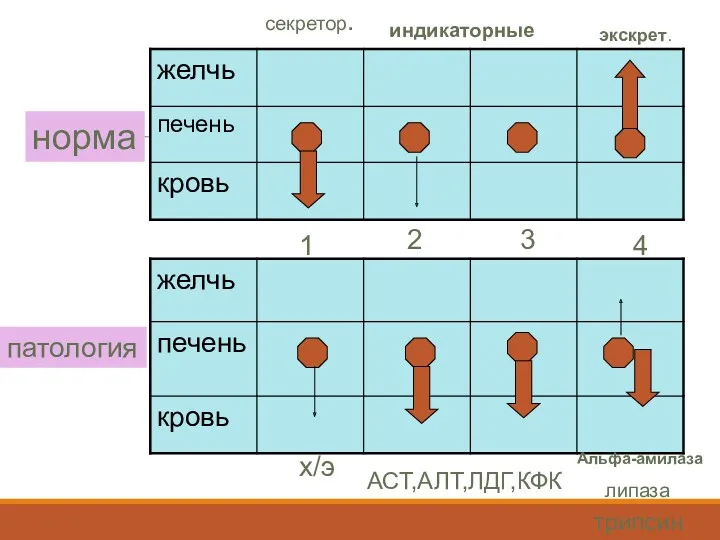
- 50. норма патология 1 2 3 4 секретор. индикаторные экскрет. х/э АСТ,АЛТ,ЛДГ,КФК Альфа-амилаза липаза трипсин
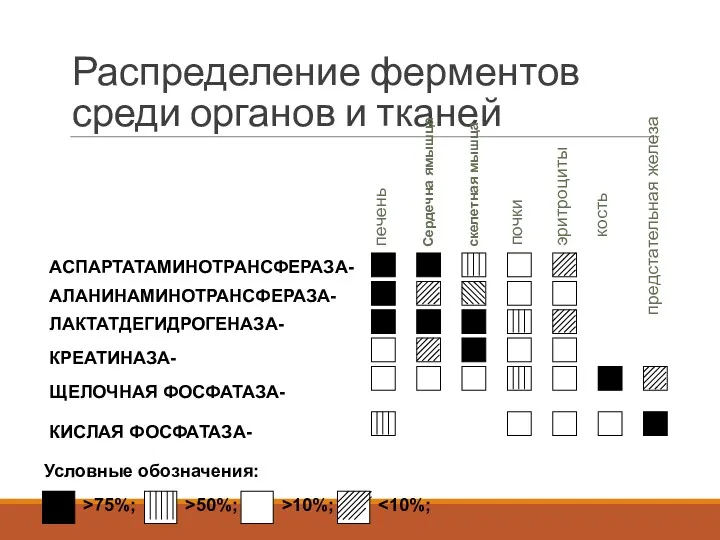
- 51. Распределение ферментов среди органов и тканей >75%; >50%; >10%; Условные обозначения: КИСЛАЯ ФОСФАТАЗА- ЩЕЛОЧНАЯ ФОСФАТАЗА- КРЕАТИНАЗА-
- 53. Скачать презентацию




































 Демэкология. Экология популяций
Демэкология. Экология популяций Живое клеточный уровень. Живое организменный уровень ботаника. Живое организменный уровень зоология
Живое клеточный уровень. Живое организменный уровень ботаника. Живое организменный уровень зоология Field test of Citogumat in China, the year 2018
Field test of Citogumat in China, the year 2018 Жизнедеятельность организмов
Жизнедеятельность организмов Личностно-ориентированное обучение на уроках биологии.
Личностно-ориентированное обучение на уроках биологии. Водоросли
Водоросли Ствол мозга: продолговатый, задний, средний и промежуточный мозг. Занятие № 15
Ствол мозга: продолговатый, задний, средний и промежуточный мозг. Занятие № 15 Микология. Классификация и морфология грибов
Микология. Классификация и морфология грибов Гербициды. (Лекция 8)
Гербициды. (Лекция 8) Насекомые
Насекомые Клас Кісткові риби. Загальна характеристика класу, особливості процесів життєдіяльності
Клас Кісткові риби. Загальна характеристика класу, особливості процесів життєдіяльності Генетика пола
Генетика пола Как вырастить тюльпаны дома
Как вырастить тюльпаны дома Социальная геронтология. Понятие и содержание. (Тема 1)
Социальная геронтология. Понятие и содержание. (Тема 1) Двобічна симетрія тіла
Двобічна симетрія тіла Пути ресинтеза АТФ
Пути ресинтеза АТФ Доклад на тему: Формирование универсальных умений и универсальных учебных действий учащихся в свете требований ФГОС на уроках биологии .
Доклад на тему: Формирование универсальных умений и универсальных учебных действий учащихся в свете требований ФГОС на уроках биологии .  Биохимия печени
Биохимия печени Потоки вещества и энергии, динамика экосистем
Потоки вещества и энергии, динамика экосистем Муравьи. Муравейник
Муравьи. Муравейник Кровообращение и лимфообращение
Кровообращение и лимфообращение Бактерии. Формы бактерий
Бактерии. Формы бактерий Генетичний апарат клітини
Генетичний апарат клітини Лекарственные растения
Лекарственные растения Значение биологии для сельского хозяйства и медицины
Значение биологии для сельского хозяйства и медицины Algorytmy ewolucyjne
Algorytmy ewolucyjne Особенности внешнего строения растений
Особенности внешнего строения растений Особенности строения ферментов
Особенности строения ферментов