Слайд 2
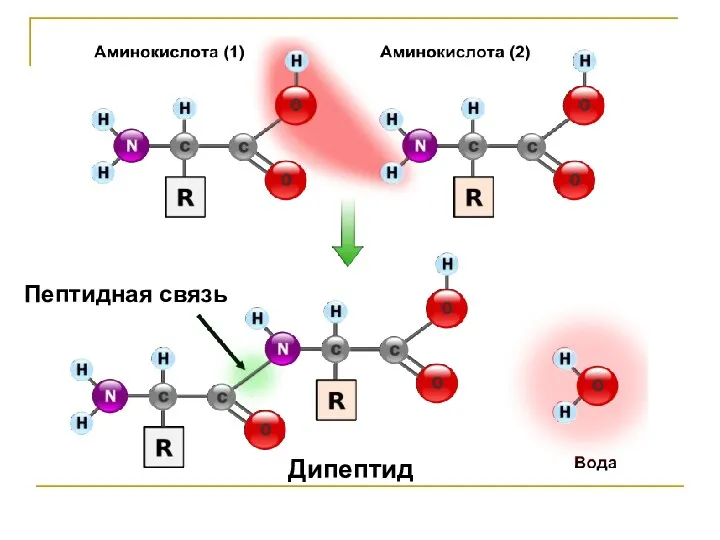
Слайд 3

По структуре радикала (R) выделяют 7 групп аминокислот:
аминокислоты, не имеющие радикала:
глицин;
аминокислоты с углеводородным радикалом: аланин, валин, лейцин, изолейцин, фенилаланин, пролин;
аминокислоты, содержащие в радикале карбоксильную группу: глютаминовая, аспарагиновая кислоты, глютамин, аспарагин;
аминокислоты, содержащие в радикале аминогруппу: лизин, аргинин;
аминокислоты, содержащие в радикале гидроксильную группу: серин, треонин, тирозин, гидроксипролин, гидрокислизин;
аминокислоты, содержащие в радикале тиогруппу: цистеин, цистин, метионин;
аминокислоты, содержащие гетероциклический радикал: гитидин, триптофан.
Слайд 4

По полярности радикала (R) – две группы:
1. Неполярные (гидрофобные) аминокислоты: аланин,
валин, лейцин, изолейцин, фенилаланин, триптофан, пролин, гидроксипролин, метионин;
2. Полярные (гидрофильные) аминокислоты:
а) электронейтральные (незаряженные) аминокислоты: серин, треонин, цистеин, аспарагин, глютамин;
б) кислые (отрицательно заряженные): глютаминовая, апарагиновая;
в) основные (положительно заряженные) аминокислоты: лизин, аргинин, гистидин.
Слайд 5
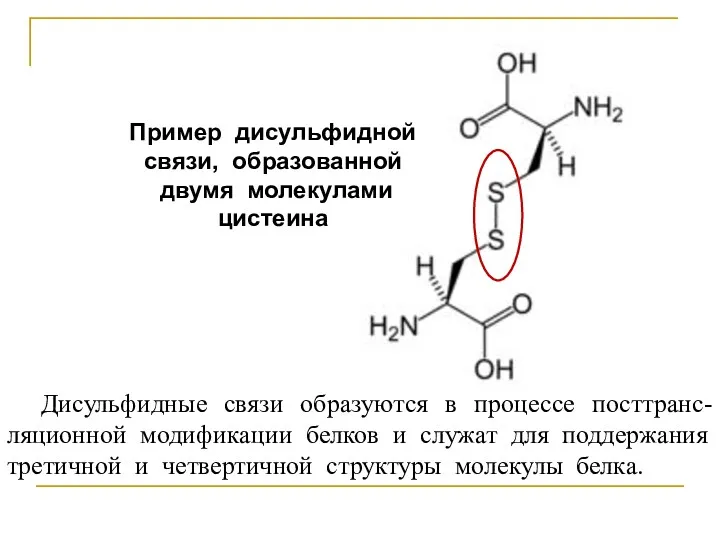
Пример дисульфидной связи, образованной
двумя молекулами цистеина
Дисульфидные связи образуются в процессе
посттранс-
ляционной модификации белков и служат для поддержания третичной и четвертичной структуры молекулы белка.
Слайд 6

Основные типы связей в белковой молекуле:
2) нековалентные
- гидрофобная образуется в результате
сближения неполярных групп;
- водородная – форма ассоциации между электроотрица-тельным атомом и атомом водорода H+, связанным ковалентно
с другим электроотрицательным атомом (N, O или Fe);
- ионная (солевая, электровалентная) образуется между группами –СОО– и +H3N–
Слайд 7
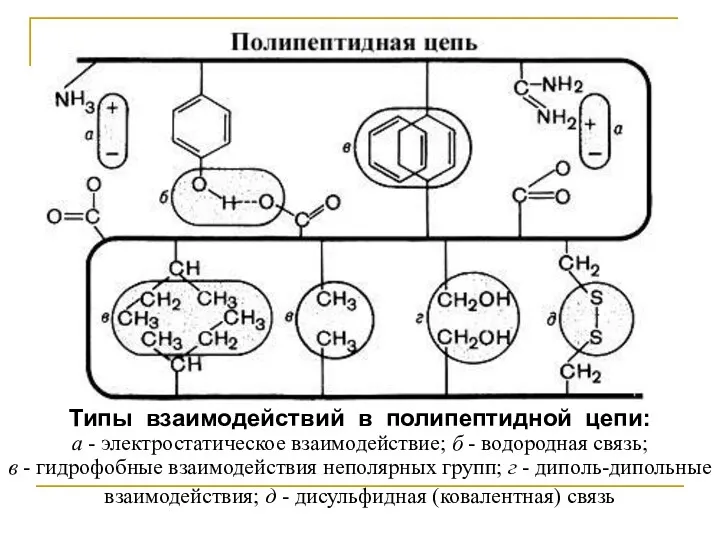
Типы взаимодействий в полипептидной цепи:
а - электростатическое взаимодействие; б - водородная
связь;
в - гидрофобные взаимодействия неполярных групп; г - диполь-дипольные взаимодействия; д - дисульфидная (ковалентная) связь
Слайд 8
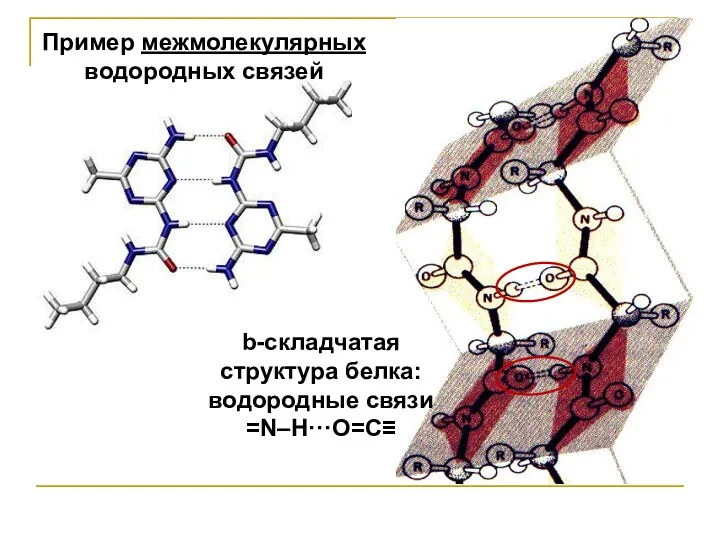
Пример межмолекулярных
водородных связей
b-складчатая
структура белка:
водородные связи
=N–H···O=С≡
Слайд 9

Структурная организация белков
Первичная структура белка – это порядок чередования аминокислотных остатков
в полипептидной цепи (ППЦ). Определяется числом и последовательностью аминокислот
в ППЦ, соединённых друг с другом пептидными связями.
Вторичная структура белка – это упорядоченное расположение гибких полипептидных цепей, возникающее
за счёт водородных связей, то есть способ укладки или скручивания ППЦ в определённую конформацию –
α-спираль, β-структуру или беспорядочный клубок.
Третичная структура белка – компактное расположение или упаковка в пространстве одной или нескольких ППЦ
в определенном объеме, в глобулу. Поддерживается связями 3-х типов: ионными, водородными, дисульфидными, а также гидрофобными взаимодействиями.
Четвёртичная структура белка – способ соединения и пространственной укладки полипептидных цепей относительно друг друга. Цепи соединяются между собой нековалентными связями.
Слайд 10

1) Первичная структура белков уникальна. Каждый индиви-дуальный гомогенный белок характеризуется уникальной
после-довательностью аминокислот: частота замены аминокислот при-водит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций белка.
2) Стабильность первичной структуры обеспечивается
пептидными связями при участии дисульфидных связей.
3) В ППЦ могут быть обнаружены разнообразные комбинации аминокислот; редки повторяющиеся последовательности.
4) В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров.
5) В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие её общую пространственную конформацию.
Слайд 11
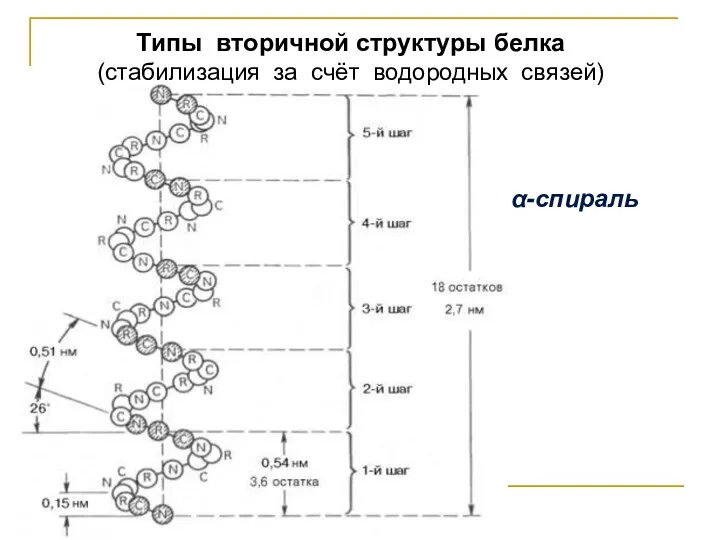
α-спираль
Типы вторичной структуры белка
(стабилизация за счёт водородных связей)










 Цікаві факти про метеликів: швидше, далі, яскравіше
Цікаві факти про метеликів: швидше, далі, яскравіше Движущие силы эволюции по Дарвину. Формы естественного отбора
Движущие силы эволюции по Дарвину. Формы естественного отбора История представлений о развитии жизни на Земле
История представлений о развитии жизни на Земле Генетика пола. Наследование сцепленное с полом
Генетика пола. Наследование сцепленное с полом Генетически модифицированные организмы (ГМО)
Генетически модифицированные организмы (ГМО) Многообразие природы родного края. Краснодарский край
Многообразие природы родного края. Краснодарский край Самые редкие и необычные породы кошек
Самые редкие и необычные породы кошек Суарудың гидропоника әдісі
Суарудың гидропоника әдісі Органоиды цитоплазмы: клеточный центр, органоиды движения. Включения
Органоиды цитоплазмы: клеточный центр, органоиды движения. Включения Размножение. Начало новой жизни
Размножение. Начало новой жизни Типы наследования признаков у человека
Типы наследования признаков у человека Большой практикум. Опорно-двигательная система
Большой практикум. Опорно-двигательная система Биосинтез белка
Биосинтез белка Биология 9 классы 15.04 Кочетова М И
Биология 9 классы 15.04 Кочетова М И Использование современного оборудования в образовательном процессе
Использование современного оборудования в образовательном процессе ГОСТы на посадочный материал
ГОСТы на посадочный материал Соединения костей
Соединения костей Плоды. Строение плода. Классификация плодов
Плоды. Строение плода. Классификация плодов Методы биологических исследований
Методы биологических исследований Генная инженерия растений
Генная инженерия растений Закономерности индивидуального развития опорно-двигательного аппарата
Закономерности индивидуального развития опорно-двигательного аппарата Анатомия. Мышцы
Анатомия. Мышцы Онтогенез. 10 класс
Онтогенез. 10 класс Основы сравнительной эмбриологии
Основы сравнительной эмбриологии Сколько царств живой природы?
Сколько царств живой природы? Живая и неживая природа
Живая и неживая природа Биология клетки. Лекция 1
Биология клетки. Лекция 1 Насекомые
Насекомые