Содержание
- 2. OBIECTIVELE: Noţiune despre enzime şi rolul lor biologic. Asemănările și deosebirile dintre acţiunea enzimelor şi a
- 3. NOȚIUNE DE ENZIMĂ ENZIMĂ – de la grecescul “EN ZYME”- în drojdii Enzime – biocatalizatori de
- 4. ROLUL BIOLOGIC Digestiv (enzimele digestiei) Metabolic MEDICAL ENZIMODIAGNOSTICUL ENZIMOTERAPIA
- 5. Natura chimică a E E- sunt proteine şi posedă toate proprietăţile fizico-chimice specifice acestor molecule (solubilitate,
- 6. Asemănările E cu catalizatorii neorganici catalizează numai reacţiile posibile din punct de vedere energetic nu modifică
- 7. Deosebirile enzimelor (E) de catalizatorii neorganici Viteza catalizei enzimatice este cu mult mai mare decât a
- 8. Deosebirile E de catalizatorii neorganici 4. E catalizează reacţiile fără formarea produselor intermediare – randamentul este
- 9. Structura enzimelor (E) Masa moleculară a E e de mii de ori mai mare decât masa
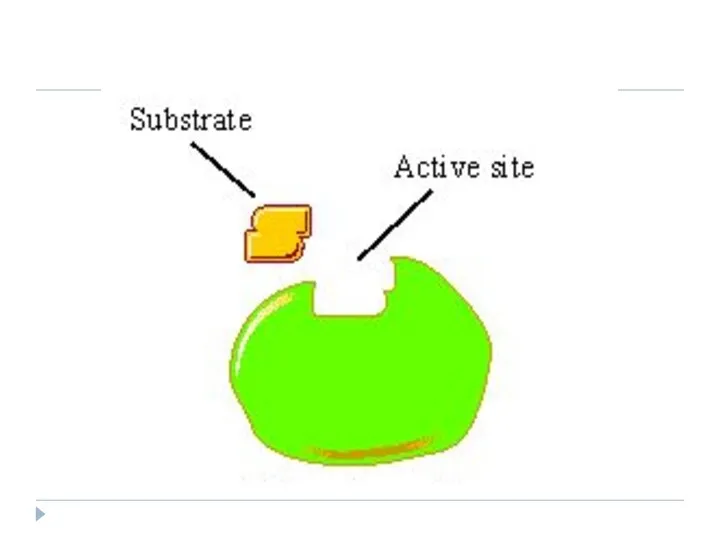
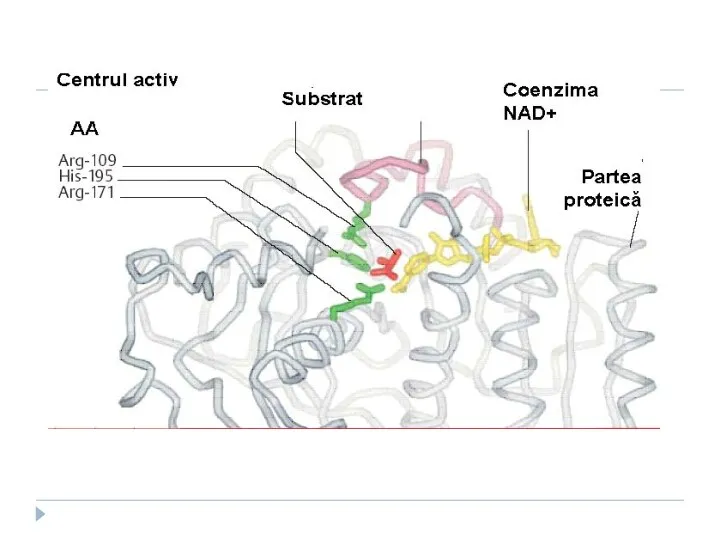
- 12. Particularităţile CA este o structură tridimensională unicală, formată din radicali ai aminoacizilor distanţaţi în catena primară
- 15. Particularităţile CA 3. Are formă de adâncitură sau cavitate 4. Ocupă o parte relativ mică din
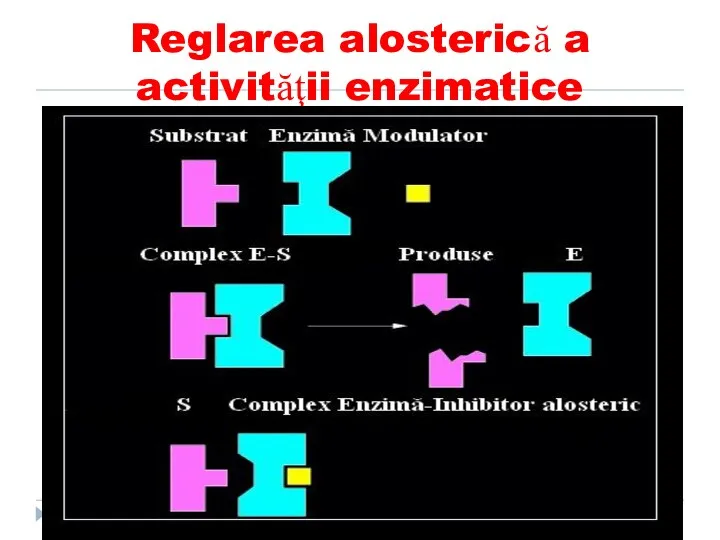
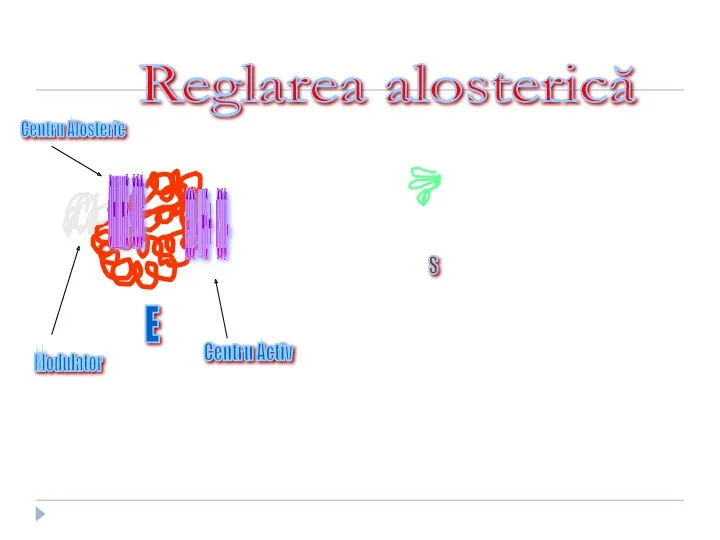
- 16. Organizarea funcţională a enzimelor Centrul alosteric Este centrul reglator Fixează modulatorul alosteric Adiţionarea modulatorului modifică conformaţia
- 17. Reglarea alosterică a activităţii enzimatice
- 18. S COO- NH3+ COO- E Centru Activ Modulator Reglarea alosterică OH NH3 -OOC Centru Alosteric
- 19. Enzime alosterice Moleculele enzimelor alosterice sunt mai mari, mai complexe şi sunt oligomere pare Au cinetica
- 21. Structura enzimelor Din punct de vedere structural deosebim: E simple – alcătuite numai din AA (proteazele,
- 22. PARTEA NEPROTEICĂ A E A: Când componenta neproteică este un ion metalic – este denumită cofactor
- 23. PARTEA NEPROTEICĂ A E B: Când componenta neproteică este o moleculă organică de mici dimensiuni –
- 24. Coenzimele Coenzima strâns legată în structura E – grupare prostetică (FMN; FAD, biotina, acidul lipoic) Coenzima
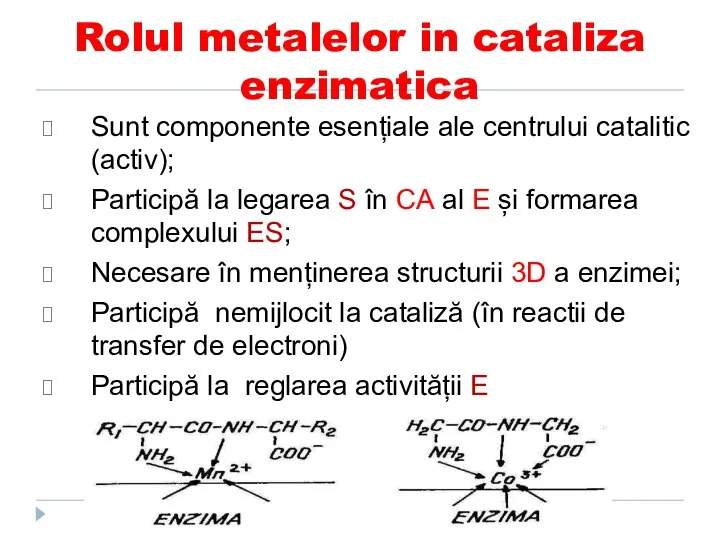
- 25. Rolul metalelor in cataliza enzimatica Sunt componente esențiale ale centrului catalitic (activ); Participă la legarea S
- 26. Ionii de metale –cofactori ai E După modul de legare şi rolul ionului metalic E sunt:
- 27. EXEMPLE DE METALOENZIME - Fe-enzime: hem (citocromi, catalaze, peroxidaze); - Cu-enzime: citocromoxidaza, superoxid-dismutaza, tiroxin-hidroxilaza; - Mn-enzime:
- 28. Coenzimele (CoE) Sunt parte componentă a centrului activ Contribuie la stabilizarea conformaţiei enzimei Contribuie la fixarea
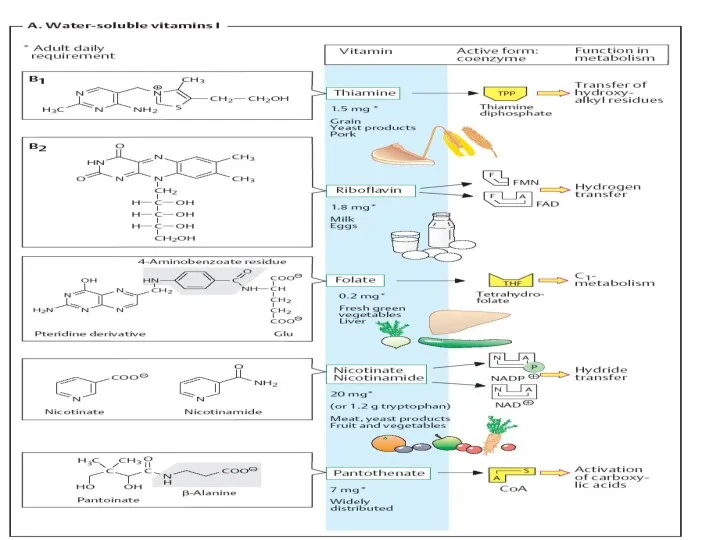
- 29. Clasificarea CoE CoE vitaminice Tiaminice Flavinice Nicotinamidice Piridoxinice Folice Cobamidice Biotinice lipoice CoE nevitaminice hemurile de
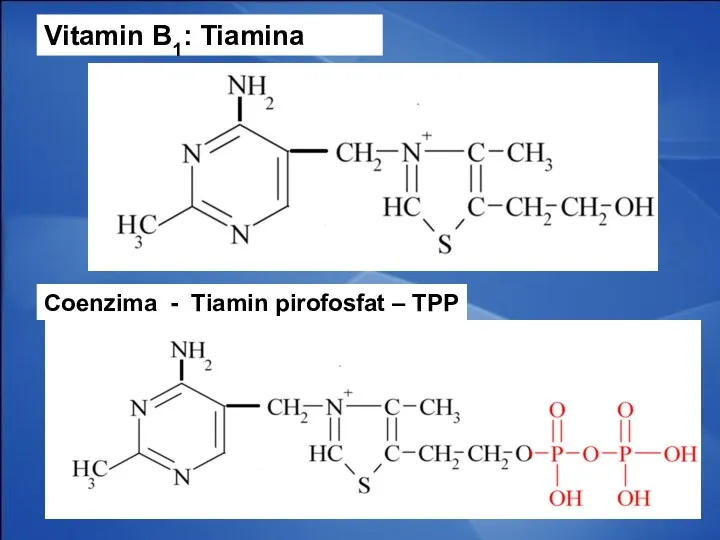
- 31. Coenzimele tiaminice Derivaţii vitaminei B1 (tiamina) CoE - TMP, TDP (TPP)cocarboxilaza, TTP Rolul: Decarboxilarea oxidativă a
- 32. Vitamin B1: Tiamina Coenzima - Tiamin pirofosfat – TPP
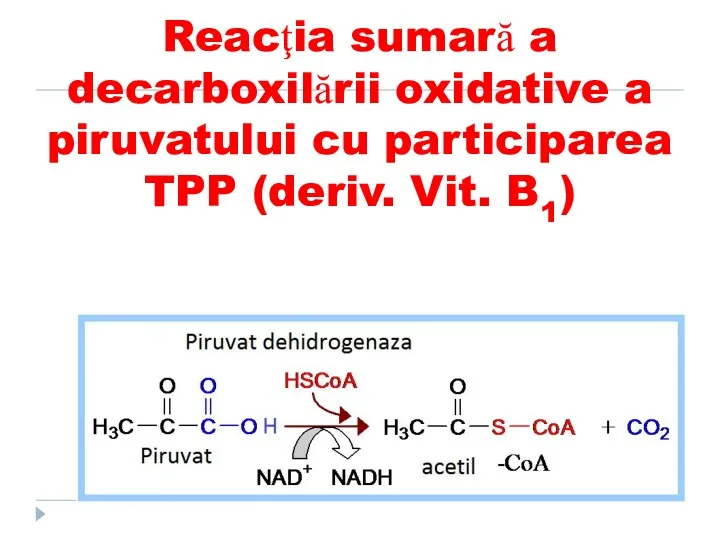
- 33. Reacţia sumară a decarboxilării oxidative a piruvatului cu participarea TPP (deriv. Vit. B1)
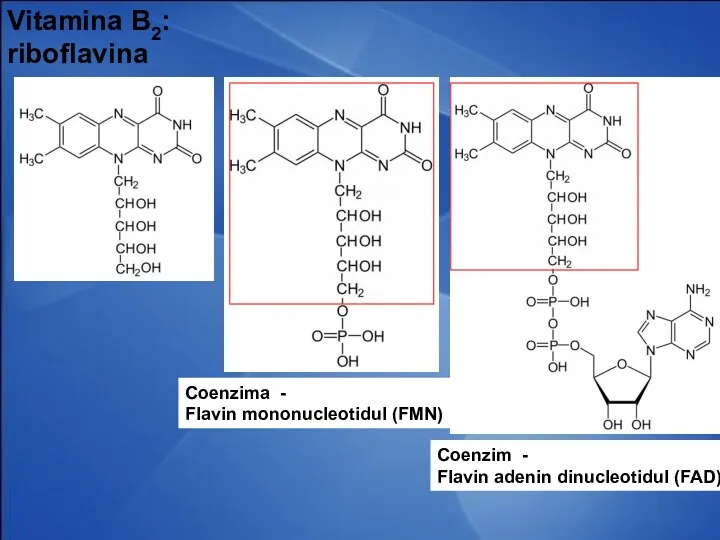
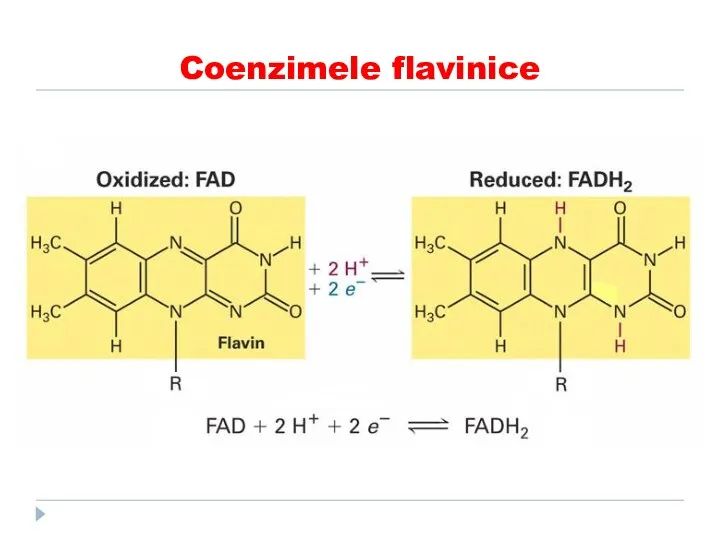
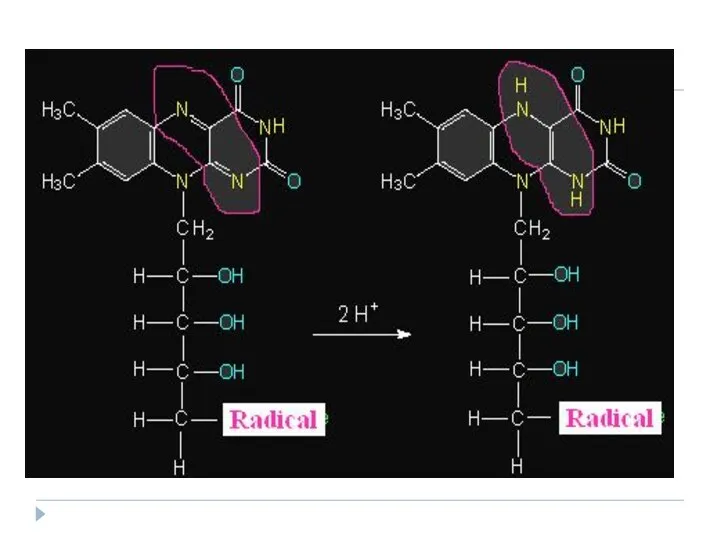
- 34. Coenzimele flavinice Derivaţi ai vitaminei B2 - riboflavina structură heterociclică numita izoaloxazină
- 35. Coenzimele flavinice CoE- Flavin mononucleotidul (FMN) Flavinadenindinucleotidul (FAD) Rolul: Participă în reacţiile de oxido-reducere: Dezaminarea AA
- 36. Vitamina B2: riboflavina Coenzim - Flavin adenin dinucleotidul (FAD) Coenzima - Flavin mononucleotidul (FMN)
- 37. Coenzimele flavinice
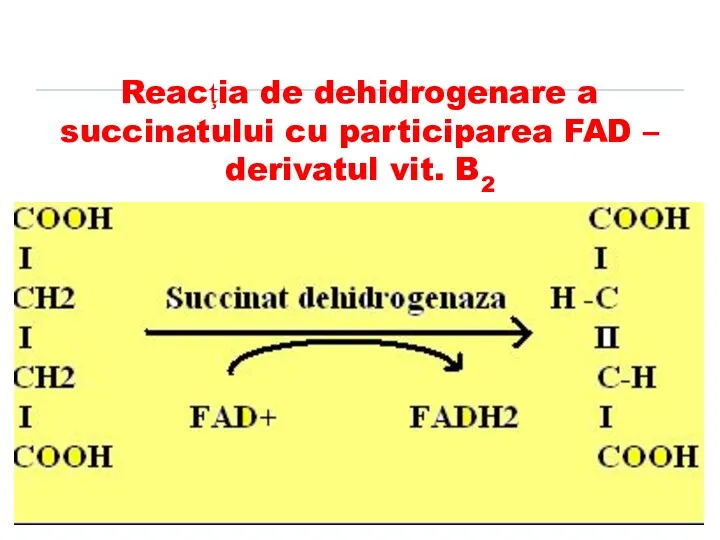
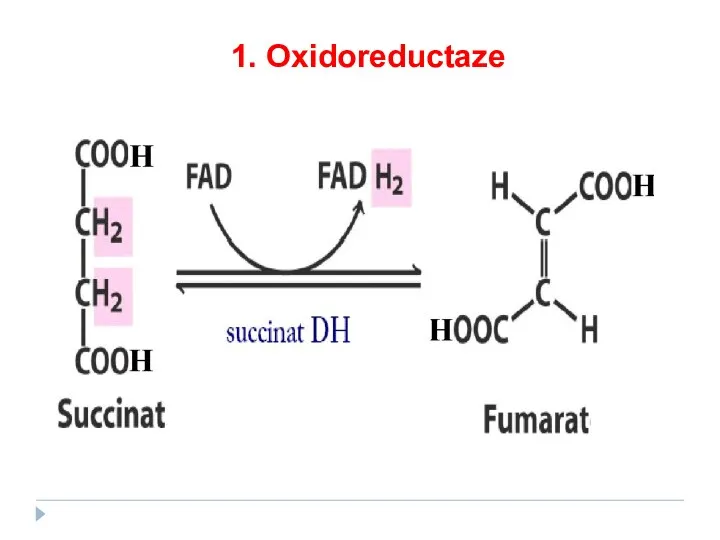
- 39. Reacţia de dehidrogenare a succinatului cu participarea FAD – derivatul vit. B2
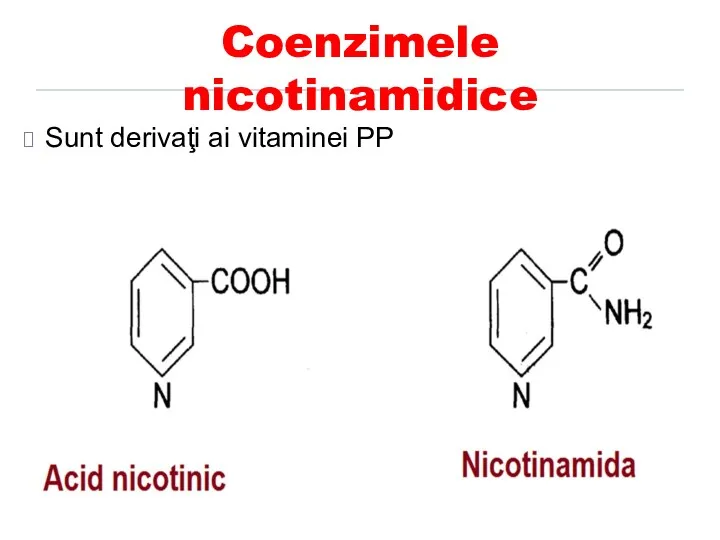
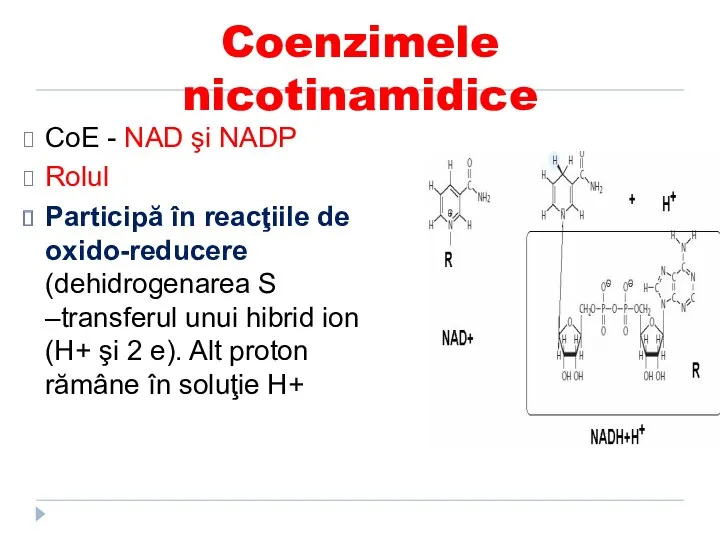
- 40. Coenzimele nicotinamidice Sunt derivaţi ai vitaminei PP
- 41. Coenzimele nicotinamidice CoE - NAD şi NADP Rolul Participă în reacţiile de oxido-reducere (dehidrogenarea S –transferul
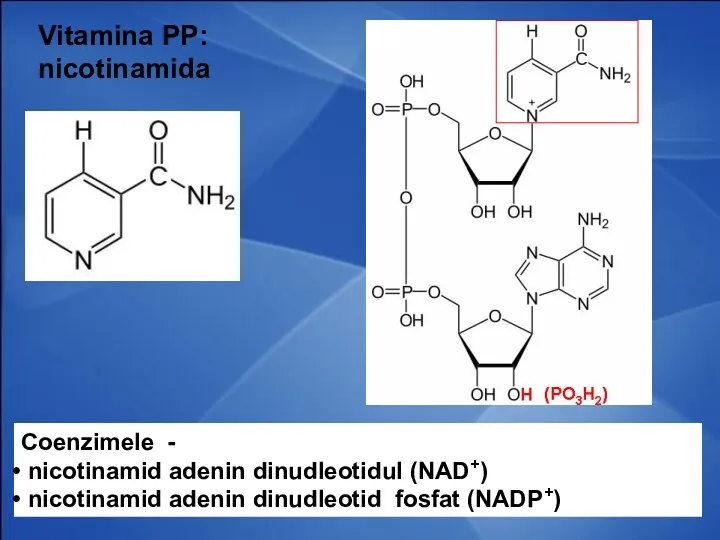
- 42. Vitamina PP: nicotinamida Coenzimele - nicotinamid adenin dinudleotidul (NAD+) nicotinamid adenin dinudleotid fosfat (NADP+)
- 43. Coenzimele nicotinamidice
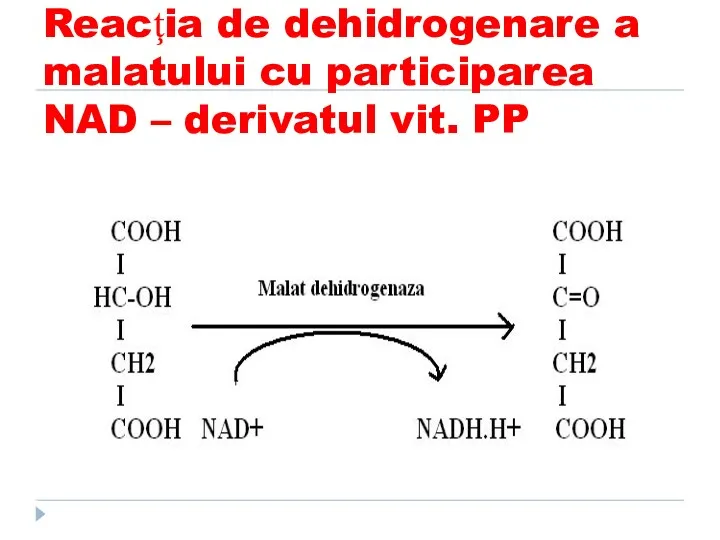
- 44. Reacţia de dehidrogenare a malatului cu participarea NAD – derivatul vit. PP
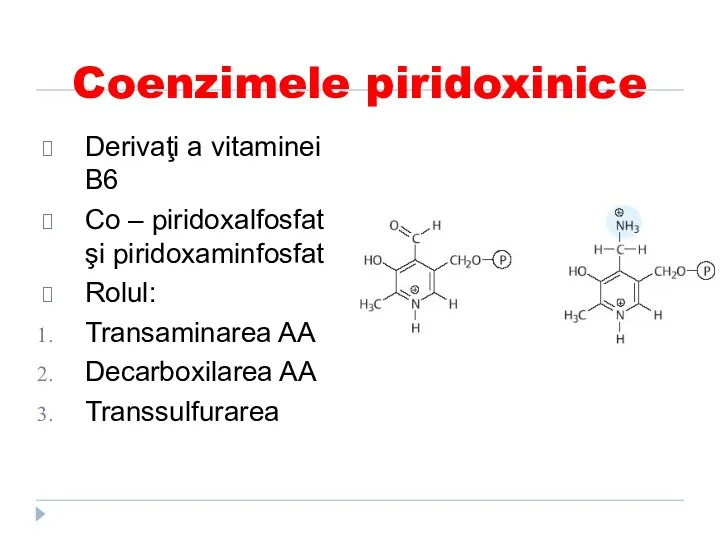
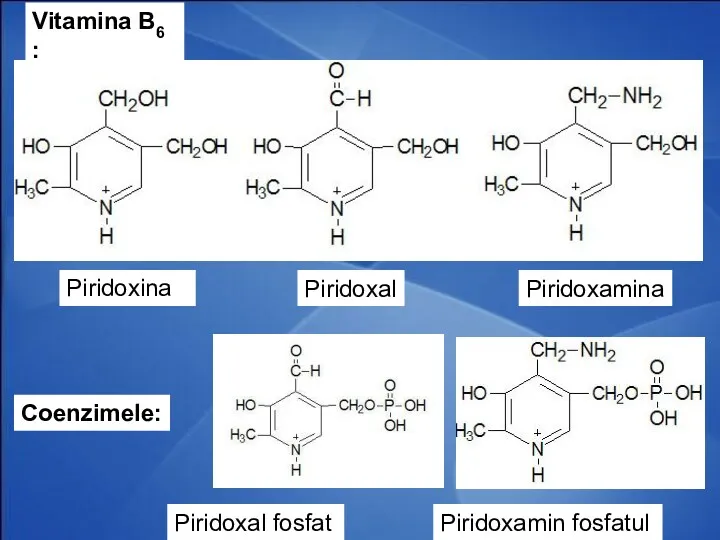
- 45. Coenzimele piridoxinice Derivaţi a vitaminei B6 Co – piridoxalfosfat şi piridoxaminfosfat Rolul: Transaminarea AA Decarboxilarea AA
- 46. Vitamina B6 : Piridoxal fosfat Piridoxamin fosfatul Piridoxina Piridoxal Piridoxamina Coenzimele:
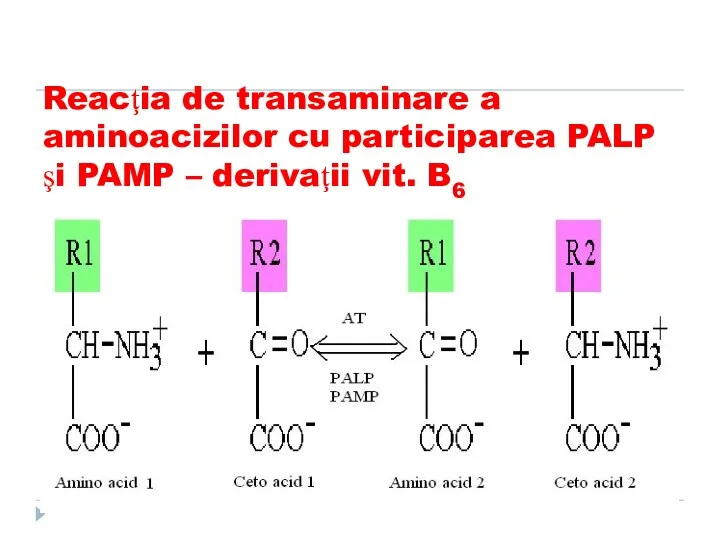
- 47. Reacţia de transaminare a aminoacizilor cu participarea PALP şi PAMP – derivaţii vit. B6
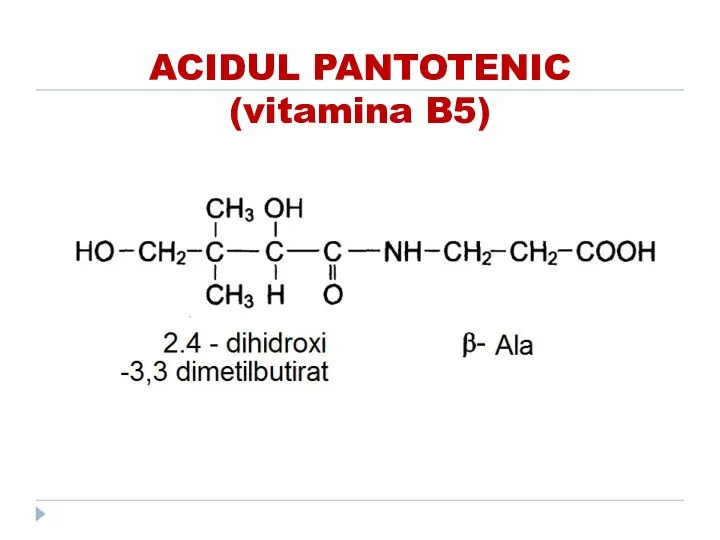
- 48. ACIDUL PANTOTENIC (vitamina B5)
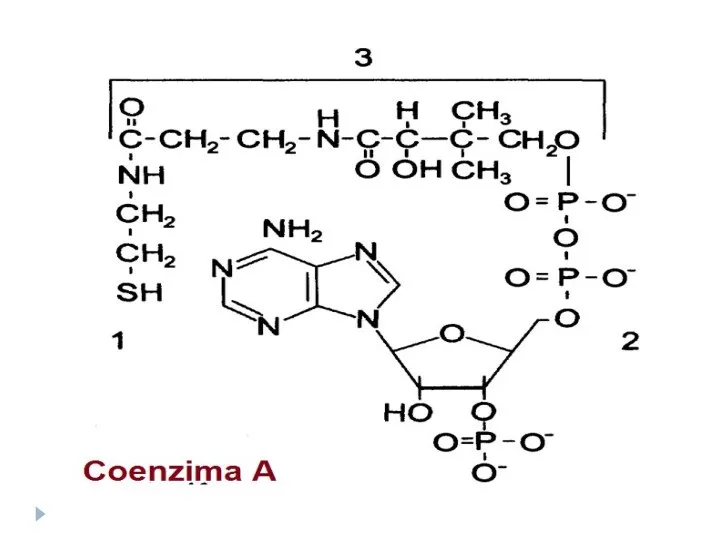
- 49. Coenzimele acidului pantotenic: Coenzima A Fosfopantoteina Rolul metabolic: Coenzima A - la activarea acizilor grași Fosfopantoteina
- 51. Co pantotenice (B5)- HS-CoA biosinteza AG biosinteza Col sinteza corpilor cetonici Oxidarea AG Ciclul Krebs Sinteza
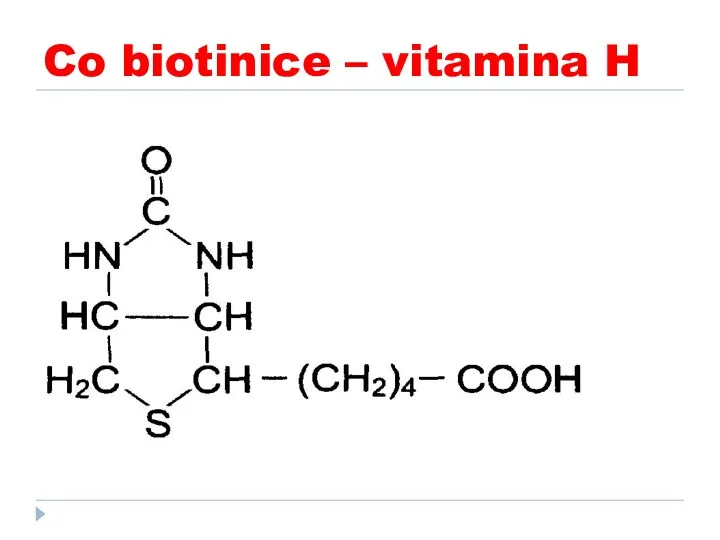
- 52. Co biotinice – vitamina H
- 53. Co biotinice – vitamina H ROL: Participă în reacțiile de carboxilare a piruvatului, acetil Co A
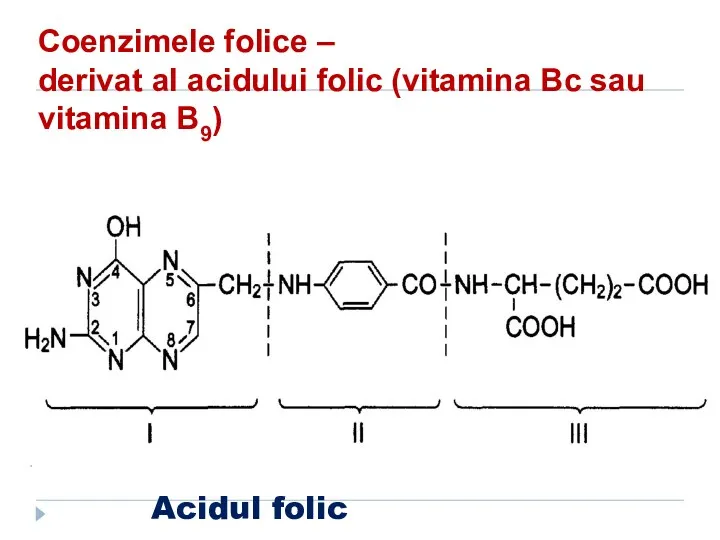
- 54. Coenzimele folice – derivat al acidului folic (vitamina Bc sau vitamina B9) Acidul folic
- 55. Co folice acidul tetrahidrofolic
- 56. ROLUL THF transportator al unor fragmente cu un atom de carbon (grupări monocarbonice): -metil (-CH3), -metilen
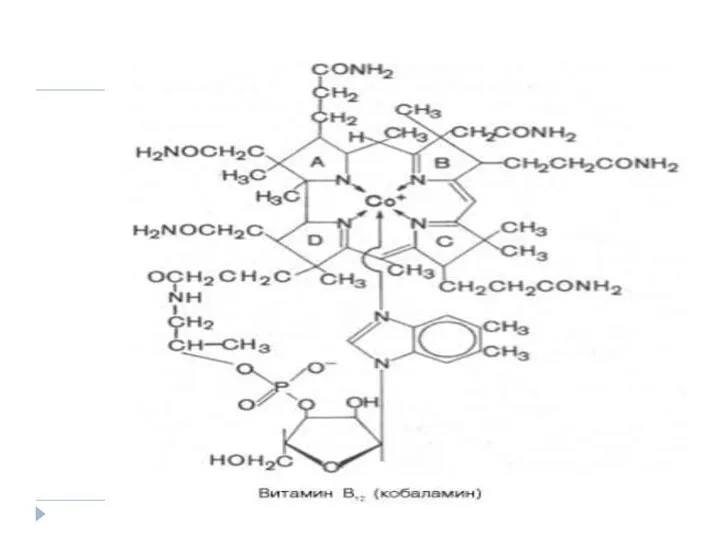
- 57. Co cobamidice – B12 -ciancobalamina Vitamină antipernicioasă pentru om şi factor de creştere pentru microorganisme În
- 59. MECANISMUL DE ACŢIUNE AL ENZIMELOR. CLASIFICAREA ŞI NOMENCLATURA ENZIMELOR. CINETICA REACŢIILOR ENZIMATICE
- 60. OBIECTIVE Nomenclatura (denumirea) şi clasificarea enzimelor. Caracteristica generală a claselor şi subclaselor principale de enzime. Numărul
- 61. CLASIFICAREA ENZIMELOR
- 62. NOMENCLATURA ENZIMELOR DENUMIREA COMUNĂ: Numele substratului (S) + sufixul «aza» (glucozidaza, ureaza, lipaza, nucleaza) sau denumirea
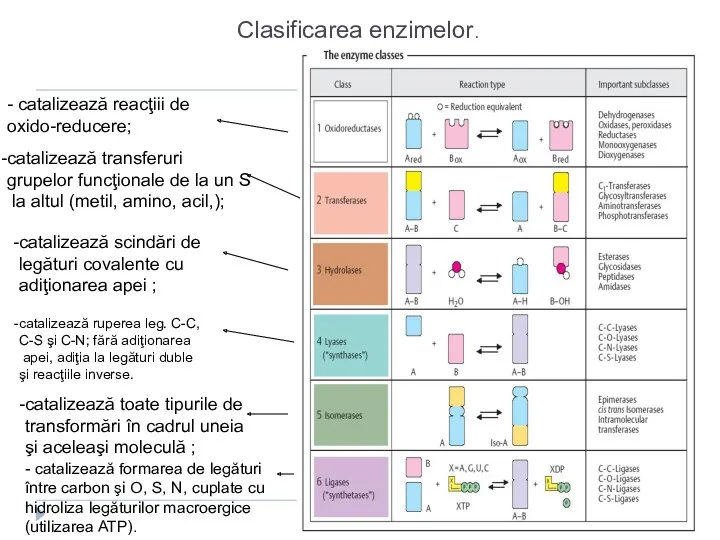
- 63. Clasificarea actuală a enzimelor Toate E se împart în: şapte clase, clasele în subclase, subclasele în
- 64. Clasificarea actuală a enzimelor Ex: LDH - 1.1.1.27 Clasa reprezintă tipul de reacţie, catalizat de enzime
- 65. Clasificarea actuală a enzimelor Oxidoreductaze Transferaze Hidrolaze Liaze Izomeraze Ligaze (sintetaze) Translocaze
- 66. Clasificarea enzimelor. - catalizează formarea de legături între carbon şi O, S, N, cuplate cu hidroliza
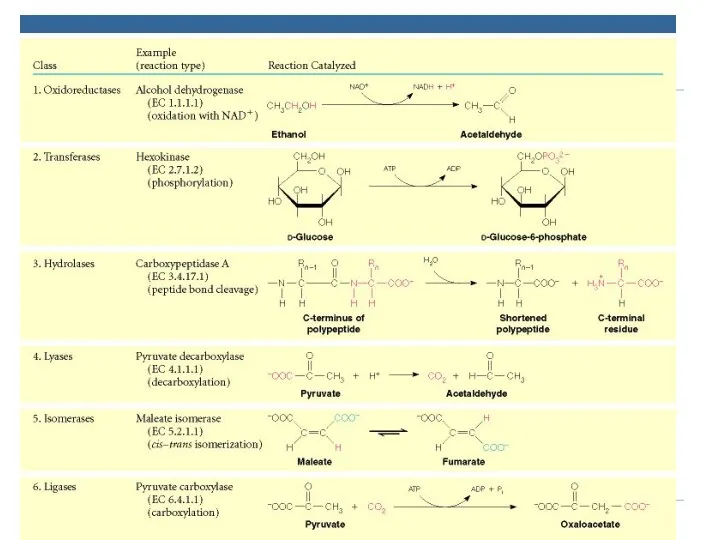
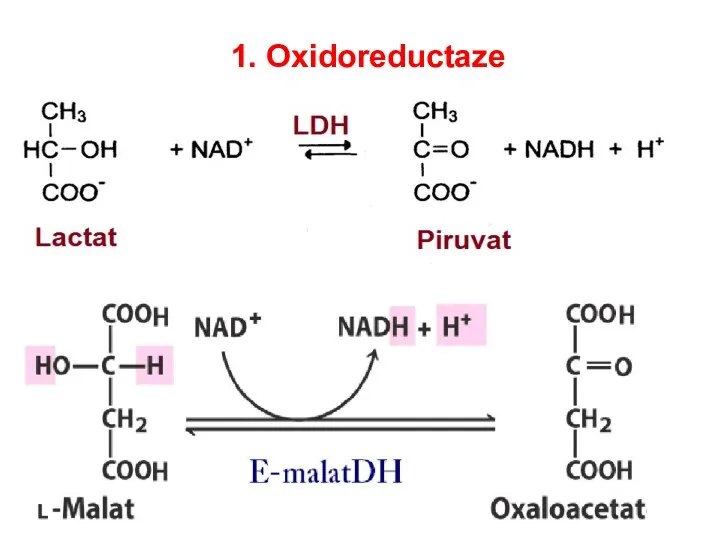
- 68. 7 clase de Enzime 1. Oxidoreductaze catalizează reacţiii de oxido-reducere SUBCLASELE: Dehidrogenaze Reductaze Oxidaze, Peroxidaze, Hidroxilaze,
- 69. 1. Oxidoreductaze
- 70. 1. Oxidoreductaze
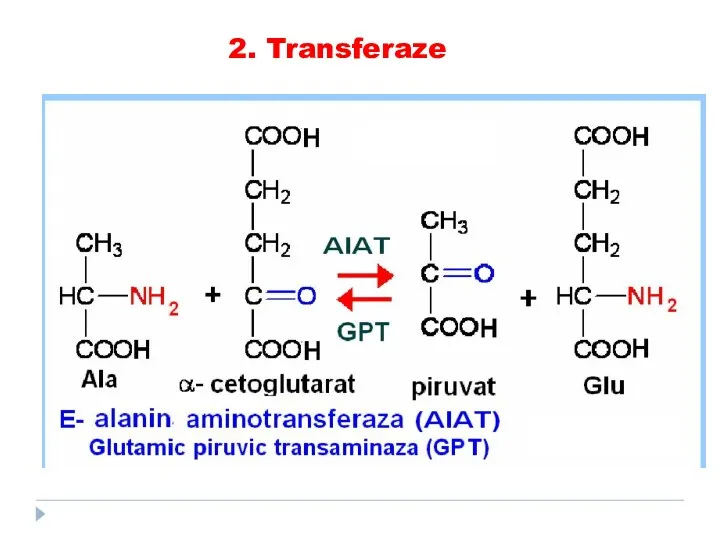
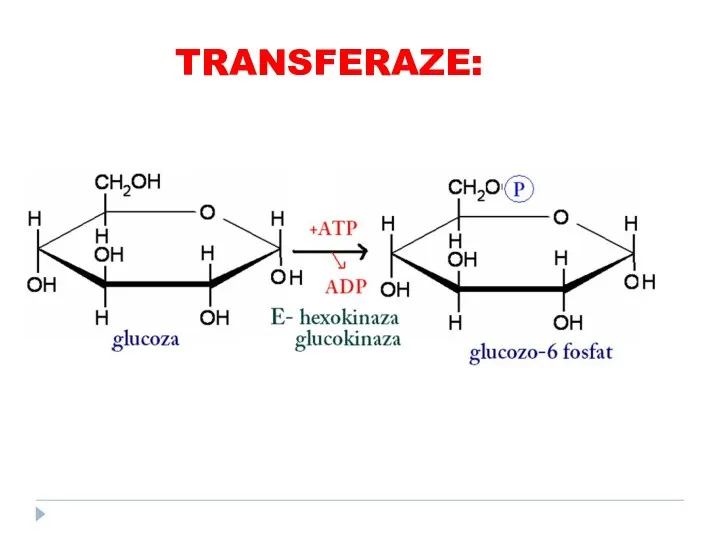
- 71. 2. Transferaze catalizează transferuri grupelor funcţionale de la un substrat la altul (metil, amino, acil) SUBCLASELE:
- 72. 2. Transferaze
- 73. TRANSFERAZE:
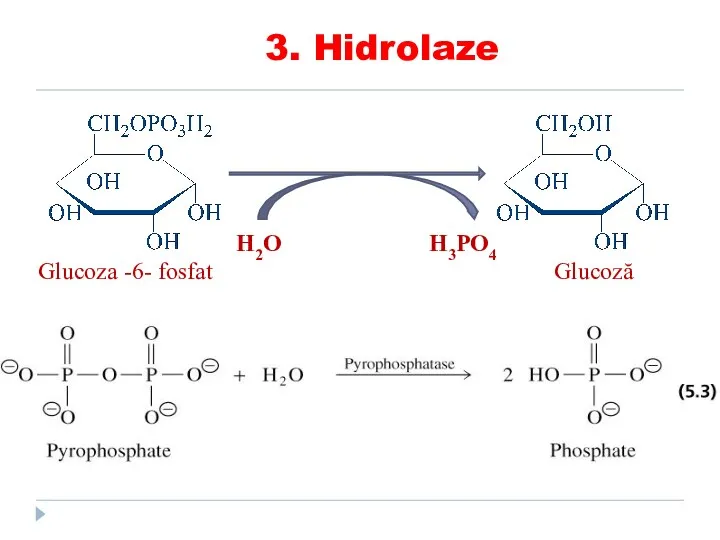
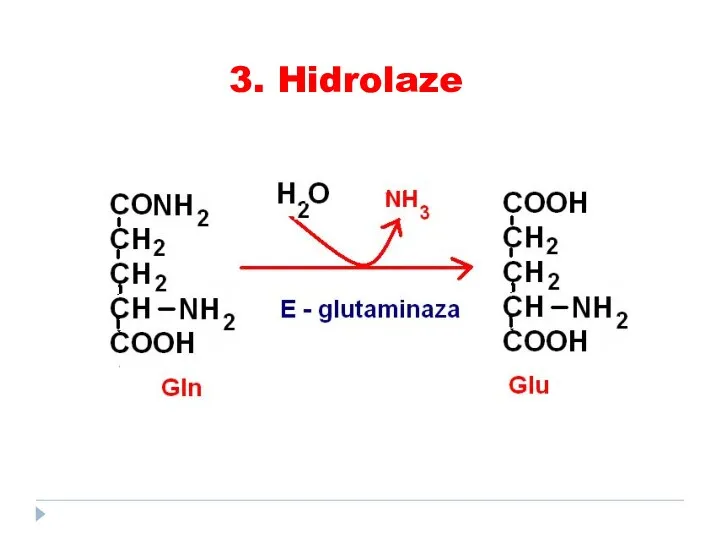
- 74. 3. Hidrolaze catalizează scindări de legături covalente cu adiţionarea apei SUBCLASELE: Esteraze Glicozidaze Peptidaze Fosfataze Tiolaze
- 75. H2O H3PO4 Glucoza -6- fosfat Glucoză 3. Hidrolaze
- 76. 3. Hidrolaze
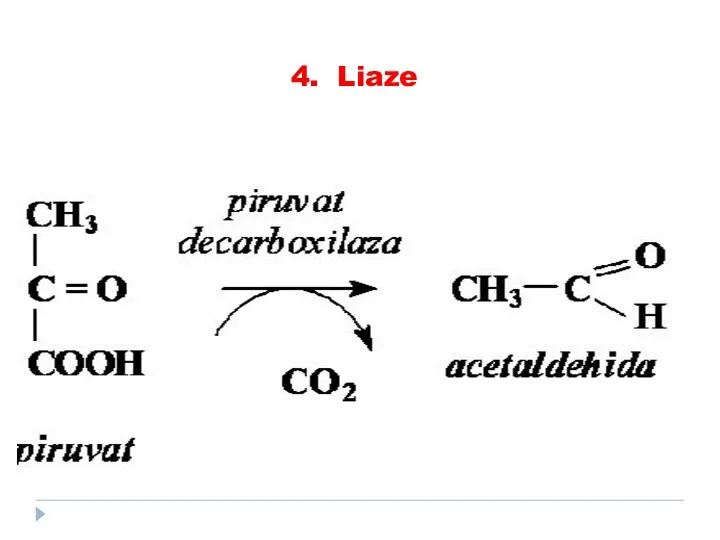
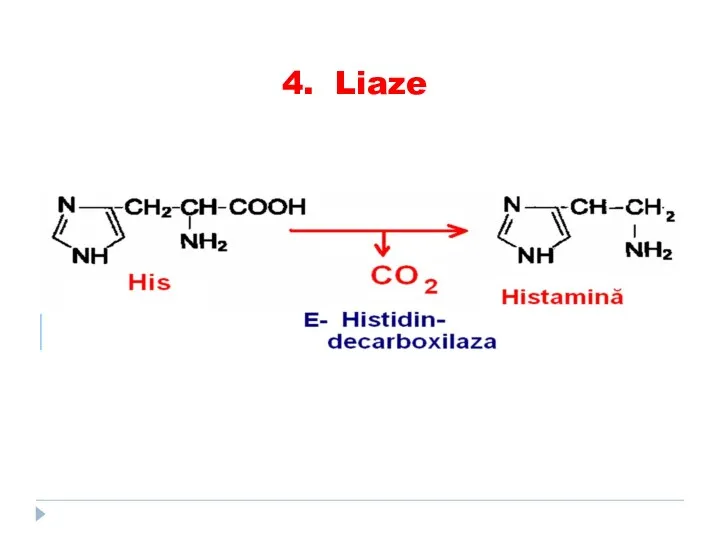
- 77. 4. Liaze catalizează ruperea leg. C-C, C-S şi C-N; fără adiţionarea apei, adiţia la legături duble
- 78. 4. Liaze
- 79. 4. Liaze
- 80. 4. Liaze
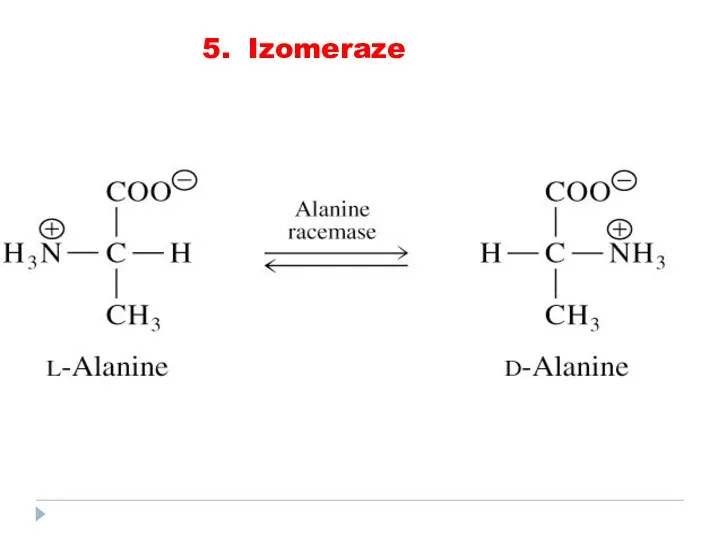
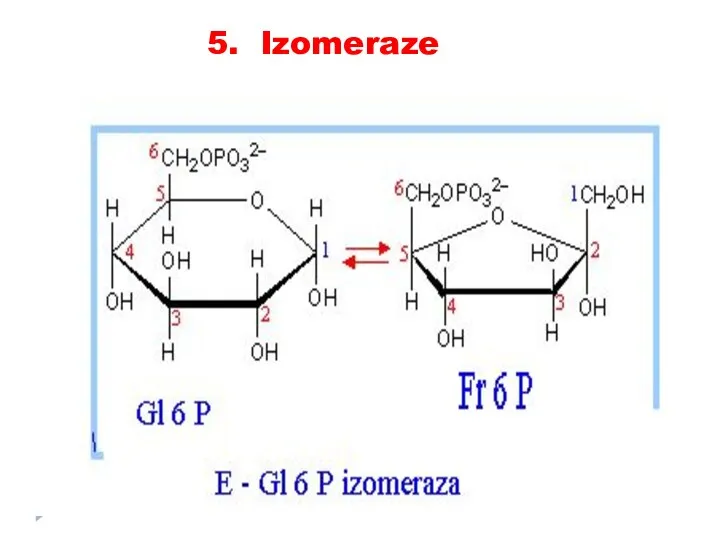
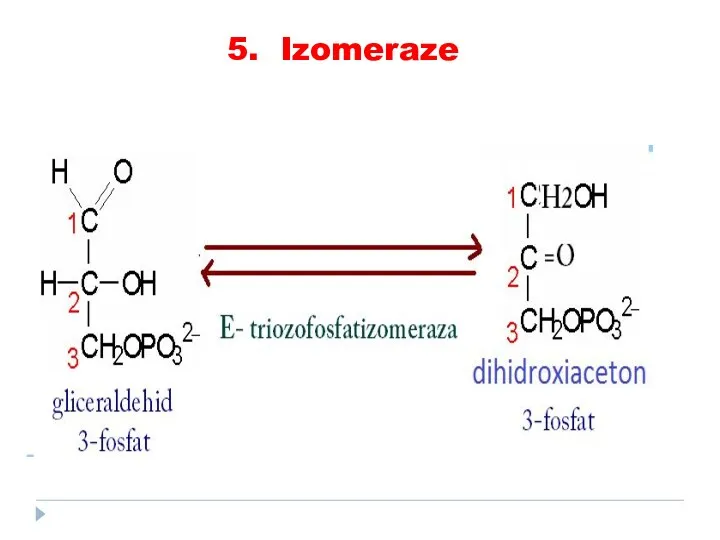
- 81. 5. Izomeraze catalizează toate tipurile de transformări în cadrul uneia şi aceleiaşi moleculă SUBCLASELE: Racemaze Epimeraze
- 82. 5. Izomeraze
- 83. 5. Izomeraze
- 84. 5. Izomeraze
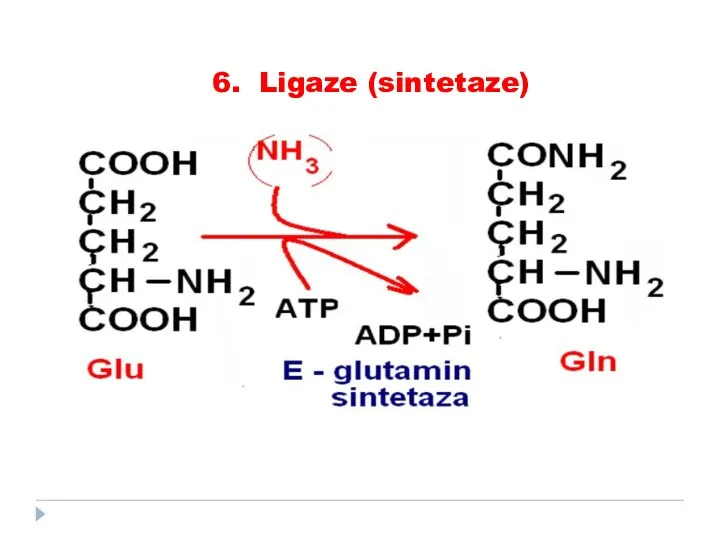
- 85. 6. Ligaze (sintetaze) catalizează formarea de legături între carbon şi O, S, N, cuplate cu hidroliza
- 86. 6. Ligaze (sintetaze)
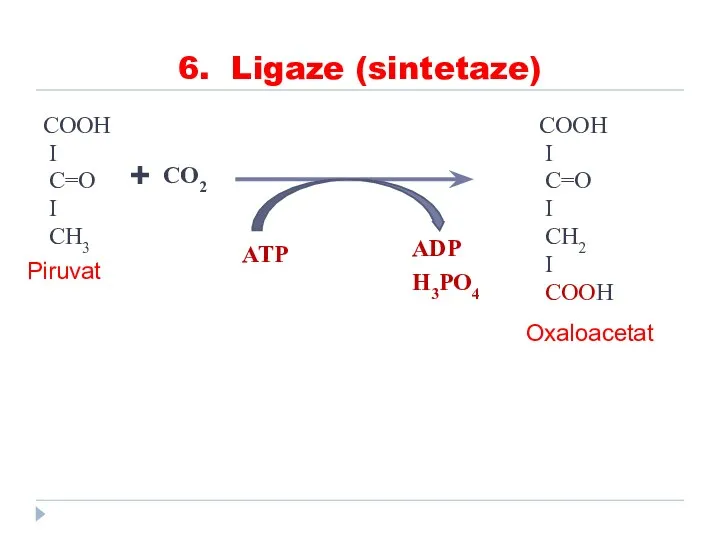
- 87. 6. Ligaze (sintetaze) COOH I C=O I CH3 COOH I C=О I CН2 I CООН ADP
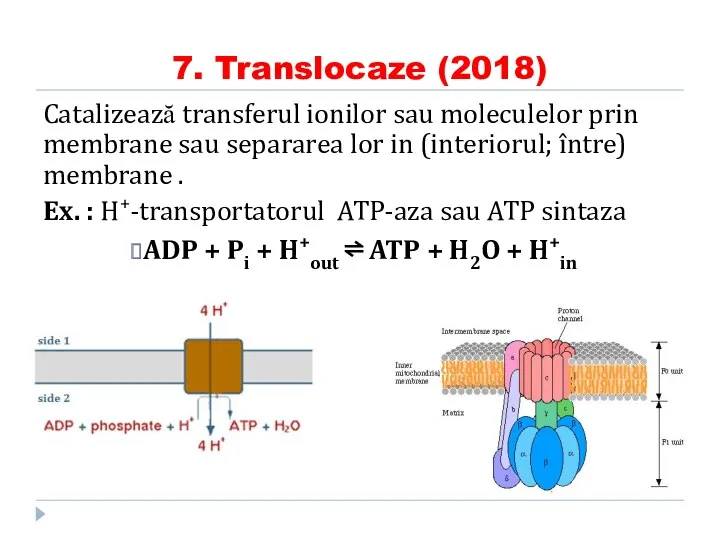
- 88. 7. Translocaze (2018) Catalizează transferul ionilor sau moleculelor prin membrane sau separarea lor in (interiorul; între)
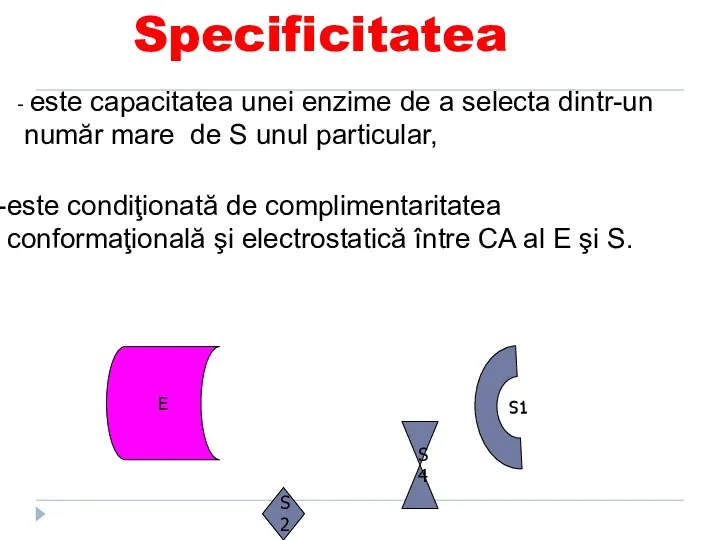
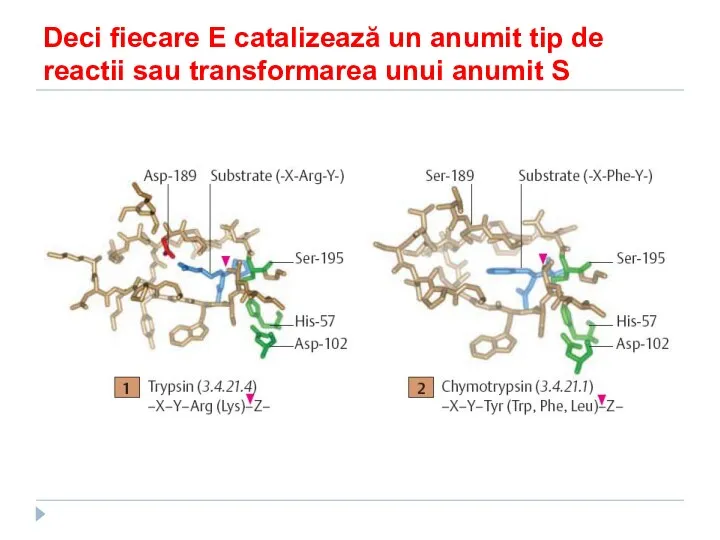
- 89. Specificitatea E S1 S2 S4 este condiţionată de complimentaritatea conformaţională şi electrostatică între CA al E
- 90. Deci fiecare E catalizează un anumit tip de reactii sau transformarea unui anumit S
- 91. SPECIFICITATEA De reacție De substrat: A. Absolută B. Relativă C. stereospecificitate
- 92. Specificitatea: Specificitatea de reacţie: enzimele catalizează un anumit tip de reacţie ce stă la baza clasificării
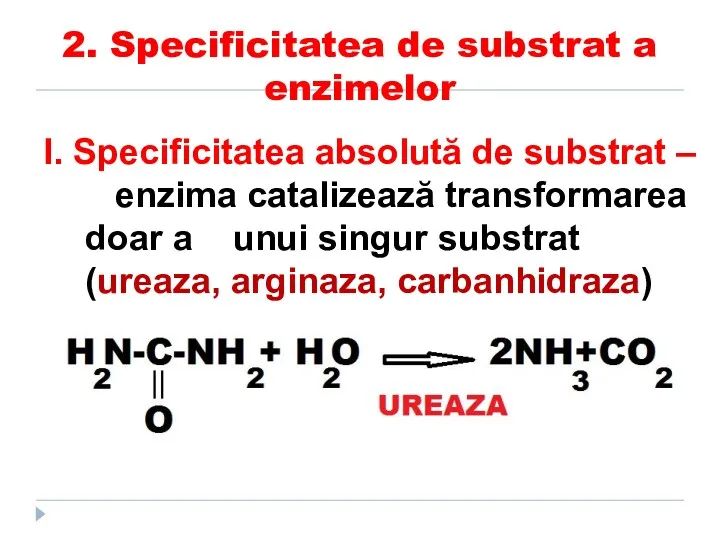
- 93. 2. Specificitatea de substrat a enzimelor I. Specificitatea absolută de substrat – enzima catalizează transformarea doar
- 94. Specificitatea de substrat a enzimelor II. Specificitatea relativă de substrat – enzima catalizează transformarea unei grup
- 95. Specificitatea de substrat a enzimelor specificitate relativa de substrat - asigura transformarea unui grup de substante
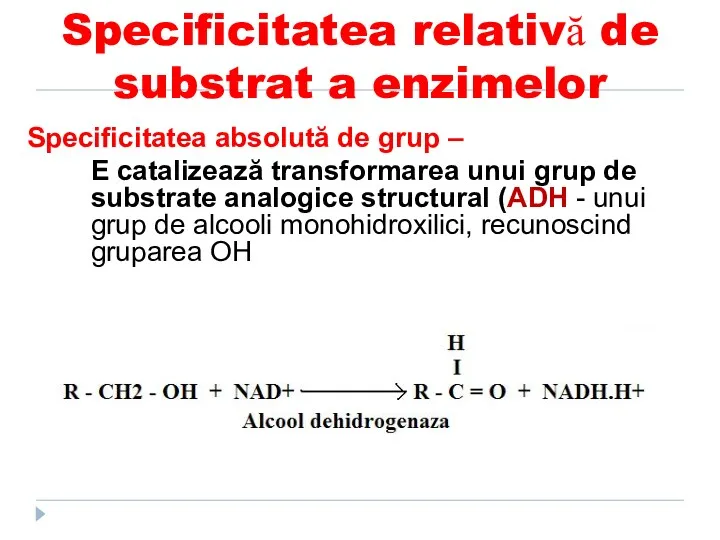
- 96. Specificitatea relativă de substrat a enzimelor Specificitatea absolută de grup – E catalizează transformarea unui grup
- 97. Specificitatea relativă de substrat a enzimelor Specificitatea relativă de grup – enzima catalizează transformarea unei anumite
- 98. Specificitatea relativă de grupă
- 99. Specificitate stereochimică E catalizează transformarea numai a unuia din stereoizomerii posibili (D sau L; sau numai
- 100. Specificitate stereochimică Hexokinaza – specificitate la D- glucoză Oxidazele – specificitate la L-AA Fumaraza – specificitate
- 101. MECANISMUL DE ACȚIUNE AL ENZIMELOR
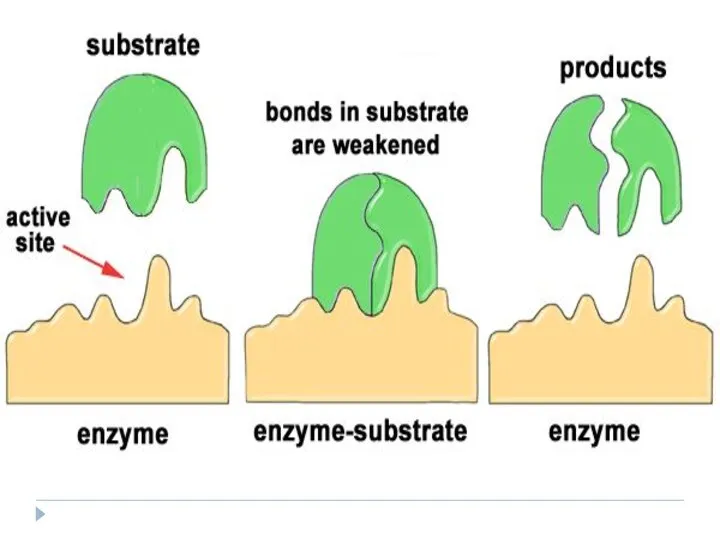
- 102. Mecanismul de acţiune al E Pentru decurgerea unei reacţii este necesar ca molecula de S şi
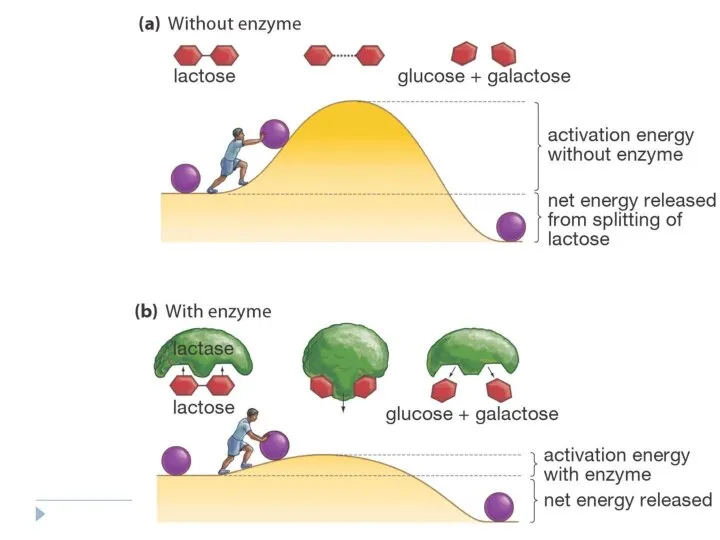
- 103. Mecanismul de acţiune al E E - micşorează energia de activare ale reacţiilor chimice. Cu cât
- 104. S + E ↔ E-S → E + P Enzimele reduc energia de activare fara sa
- 105. Enzymes Lower a Reaction’s Activation Energy
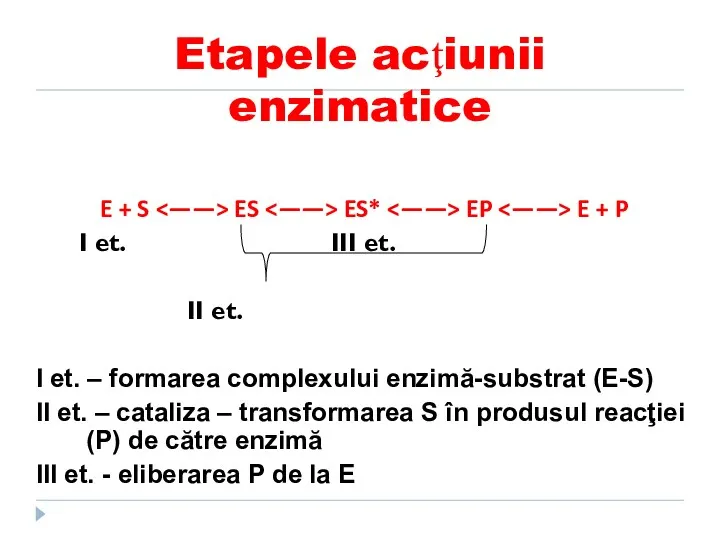
- 106. Etapele acţiunii enzimatice E + S ES ES* EP E + P I et. III et.
- 107. Mecanismul de acţiune al enzimelor Prima etapă: Difuzia S spre E şi legarea cu CA al
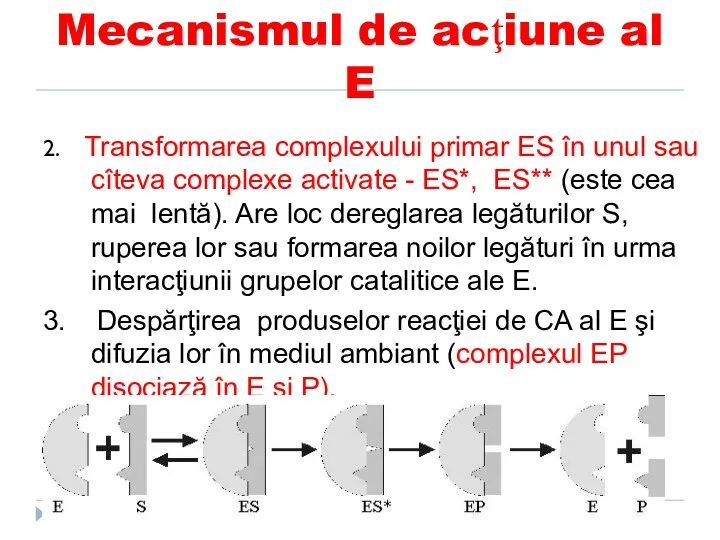
- 108. Mecanismul de acţiune al E 2. Transformarea complexului primar ES în unul sau cîteva complexe activate
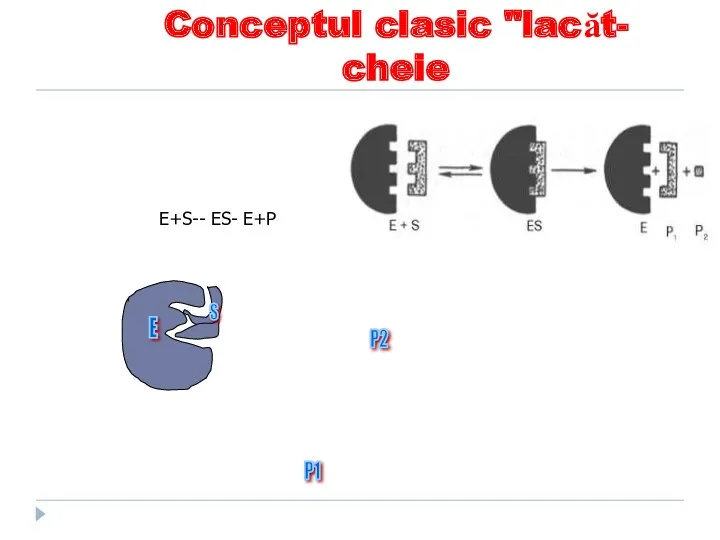
- 109. Ipoteza “lacăt-cheie” (Fischer) şi “coincidenţa forţată” (Koshland) Modelul clasic (Emil Fischer) consideră că potrivirea S cu
- 110. Teoria “cheie-lacăt” - Fisher
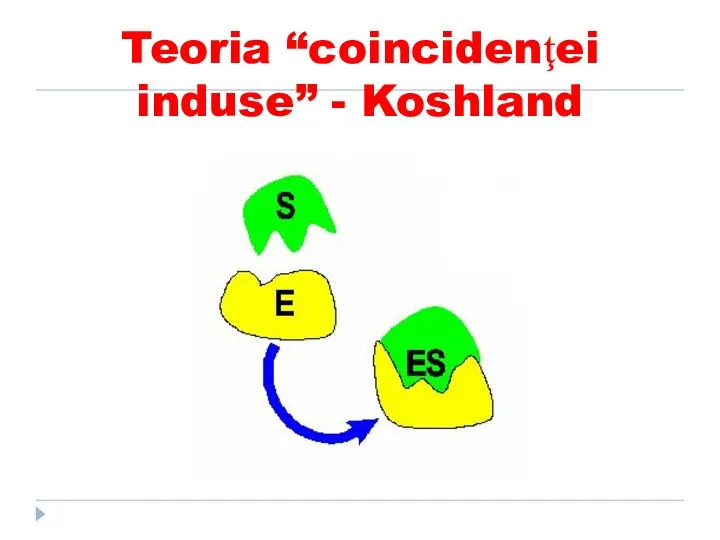
- 111. Teoria “coincidenţei induse” - Koshland
- 112. S P1 P2 Conceptul clasic "lacăt- cheie E+S-- ES- E+P
- 113. S P1 P2 Conceptul coencidenţei inductive “coincidenţa forţată” (Kochland)
- 114. Mecanismul de acţiune al E La nivel molecular acţiunea E poate fi lămurită prin următoarele efecte:
- 115. PROPRIETĂŢILE ENZIMELOR
- 116. Obiectivele: Cinetica enzimatică. Influenţa concentraţiei enzimei şi a substratului, a pH-ului şi a temperaturii asupra activităţii
- 117. CINETICA ENZIMATICĂ Studiază viteza reacției enzimatice, luând în considerație factorii fizico-chimici ce o influențează
- 118. VITEZA REACȚIEI ENZIMATICE reprezintă numărul moleculelor de substrat transformate în produs final pe unitatea de timp
- 119. Factorii care influenţiază viteza reacției enzimatice Concentraţia S Concentraţia E Temperatura pH
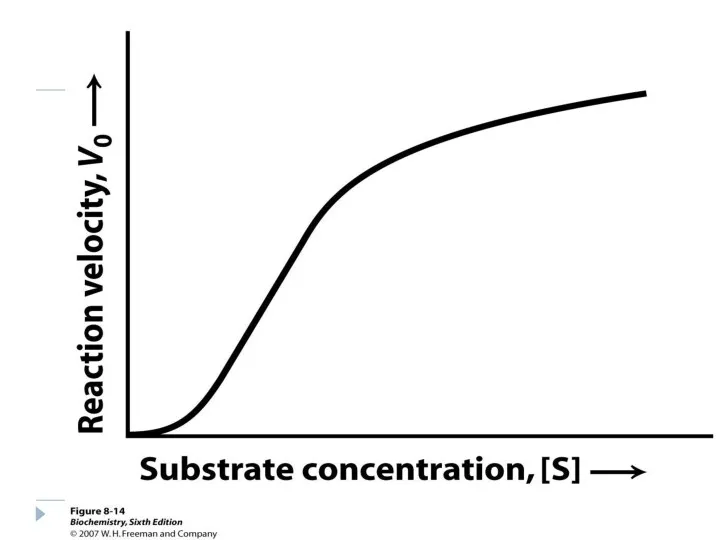
- 120. Influența [S] asupta vitezei reacției enzimatice Grafic se reprezintă sub formă de o curbă de tip
- 121. Influența [S] asupta vitezei reacției enzimatice Analiza curbei arată 3 zone: Zona “a”- v creste proportional
- 122. Această curbă este numită curba lui Michaelis-Menten şi se exprimă prin ecuaţia: [S] V0=Vmax x _________
- 124. Semnificația lui Km și V max Km-constanta lui Michaelis Menten - este acea concentraţie de S
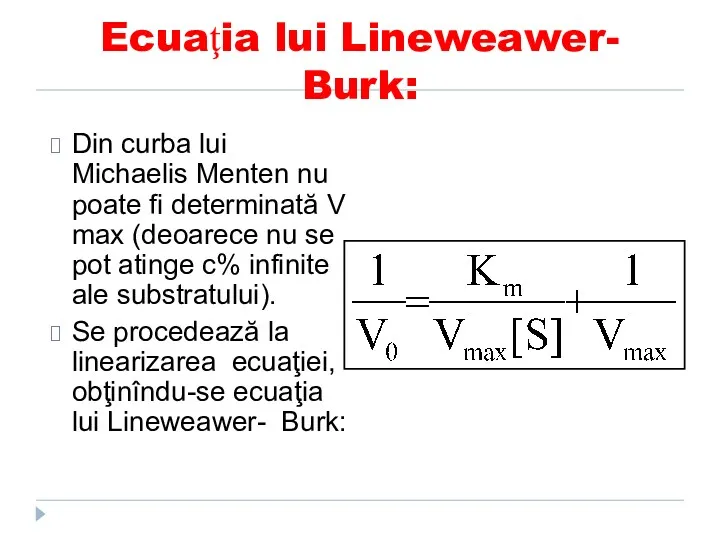
- 125. Ecuaţia lui Lineweawer- Burk: Din curba lui Michaelis Menten nu poate fi determinată V max (deoarece
- 126. Diagrama lui Lineweawer- Burk: Reciproca ecuatiei Michaelis-Menten
- 127. Influența [E] asupta vitezei reacției în condiţii standard 2 mol de E într-o anumită perioadă de
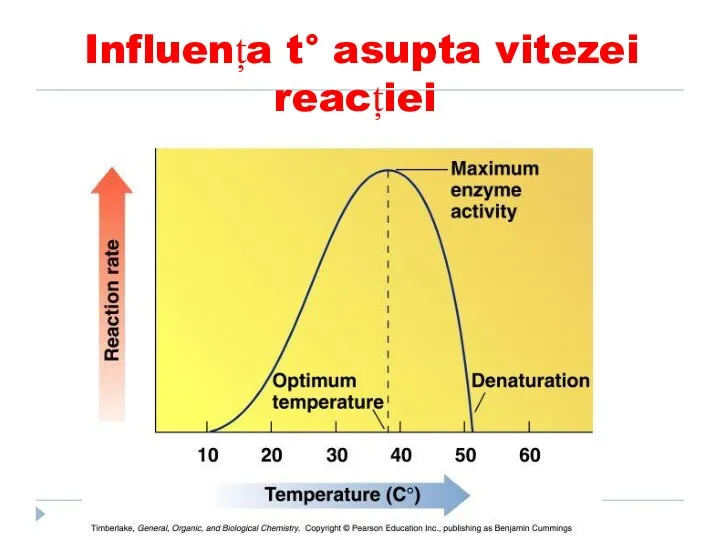
- 128. Influența t° asupta vitezei reacției
- 129. Termolabilitatea (t°) Unele E a microorganismelor termofile sunt active la t de 80°C La t joase
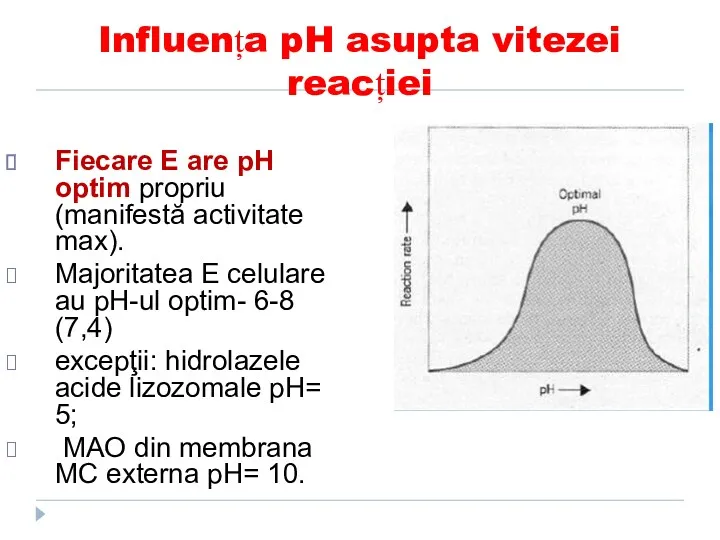
- 130. Influența pH asupta vitezei reacției Fiecare E are pH optim propriu (manifestă activitate max). Majoritatea E
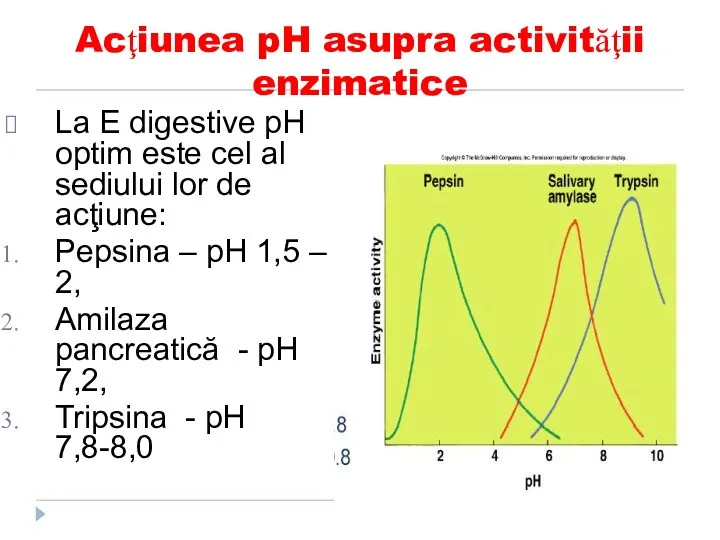
- 131. Acţiunea pH asupra activităţii enzimatice La E digestive pH optim este cel al sediului lor de
- 132. Acţiunea pH asupra activităţii enzimatice
- 133. Acţiunea pH asupra activităţii enzimatice pH optim e dependent de: gradul de ionizare a grupelor funcţionale,
- 134. Acţiunea pH asupra activităţii enzimatice Centrul activ al enzimelor contine grupe ionizabile, acide sau bazice, deci
- 135. Influenta efectorilor enzimatici Efectorii enzimatici sunt substante cu structuri chimice variate care aduse in mediul de
- 136. Inhibitorii enzimatici Inhibitorii enzimatici sunt compusi care influenteaza negativ activitatea enzimelor pe care o pot anula
- 137. Inhibiţia enzimatică Deosebim: inhibiţie nespecifică (T, pH, agenţii denaturării ) inhibiţie specifică Inhibiţia poate fi reversibilă
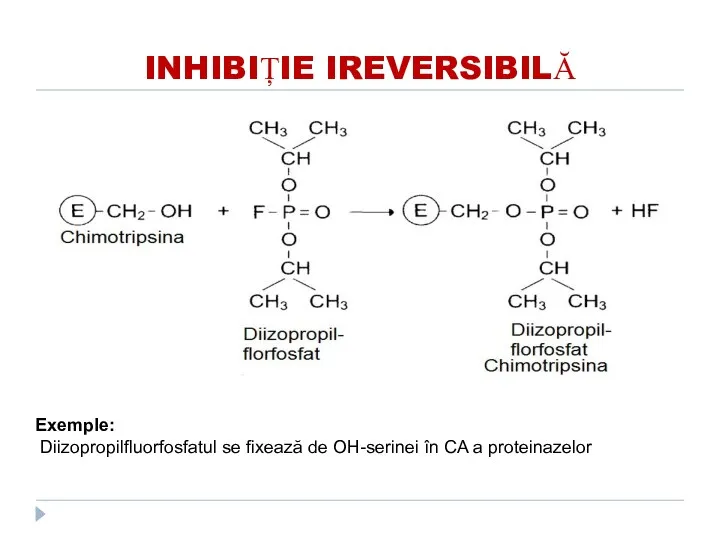
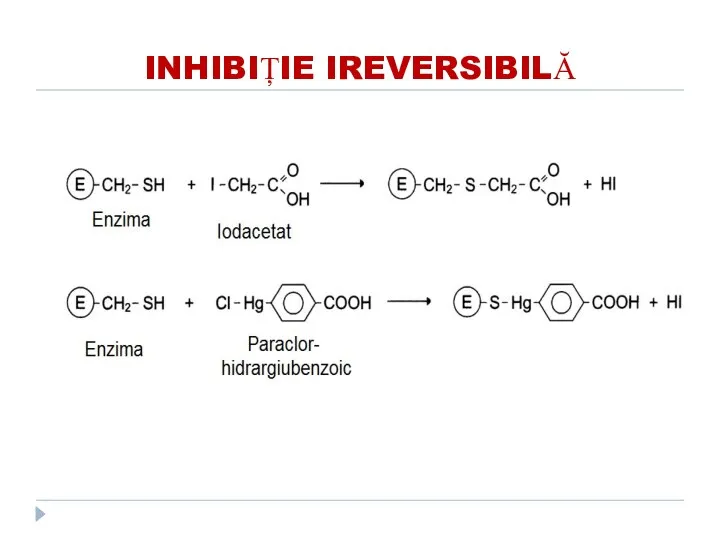
- 138. EXEMPLE DE INHIBITORI IREVERSIBILI Compușii organofosforici (Diizopropilfluorfosfatul) (toxina neuroparalitica) se fixează de OH-Ser în CA a
- 139. Inhibiţie ireversibilă
- 140. INHIBIȚIE IREVERSIBILĂ Exemple: Diizopropilfluorfosfatul se fixează de OH-serinei în CA a proteinazelor
- 141. INHIBIȚIE IREVERSIBILĂ
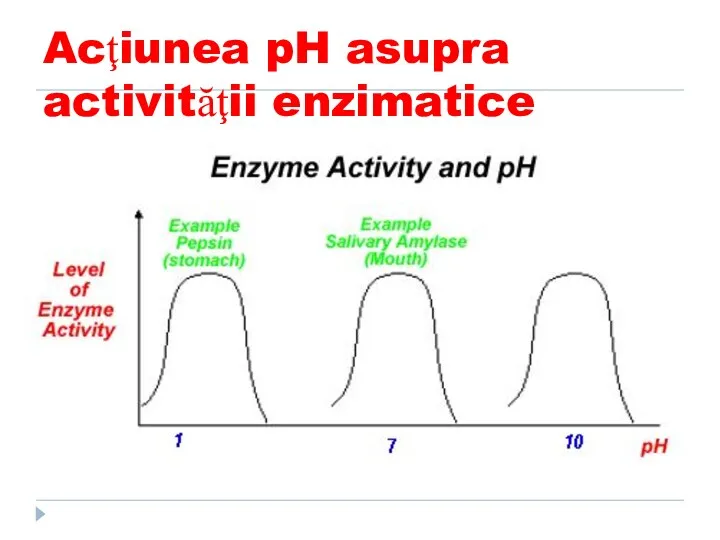
- 142. Tipuri de inhibitie revesibilă Deosebim: Inhibiţie competitivă Inhibiţie necompetitivă (noncompetitivă) Inhibiţie uncompetetivă Inhibiţie alosterică
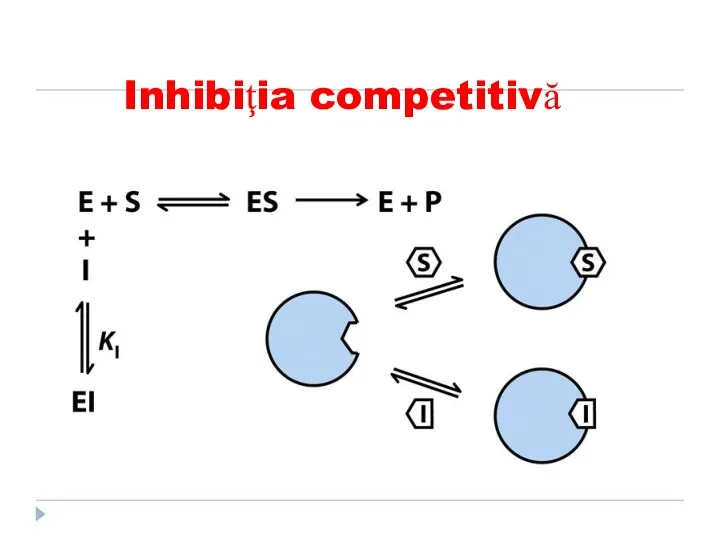
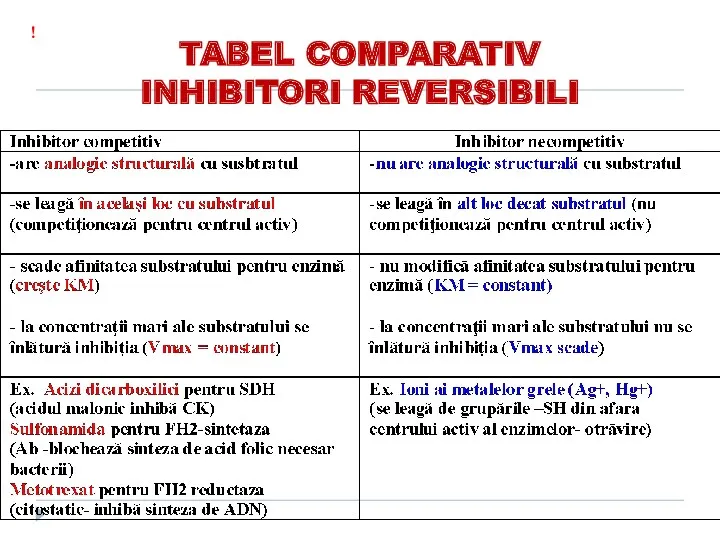
- 143. Inhibiţia competitivă I se aseamănă după structură cu S. Apare o competiţie dintre I şi S
- 144. Inhibiţia competitivă
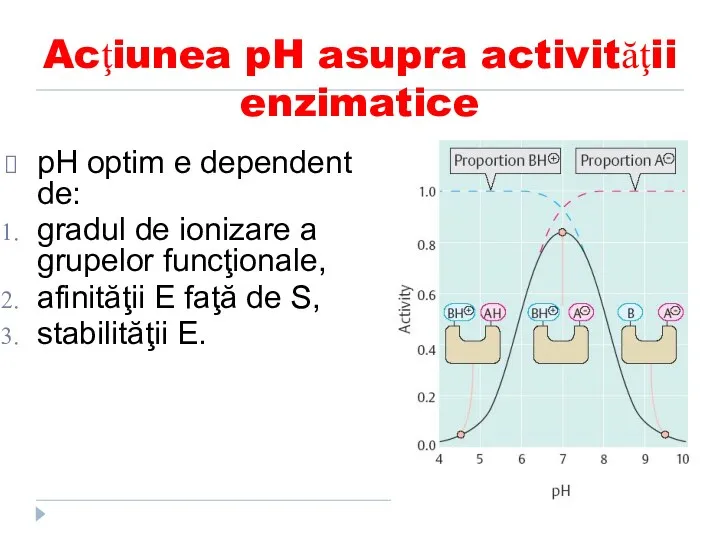
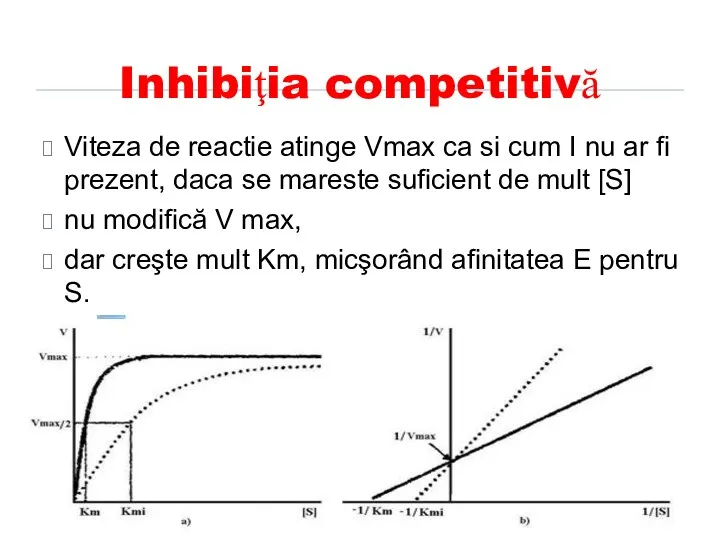
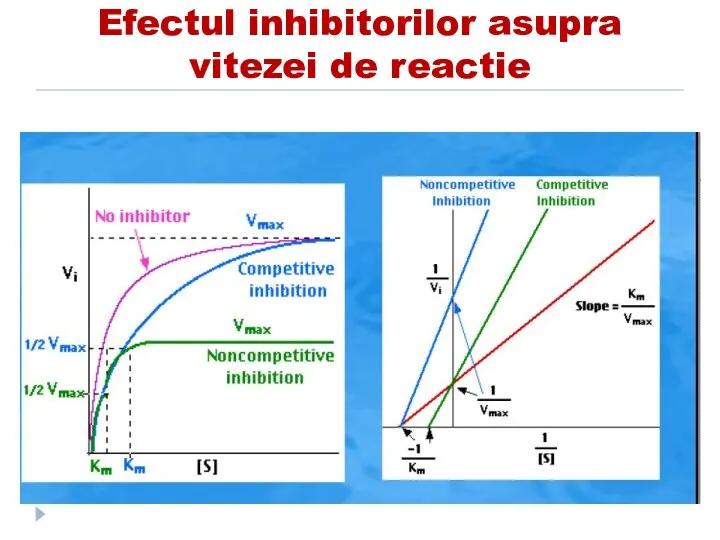
- 145. Inhibiţia competitivă Viteza de reactie atinge Vmax ca si cum I nu ar fi prezent, daca
- 146. Exemple de I competitivi: inhibiţia SDH cu malonat (SDH -oxideaza succinatul in fumarat). Malonatul inhibă aceasta
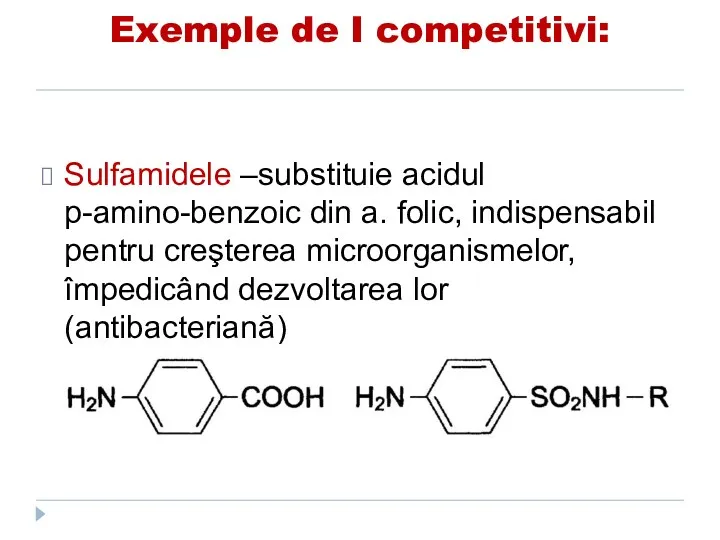
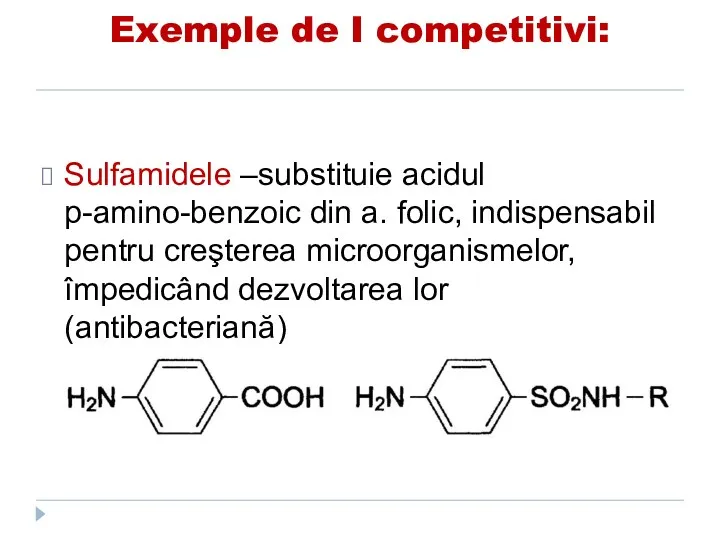
- 147. Exemple de I competitivi: Sulfamidele –substituie acidul p-amino-benzoic din a. folic, indispensabil pentru creşterea microorganismelor, împedicând
- 148. Exemple de I competitivi: Sulfamidele –substituie acidul p-amino-benzoic din a. folic, indispensabil pentru creşterea microorganismelor, împedicând
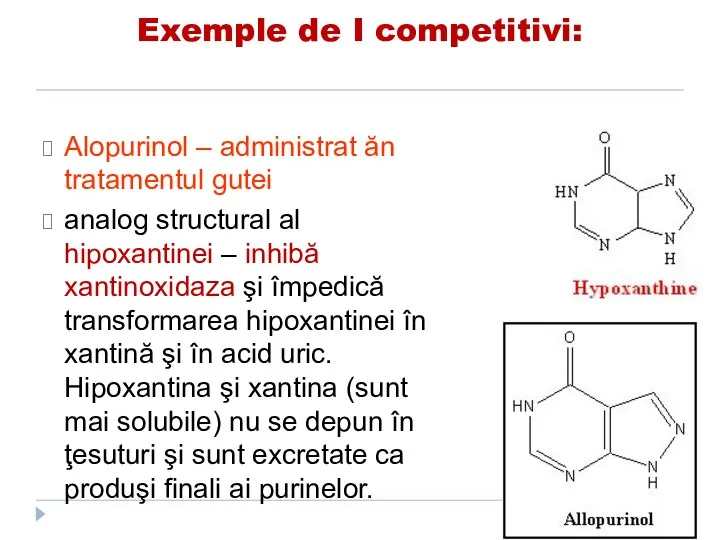
- 149. Exemple de I competitivi: Alopurinol – administrat ăn tratamentul gutei analog structural al hipoxantinei – inhibă
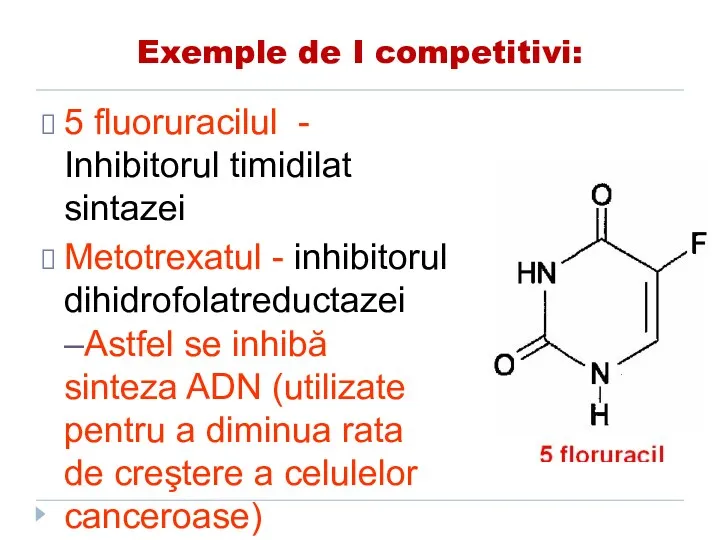
- 150. Exemple de I competitivi: 5 fluoruracilul - Inhibitorul timidilat sintazei Metotrexatul - inhibitorul dihidrofolatreductazei –Astfel se
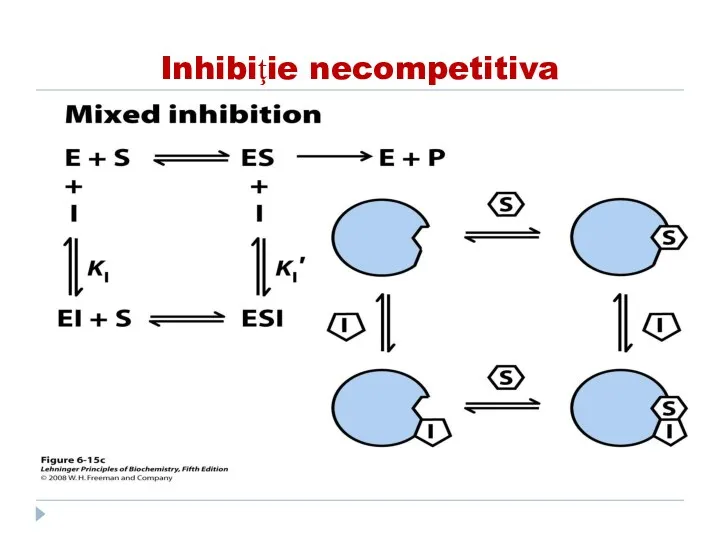
- 151. Inhibiţia necompetitivă Inhibitorul nu se aseamănă ca structură cu S I şi S se leagă simultan
- 152. Inhibiţie necompetitiva
- 153. Inhibiţie necompetitiva In cazul inhibitiei necompetitive, I chiar daca nu se leaga la centru activ al
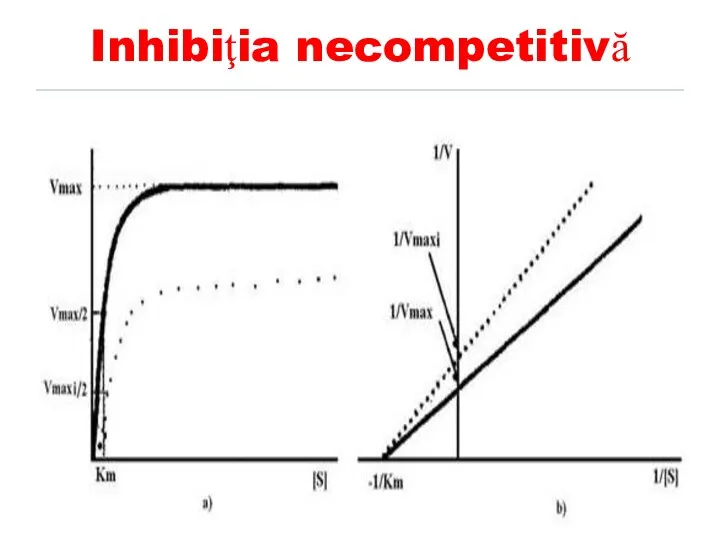
- 154. Inhibiţia necompetitivă
- 155. Tipuri de inhibitori necompetitivi: cianurile, CO se fixează cu Fe 3+ din citocromoxidază ---se întrerupe LR
- 156. Inhibiţia necompetitivă I poate fi înlăturat de substanţe care îl leagă – numite reactivatori
- 157. TABEL COMPARATIV INHIBITORI REVERSIBILI !
- 158. Efectul inhibitorilor asupra vitezei de reactie
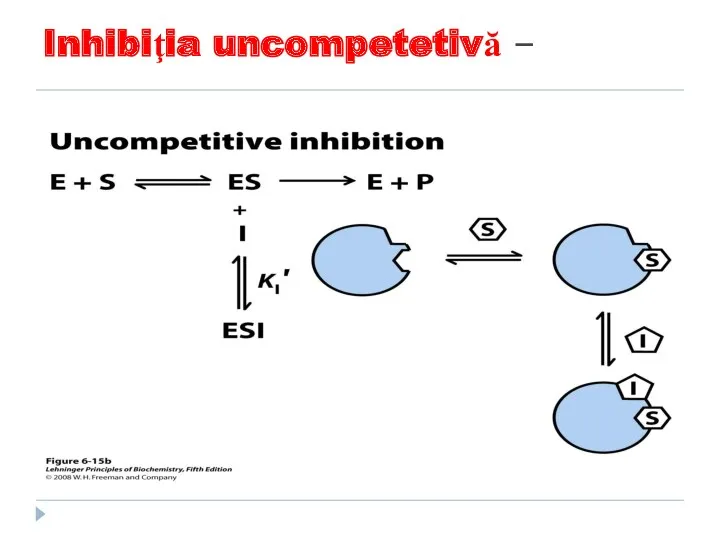
- 159. Inhibiţia uncompetetivă – E+S----ES +I-----ESI I se combina cu complexul ES formand un complex ESI ce
- 160. Inhibiţia uncompetetivă –
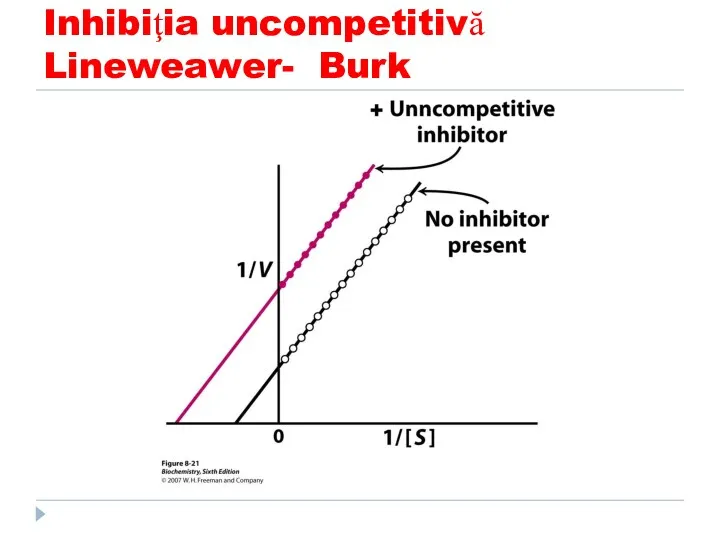
- 161. Inhibiţia uncompetitivă Lineweawer- Burk
- 162. Alte tipuri de inhibiție inhibiţia prin modificarea covalentă a moleculei E - prin fosforilare pe baza
- 163. REGLAREA ACTIVITATII ENZIMELOR
- 164. Mecanismele de activare a E Sunt : 1. nespecifice: temperatura , iradierea 2. specifice Se activează
- 165. I. REGLAREA CANTITATIVA Functie de dinamica SINTEZA/DEGRADARE Enzime inductibile Ks > Kd Enzime represibile Kd >
- 166. II. REGLAREA CALITATIVA Mecanismele de activare a E Deosebim următoarele tipuri de reglare a activităţii enzimatice:
- 167. II. REGLAREA CALITATIVA II.1.Reglarea alosterica (necovalenta)
- 168. Enzime alosterice. Efectori alosterici Sunt proteine oligomere alcatuite din mai multe subunitati identice sau diferite, in
- 169. Enzime alosterice. Efectori alosterici Pe langa centri activi, monomerii prezinta si centri alosterici de care se
- 170. II. REGLAREA CALITATIVA II.1.Reglarea alosterica de tip heterotrop
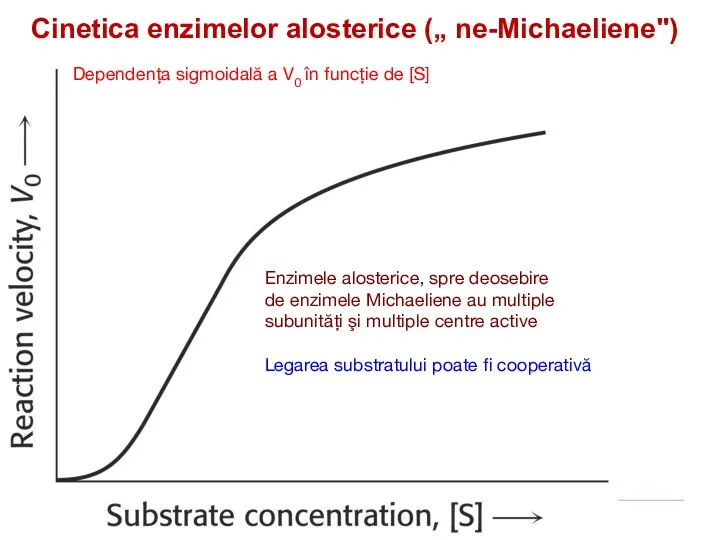
- 171. Cinetica enzimelor alosterice („ ne-Michaeliene") Dependenţa sigmoidală a V0 în funcţie de [S] Enzimele alosterice, spre
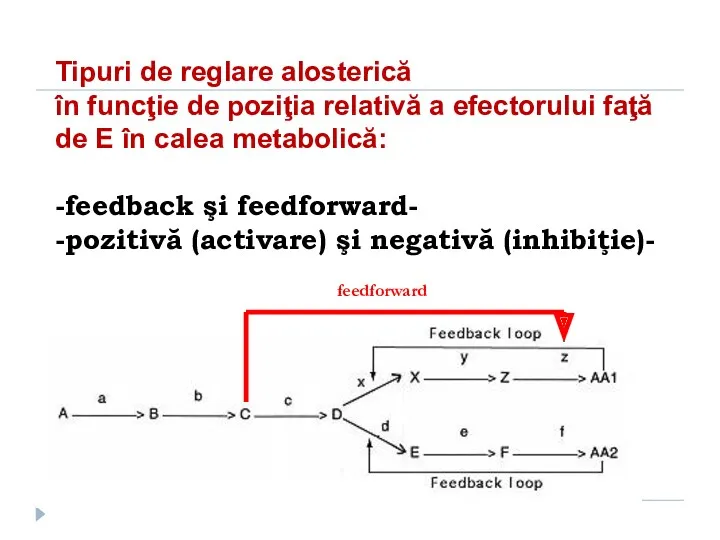
- 172. Tipuri de reglare alosterică în funcţie de poziţia relativă a efectorului faţă de E în calea
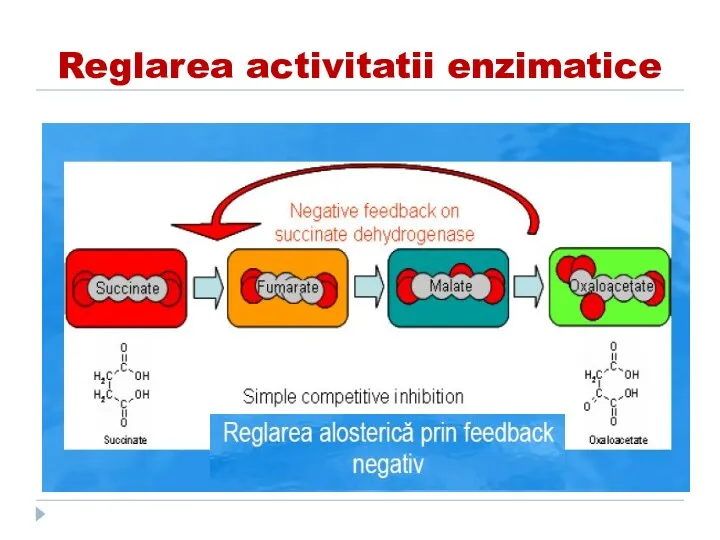
- 173. Reglarea activitatii enzimatice
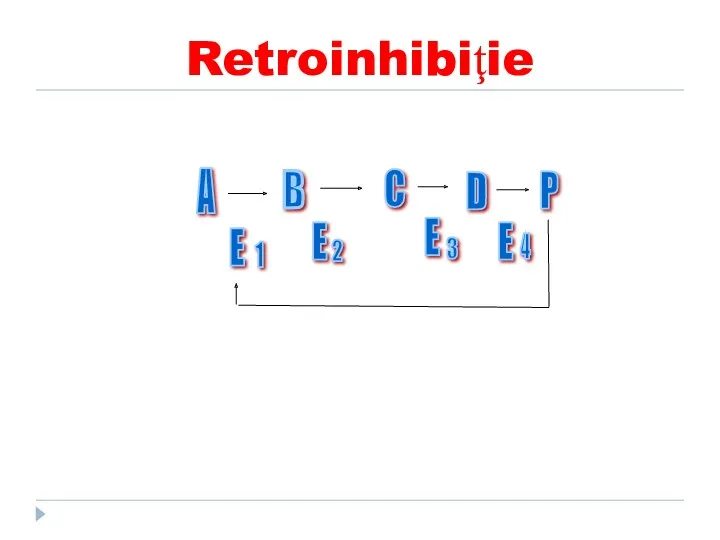
- 174. Retroinhibiţie A B C D P E E 1 E 2 3 E 4
- 175. Reglarea activitatii enzimatice
- 176. Reglarea covalentă - Proteoliză limitată Unele enzime (proteine) se sintetizează în forma neactivă de precursor –
- 177. Proteoliză limitată -este scindarea unui sector al catenei în rezultatul căreia E se restructurează şi se
- 178. Importanța biologică a prezenţei formelor neactive Zimogenii sunt produse la locurile de sinteză (mucoasa gastrică pentru
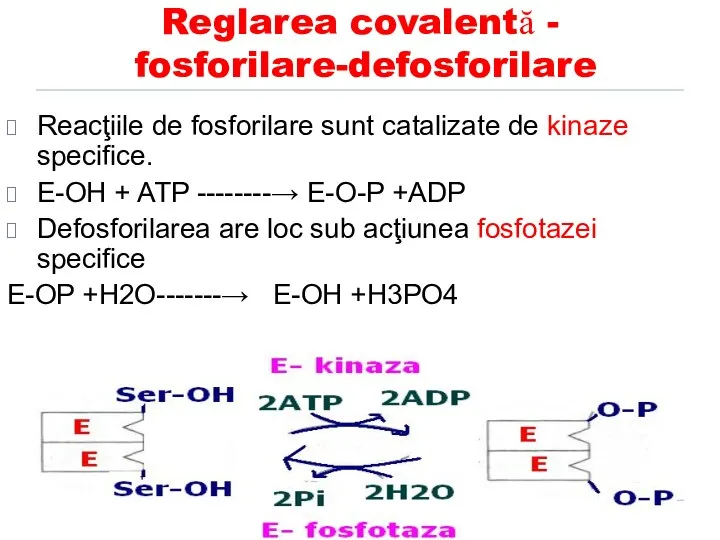
- 179. Reglarea covalentă - fosforilare-defosforilare unele E sunt active în forma fosforilată, iar altele în forma defosforilată.
- 180. Reglarea covalentă - fosforilare-defosforilare Reacţiile de fosforilare sunt catalizate de kinaze specifice. E-OH + ATP --------→
- 181. Autostructurarea cuaternară Este caracteristică E ce posedă structură cuaternară Fiecare protomer în parte nu e activ
- 182. E CA Allos S M CA Reglarea alosterică Modulator pozitiv
- 183. Izoenzimele- izoE forme moleculare multiple ale E, ce catalizează aceeaşi reacţie chimică, dar diferă prin structură,
- 184. IzoE diferă între ele prin: sarcina electrică (ce permite separarea lor prin electroforeză); V max de
- 185. STRUCTURA IZOE Sunt E oligomere, cu structură cuaternară, alcătuite din cel puţin 2 protomeri diferiţi Ex.
- 187. Izoformele lactat dehidrogenazei (LDH) LDH-1 (4H) - in inima LDH-2 (3H1M) - in sistemul reticuloendotelial LDH-3
- 188. ROLUL izoenzimelor în controlul metabolic ( faciliteaza adaptarea metabolismului in diferite ţesuturi.) Ex: in miocard predomina
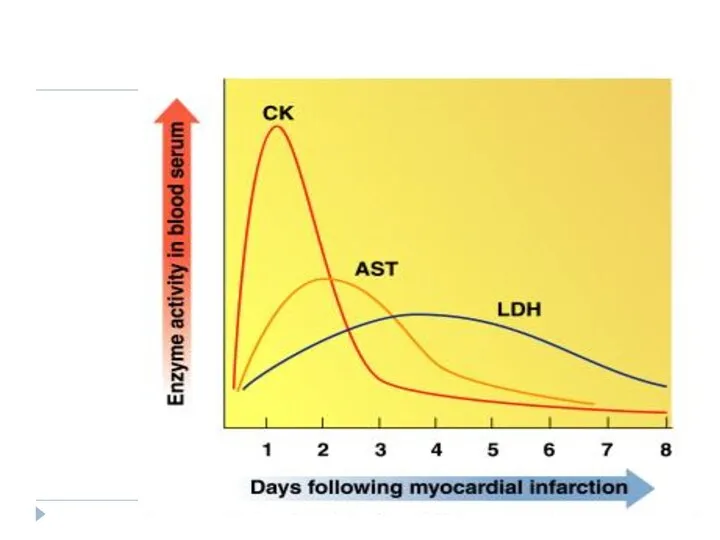
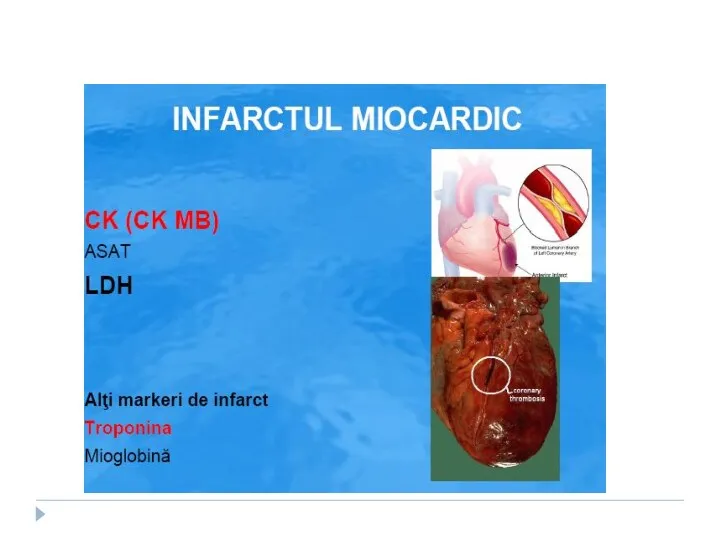
- 189. LDH Norma- 100-190U/L Creşterea de LDH 1 şi LDH2: infarctul miocardic anemia hemolitică/ megaloblastică LDH5 crescut
- 190. Exemple de izoenzime: Creatinfosfokinaza -2 tipuri de monomeri: M-Muscle şi B –brain LDH MDH Aldolaza Fosfataza
- 191. Creatinfosfokinaza (CPK)
- 194. Sistemele polienzimatice Fiecare celulă a organismului conţine setul său specific de E. Unele se găsesc în
- 195. Tipurile de organizare a sistemelor polienzimatice Se cunosc urmatoarele tipuri de organizare a sistemelor polienzimatice: -
- 196. Organizarea funcţională enzimele sunt asociate în sistemul polienzimatic cu ajutorul metaboliţilor, care difuzează de la o
- 197. Organizarea structural-funcţională E sunt fixate prin legături slabe pe o proteină “centrală”, care poate fi chiar
- 198. Organizarea structural-funcţională Ex.- complexul polienzimatic piruvatdehidrogenazic, constituit din 3 E şi 5 Co sintetaza acizilor graşi
- 199. Tipul mixt de organizare reprezintă o îmbinare a ambelor tipuri de organizare, adică o parte din
- 200. Unităţile de măsurare a activităţii E 1 UI – cantitatea de E care catalizează transformarea unui
- 201. 1 cat = 6 · 107 UI 1 UI = 16.67 · 10-9 cat
- 202. Unităţile de măsurare a activităţii E Activitatea specifică – reprezintă numărul de unităţi enzimatice per mg
- 203. Metodele de separare şi purificare ale E Dializă Salifiere Cromatografie Gel-filtrare Electroforeză Cea mai eficientă –
- 204. Metodele de determinare a activităţii E Viteza reacţiei este proporţională cu Viteza consumului substratului Viteza formării
- 205. Deosebirea privind componenţa enzimatică a organelor şi ţesuturilor. Enzimele organospecifice. Enzimele indicatorii – sunt localizate intracelular:
- 208. Utilizarea E în practica medicală Preparatele farmaceutice contemporane sunt asociate şi conţin ca regulă următoarele enzime:
- 209. Utilizarea E în practica medicală Efectele exercitate de preparatele enzimatice De substituţie (E digestive) Fibrinolitică şi
- 210. Terapia cu enzime Enzimele sunt agenţi terapeutici unici ce produc efecte importante şi specifice. Motivele care
- 211. Tehnici propuse pentru optimizarea proprietăţilor terapeutice ale enzimelor. - prin N-acilare a fost crescută semiviata asparaginazei,
- 213. Скачать презентацию


































































![Influența [S] asupta vitezei reacției enzimatice Grafic se reprezintă sub](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378235/slide-119.jpg)
![Influența [S] asupta vitezei reacției enzimatice Analiza curbei arată 3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378235/slide-120.jpg)




![Influența [E] asupta vitezei reacției în condiţii standard 2 mol](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378235/slide-126.jpg)


























































 Отряд Парнокопытные
Отряд Парнокопытные Синапсы
Синапсы Строение, свойства, биологическая роль нуклеотидов и нуклеиновых кислот. Катаболизм нуклеиновых кислот
Строение, свойства, биологическая роль нуклеотидов и нуклеиновых кислот. Катаболизм нуклеиновых кислот Endangered species
Endangered species Задания ЕГЭ по теме Антропогенез
Задания ЕГЭ по теме Антропогенез Regnul plante
Regnul plante Airfow and Ventilation
Airfow and Ventilation Семейство растений луковые
Семейство растений луковые Сообщество. Экосистема. Биогеоценоз
Сообщество. Экосистема. Биогеоценоз Жизнь в аквариуме
Жизнь в аквариуме Презентация Бактерии 5 класс
Презентация Бактерии 5 класс Кроссворд по биологии по теме: Антропогенез
Кроссворд по биологии по теме: Антропогенез Основные экологические группы растений
Основные экологические группы растений Животные Африки. (ДОУ)
Животные Африки. (ДОУ) Выращивание картофеля на даче
Выращивание картофеля на даче Клетка
Клетка Класс Пресмыкающиеся
Класс Пресмыкающиеся Жабы и лягушки. 2 класс
Жабы и лягушки. 2 класс Полимеразная цепная реакция
Полимеразная цепная реакция Мезозойская эра
Мезозойская эра Класс Насекомые. Внешнее строение майского жука
Класс Насекомые. Внешнее строение майского жука Методы исследования генетики человека
Методы исследования генетики человека Молекулярные основы наследственности
Молекулярные основы наследственности Тип Кишечнополостные. Гидра. на основе современных информационных технологий.
Тип Кишечнополостные. Гидра. на основе современных информационных технологий. Террариум и его обитатели
Террариум и его обитатели Млекопитающие белки. Виды белок
Млекопитающие белки. Виды белок Травлення у Кишечнику. Функції печінки
Травлення у Кишечнику. Функції печінки Мхи и лишайники
Мхи и лишайники