Содержание
- 2. Классификация белков по составу Простые белки (неконъюгированные). Состоят только из аминокислот. α,β-керотин, фиброин, коллаген, эластин Сложные
- 3. Классификация по простетическим группам гемапротеины (простетическая группа − гем). Гемоглобин, цитохром.; металлопротеины (простетическая группа − металл(Mg,
- 4. Классификация по пространственной структуре Фибриллярные. Для них характерна линейная структура. Плохо растворимы в воде, обычно в
- 5. Классификация по выполняемым функциям Ферменты Транспортная через мембрану(пермиаза, K/Na-АТФаза, ферритин); транспорт внутри целого организма(гемоглобин, альбумины); Защитная
- 6. Уровни организации белковой молекулы Первичная структура последовательность аминокислотных остатков в молекуле белка или пептида. NH2-Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH Первичная
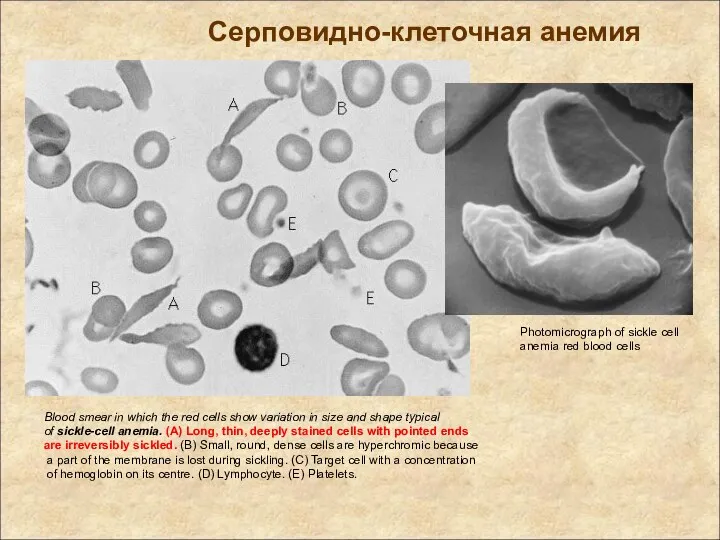
- 7. Blood smear in which the red cells show variation in size and shape typical of sickle-cell
- 8. Количество возможных первичных структур ОГРОМНО! 20 аминокислот могут дать примерно 100000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 белков, состоящих из 150 остатков
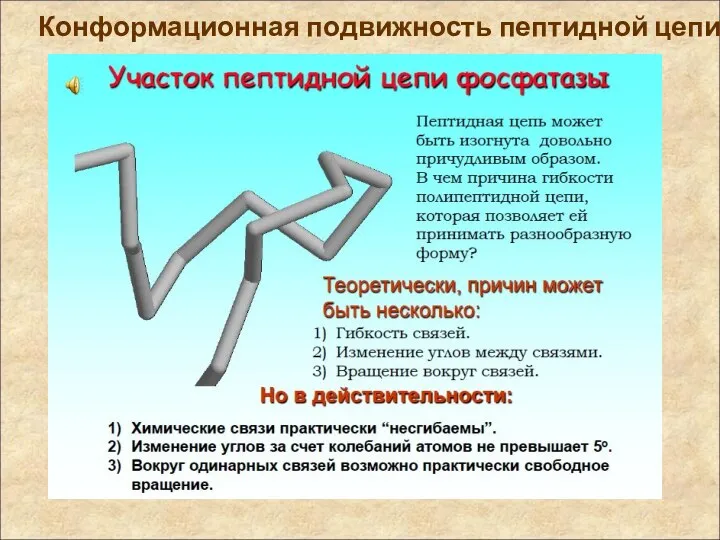
- 9. Конформационная подвижность пептидной цепи
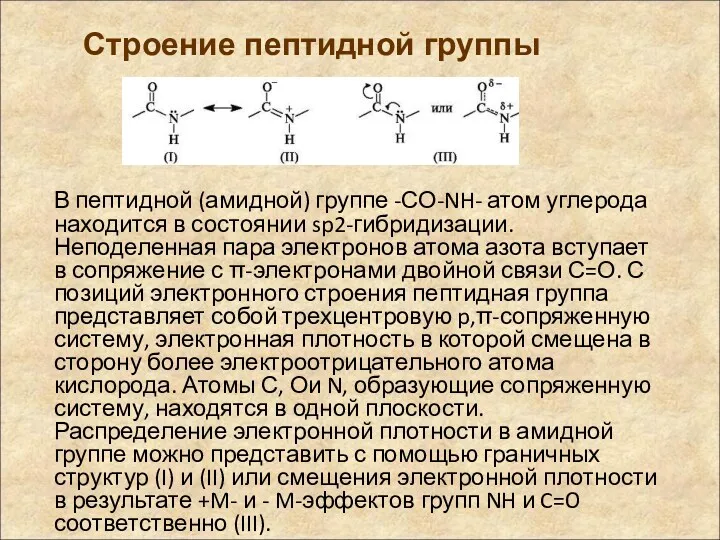
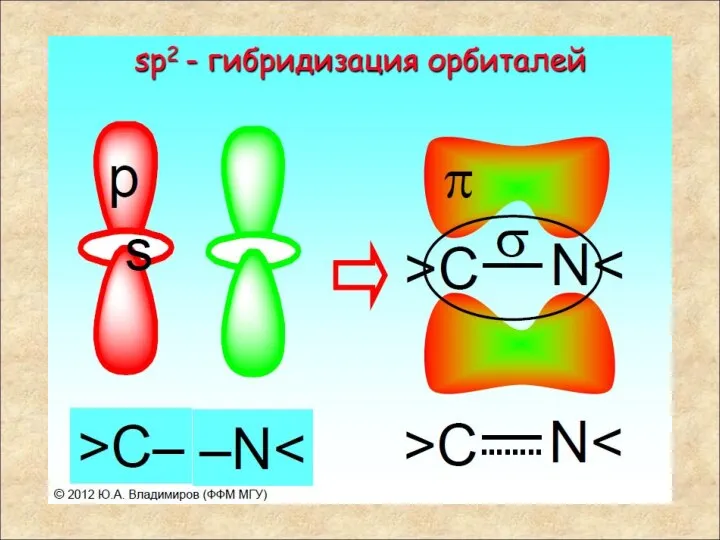
- 10. В пептидной (амидной) группе -СО-NH- атом углерода находится в состоянии sp2-гибридизации. Неподеленная пара электронов атома азота
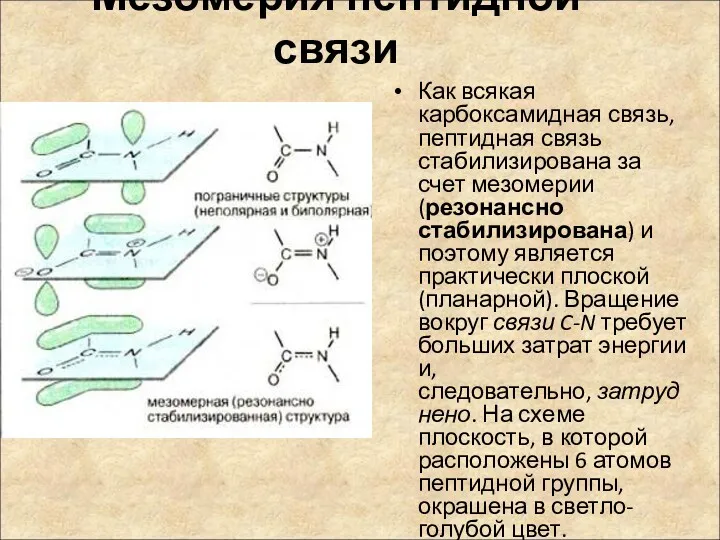
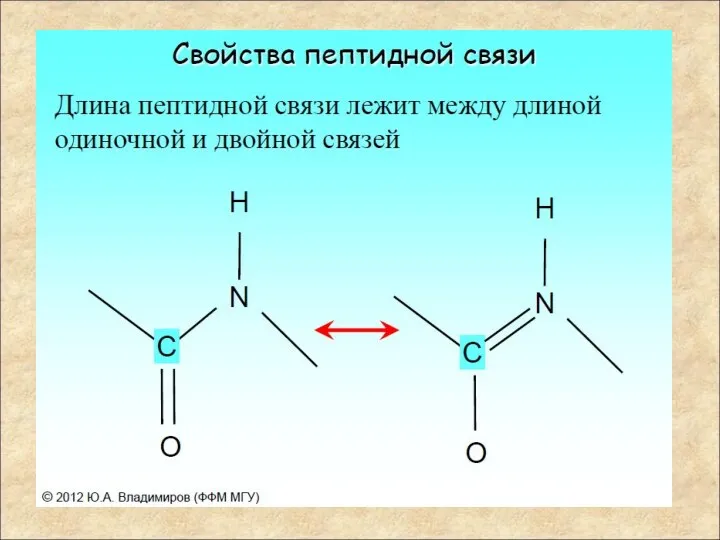
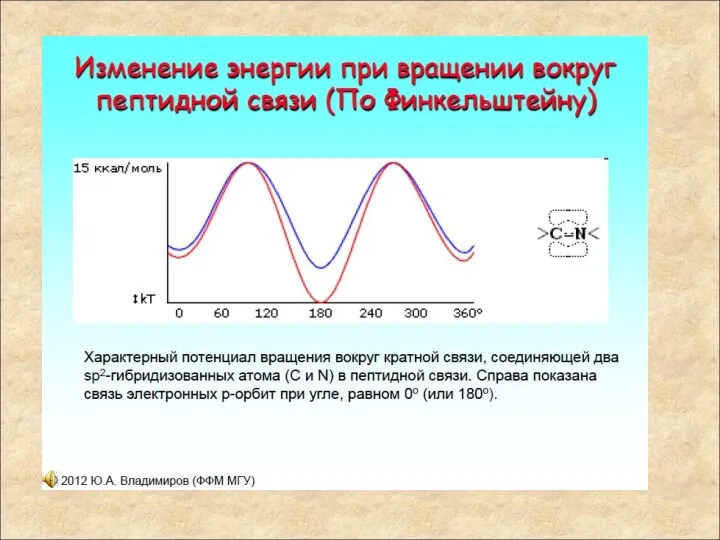
- 11. Мезомерия пептидной связи Как всякая карбоксамидная связь, пептидная связь стабилизирована за счет мезомерии (резонансно стабилизирована) и
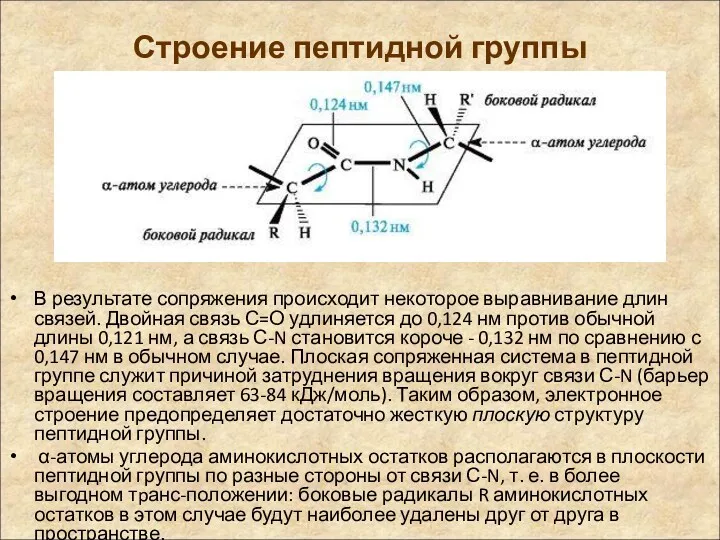
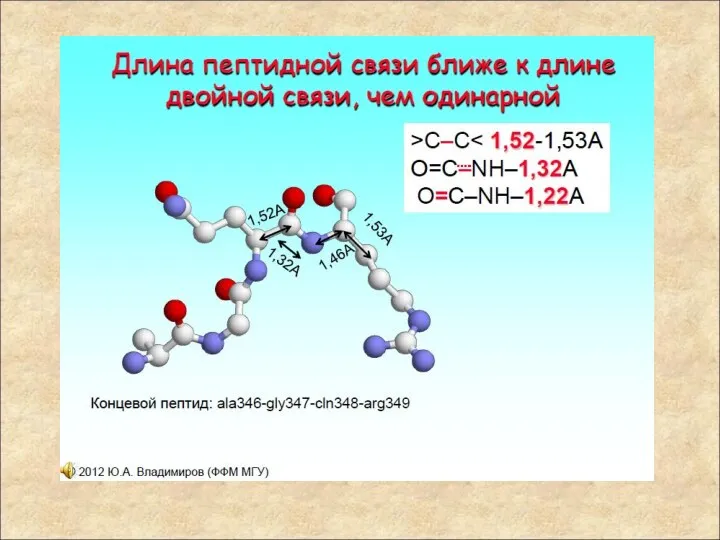
- 12. Строение пептидной группы В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до
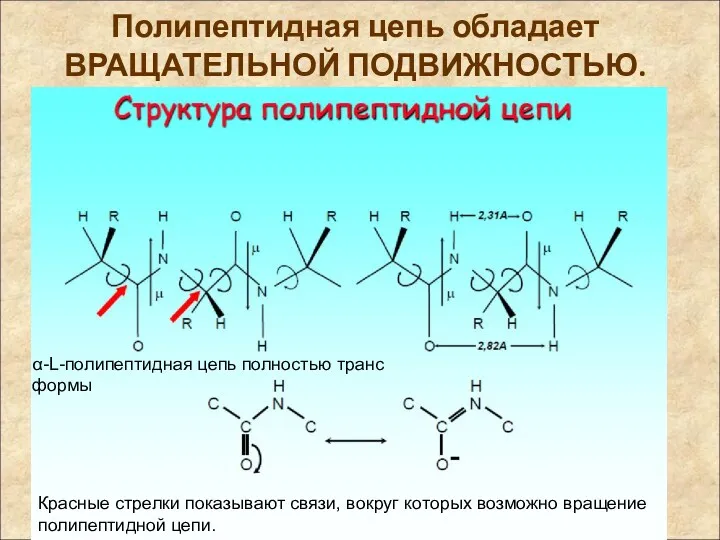
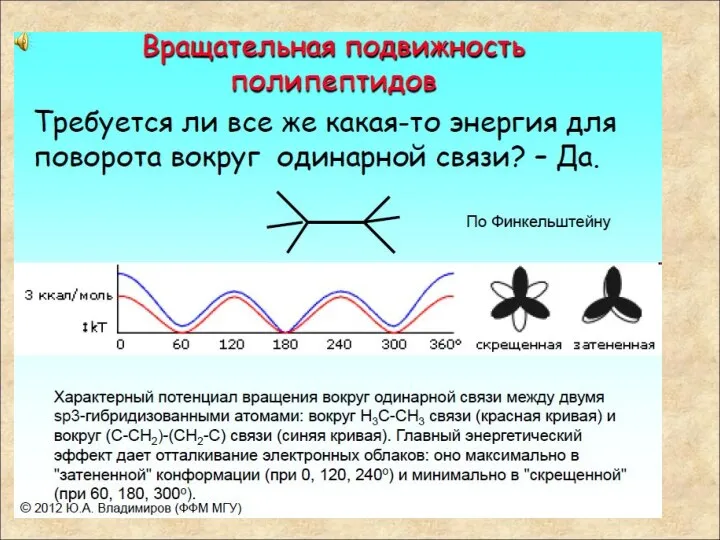
- 13. Полипептидная цепь обладает ВРАЩАТЕЛЬНОЙ ПОДВИЖНОСТЬЮ.
- 14. Полипептидная цепь обладает ВРАЩАТЕЛЬНОЙ ПОДВИЖНОСТЬЮ. Красные стрелки показывают связи, вокруг которых возможно вращение полипептидной цепи. α-L-полипептидная
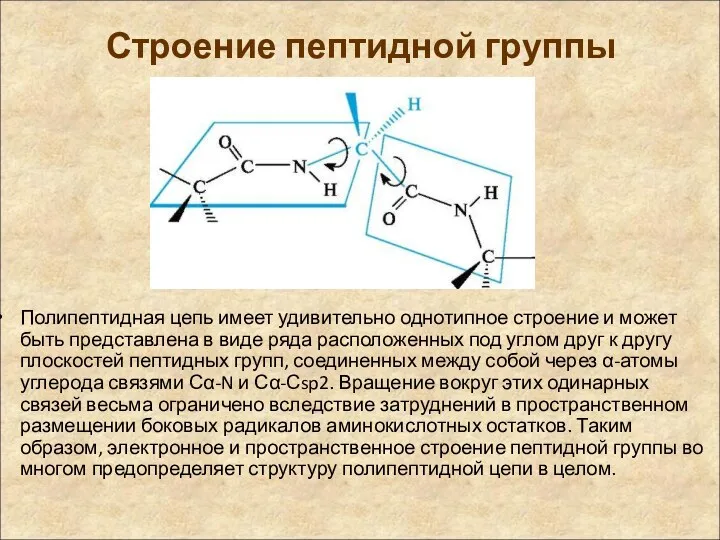
- 15. Строение пептидной группы Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда
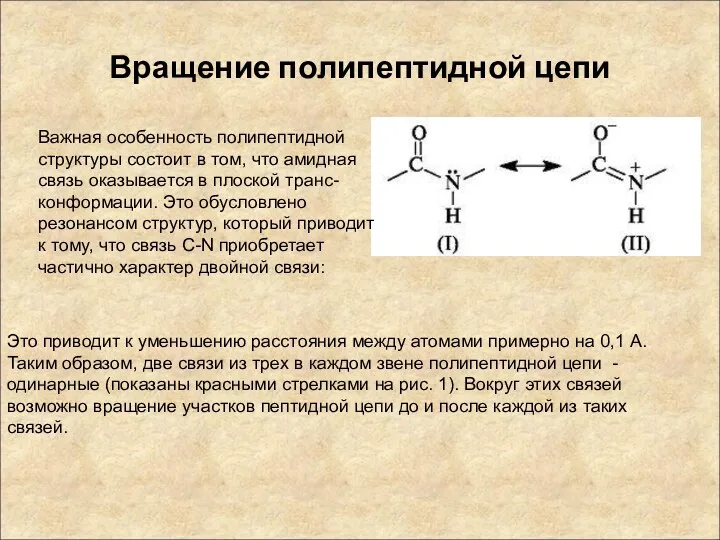
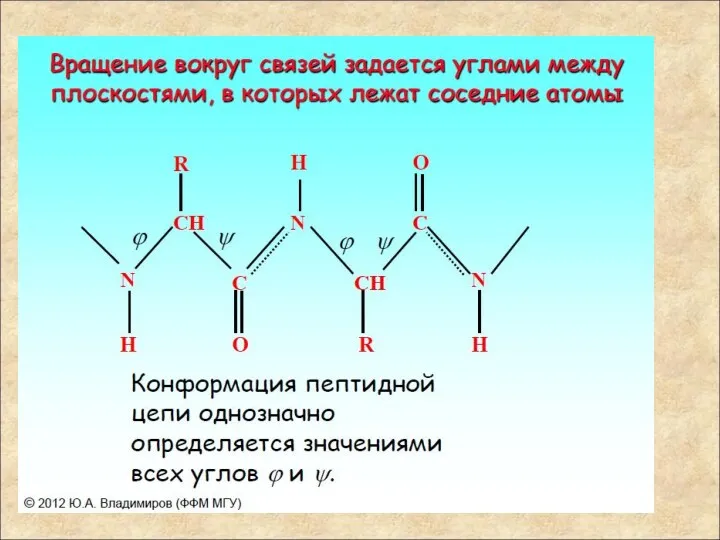
- 16. Вращение полипептидной цепи Важная особенность полипептидной структуры состоит в том, что амидная связь оказывается в плоской
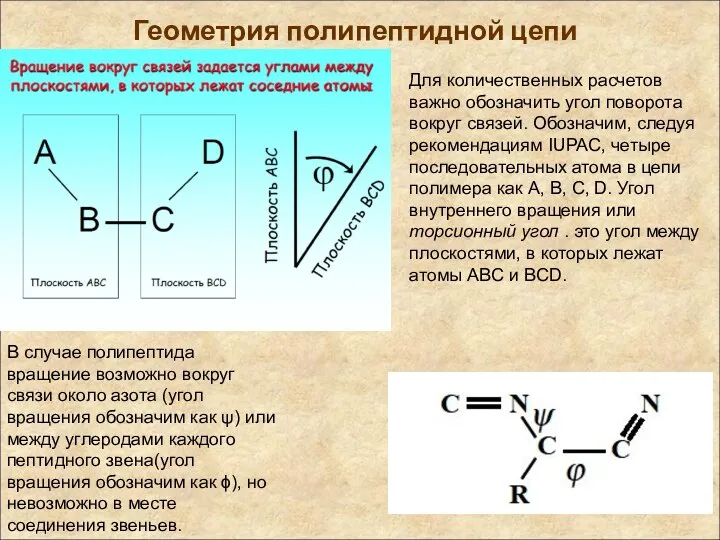
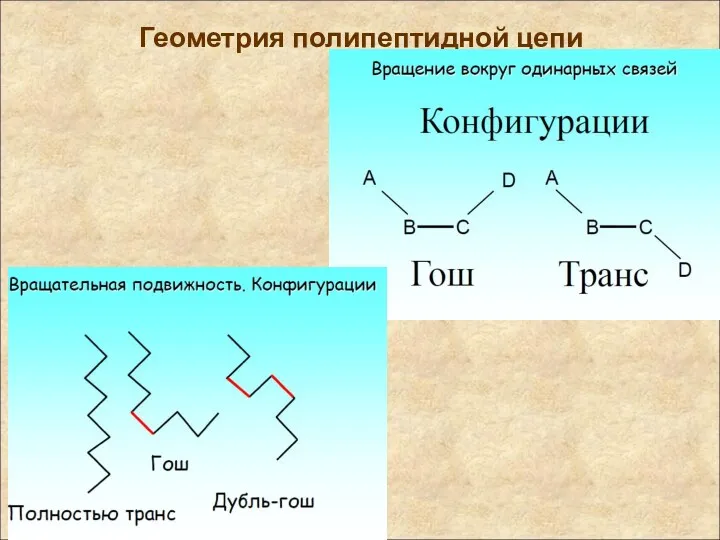
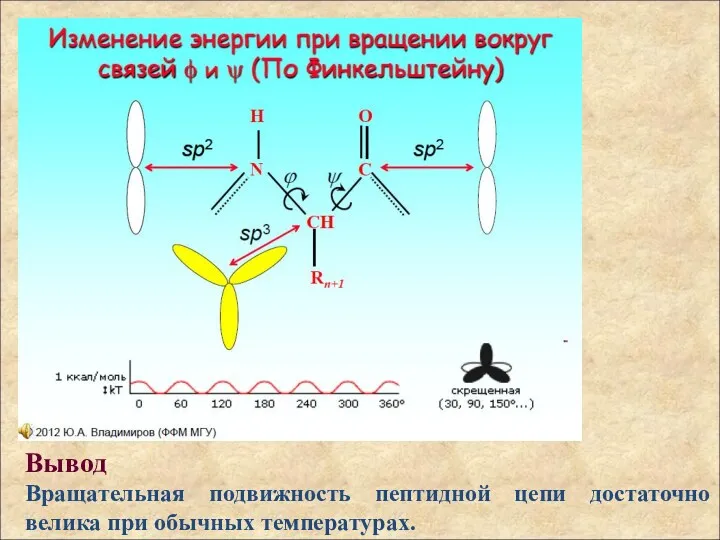
- 17. Геометрия полипептидной цепи Для количественных расчетов важно обозначить угол поворота вокруг связей. Обозначим, следуя рекомендациям IUPAC,
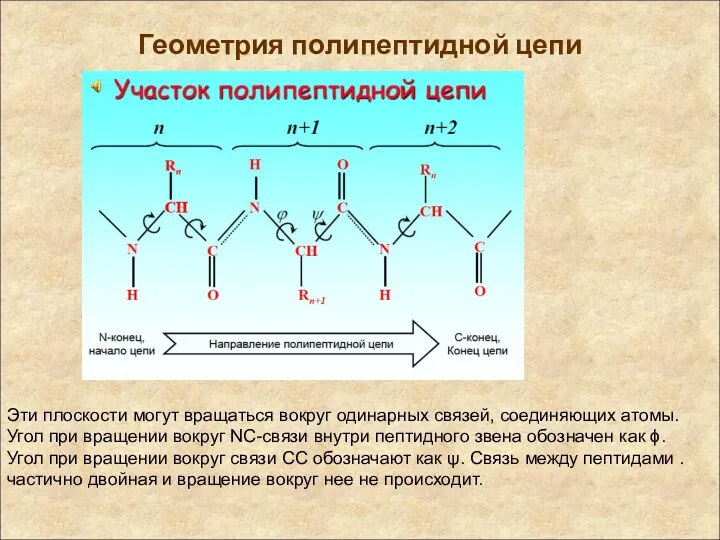
- 18. Геометрия полипептидной цепи Эти плоскости могут вращаться вокруг одинарных связей, соединяющих атомы. Угол при вращении вокруг
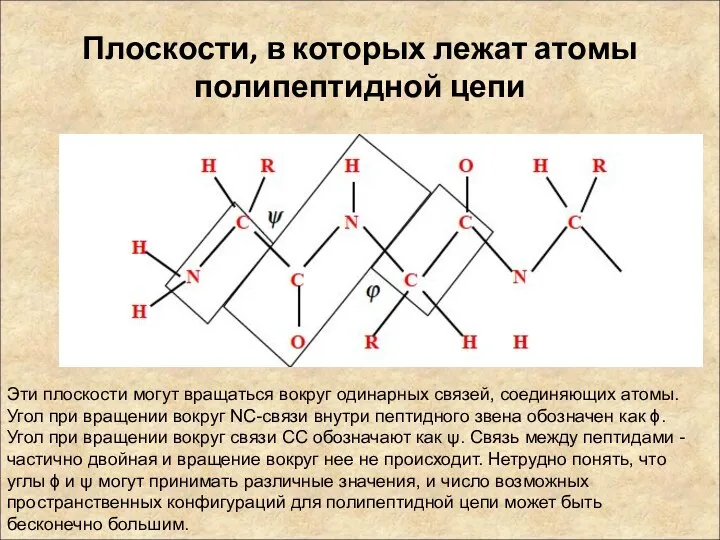
- 19. Плоскости, в которых лежат атомы полипептидной цепи Эти плоскости могут вращаться вокруг одинарных связей, соединяющих атомы.
- 20. Геометрия полипептидной цепи Однако в реальных условиях ряд конфигураций не реализуется из-за пространственных затруднений (когда атомы
- 23. Геометрия полипептидной цепи
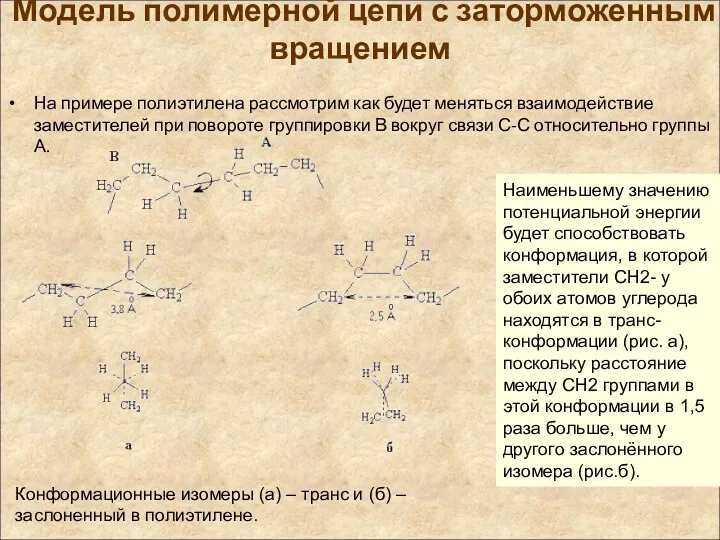
- 27. Модель полимерной цепи с заторможенным вращением На примере полиэтилена рассмотрим как будет меняться взаимодействие заместителей при
- 30. Вывод Вращательная подвижность пептидной цепи достаточно велика при обычных температурах.
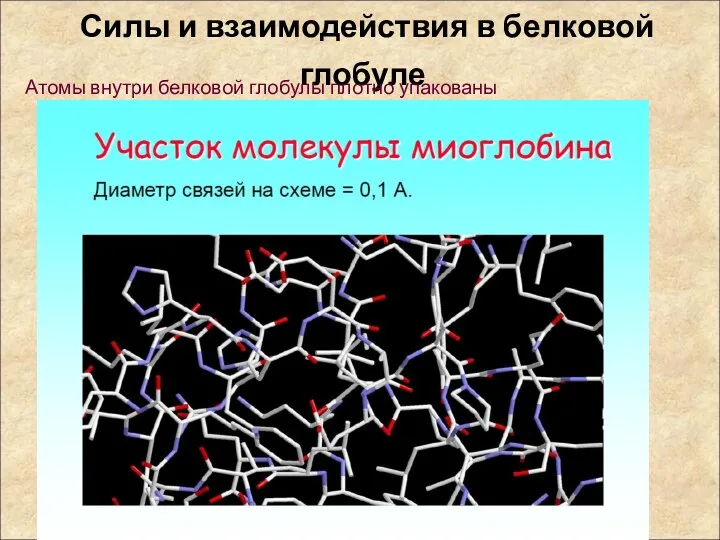
- 31. Силы и взаимодействия в белковой глобуле Атомы внутри белковой глобулы плотно упакованы
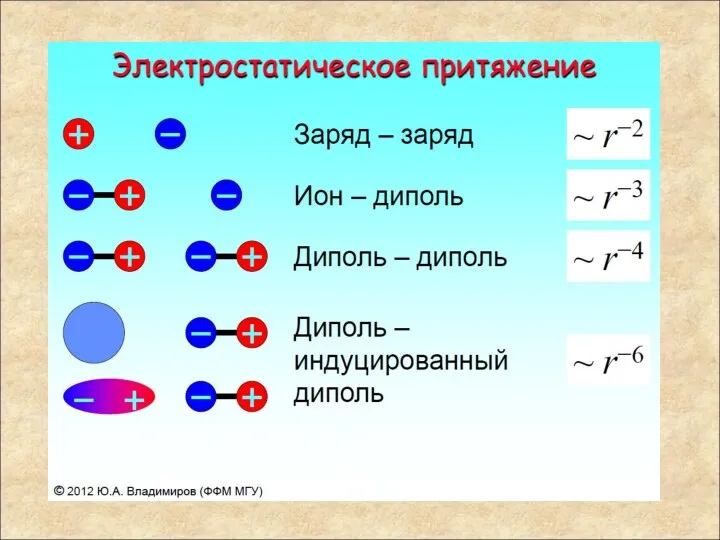
- 33. Ближнее и дальнее взаимодействие в макромолекулах Дисперсионные силы — силы электростатического притяжения мгновенного и индуцированного (наведённого)
- 37. Расчеты потенциальной энергии В пределах стерически дозволенных углов ϕ.и ψ наиболее вероятна такая конфигурайия пептидной цепи,
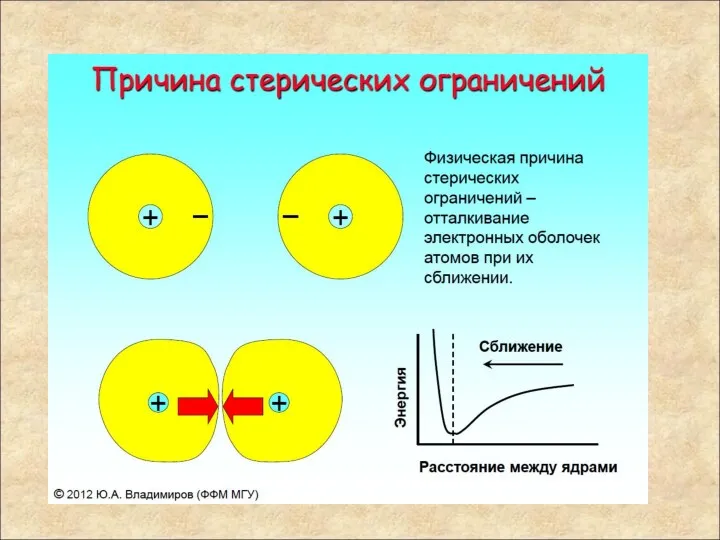
- 38. Нековалентные взаимодействия При сближении двух атомов их элетронные оболочки начинают взаимодействовать. Вначале это притяжение, связанное с
- 39. Где m составляет для разных пар атомов величину от 9 до 12. Характер зависимости энергии системы
- 40. Энергия системы минимальна при определенном расстоянии r0 между центрами ближайших атомов водорода, принадлежащих разным молекулам. Оно
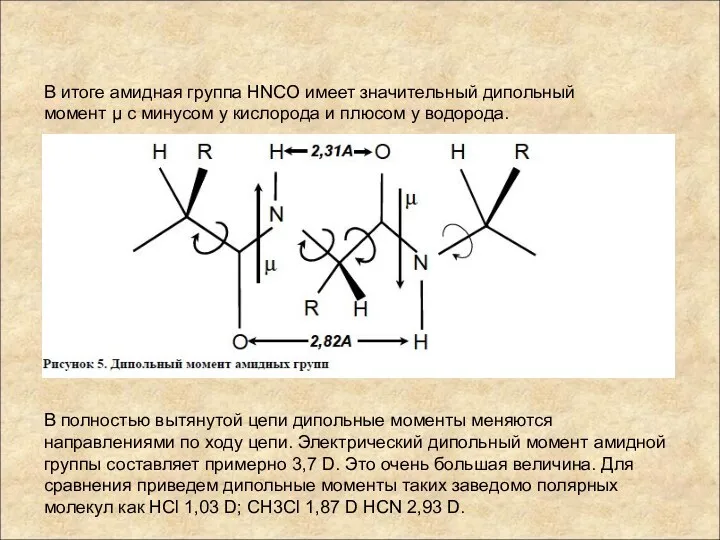
- 41. Дипольные взаимодействия По своей природе ñ это взаимодействие электрических зарядов. Распределение электронов между атомами в молекулах
- 42. В итоге амидная группа HNCO имеет значительный дипольный момент µ с минусом у кислорода и плюсом
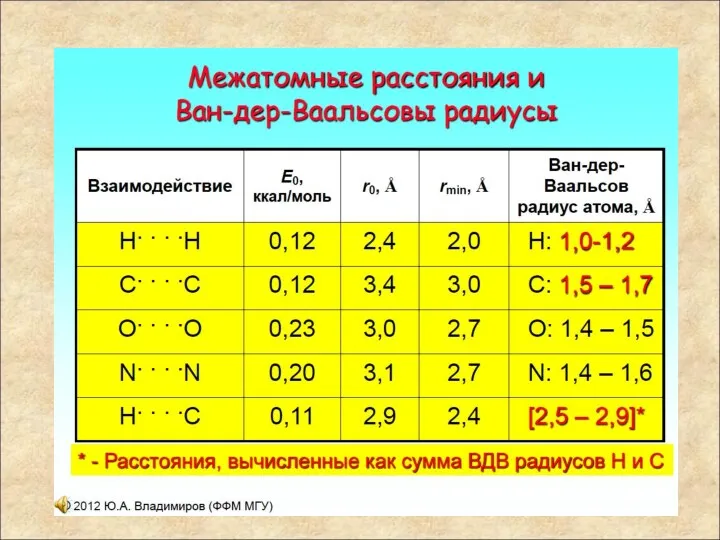
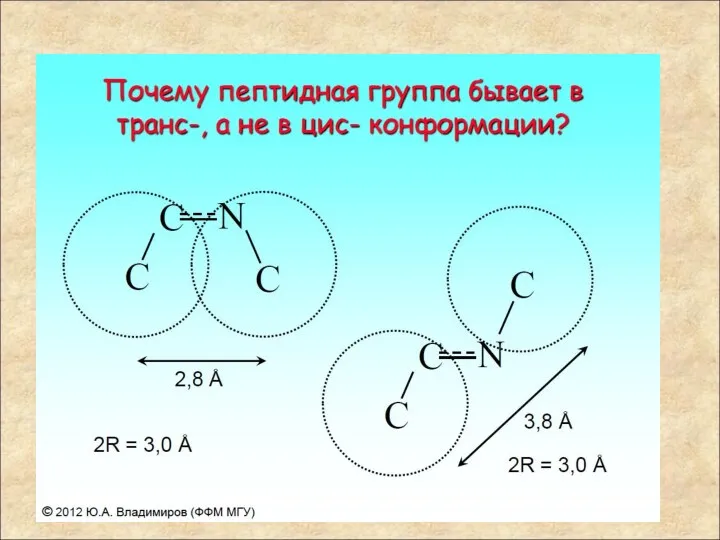
- 43. Межатомные расстояния в твердом теле и Ван-дер-ваальсовы радиусы Атомы при изменении конформации полипептидной цепи не могут
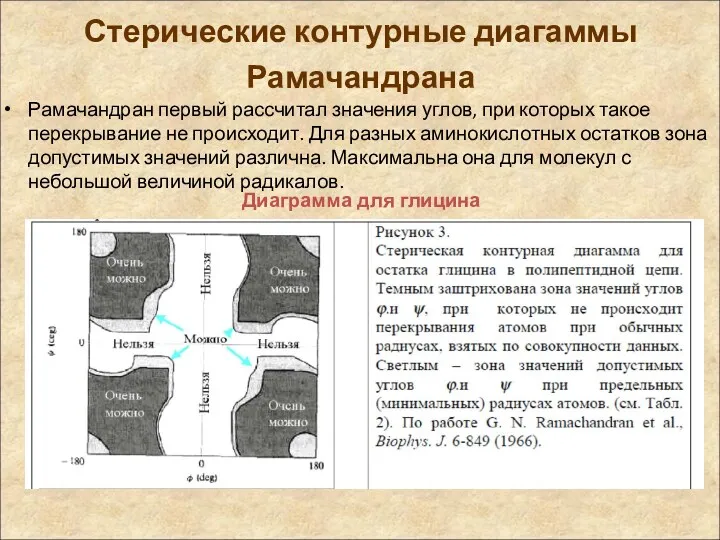
- 46. Стерические контурные диагаммы Рамачандрана Рамачандран первый рассчитал значения углов, при которых такое перекрывание не происходит. Для
- 47. Вторичная структура полипептидов и белков Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны и
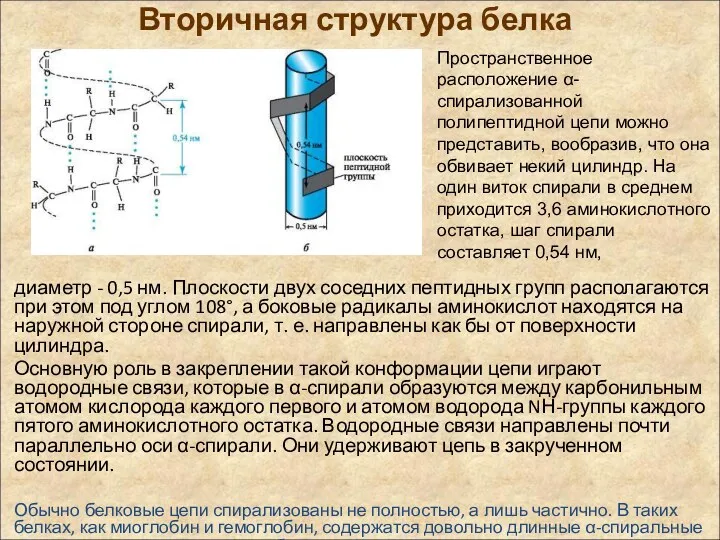
- 48. Вторичная структура белка упорядочивание за счет водородных связей Альфа спирали Лайнус Карл Полинг (1901-1994) Нобелевская премия
- 49. Вторичная структура белка диаметр - 0,5 нм. Плоскости двух соседних пептидных групп располагаются при этом под
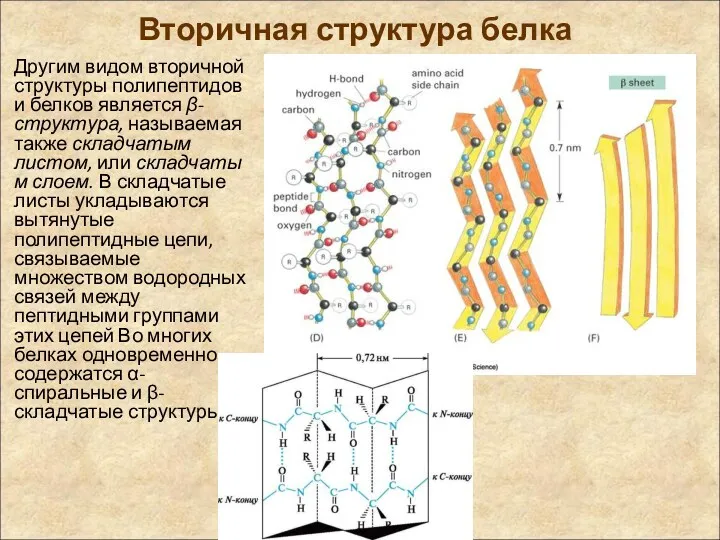
- 50. Вторичная структура белка Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом,
- 51. Это разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных
- 54. Скачать презентацию






















 презентация к уроку экологии в 9 классе
презентация к уроку экологии в 9 классе Строение клетки. Ткани
Строение клетки. Ткани Тип Членистоногие. Класс Ракообразные
Тип Членистоногие. Класс Ракообразные Протерозойская эра
Протерозойская эра Грубоволокнистая (ретикулофиброзная) костная ткань
Грубоволокнистая (ретикулофиброзная) костная ткань Части побега. Почки. Вегетативные и генеративные почки
Части побега. Почки. Вегетативные и генеративные почки 20230928_sposoby_razmnozheniya_zhivyh_orgniazmov
20230928_sposoby_razmnozheniya_zhivyh_orgniazmov Обмен веществ и энергии в организме
Обмен веществ и энергии в организме Флора и растительность Челябинской области часть 2
Флора и растительность Челябинской области часть 2 Внешнее строение насекомых.
Внешнее строение насекомых. Урок Строение и жизнедеятельность бактерий 6 класс
Урок Строение и жизнедеятельность бактерий 6 класс Белки. Содержание белков в различных тканях человека
Белки. Содержание белков в различных тканях человека Государственный природный заповедник Азас
Государственный природный заповедник Азас Удивительный мир фитодизайна
Удивительный мир фитодизайна Физиология человека
Физиология человека сновы физиологии органов кровообращения. Основы физиологии сердца
сновы физиологии органов кровообращения. Основы физиологии сердца Class ear
Class ear Презентация к уроку биологии 7 класс
Презентация к уроку биологии 7 класс Презентация к уроку по биологии 10 класс Энергетический обмен. Биологическое окисление при участии кислорода.
Презентация к уроку по биологии 10 класс Энергетический обмен. Биологическое окисление при участии кислорода. Улучшение семейного бюджета на примере разведения пчелиного хозяйства
Улучшение семейного бюджета на примере разведения пчелиного хозяйства Процессы меланизации эпидермиса
Процессы меланизации эпидермиса Развитие знаний о клетке. Клеточная теория
Развитие знаний о клетке. Клеточная теория Биотопы полости рта
Биотопы полости рта Селекция микроорганизмов
Селекция микроорганизмов Русская выхухоль
Русская выхухоль Сахарный диабет. Гормоны – производные аминокислот
Сахарный диабет. Гормоны – производные аминокислот Функциональная анатомия опорно-двигательного аппарата
Функциональная анатомия опорно-двигательного аппарата Жануарлар әлемі
Жануарлар әлемі