Содержание
- 2. Дыхательная цепь В 1961 – 1966 г. г. английский биохимик П. Митчел описал теорию окислительного фосфорилирования,
- 3. Дыхательная цепь Структура и биологическое значение митохондрий Тканевое дыхание происходит в митохондриях. Митохондрии находятся в цитоплазме
- 4. Хемиосмотическая теория Окислительного фосфорилирования Молекулы НАДН и ФАДН2, образуемые в реакциях окисления углеводов, жирных кислот, спиртов
- 5. Механизм окислительного фосфорилирования По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов.
- 6. В целом работа дыхательной цепи заключается в следующем: 1) Образующиеся в реакциях катаболизма НАДН и ФАДН2
- 7. Принцип работы дыхательной цепи 5) Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу. 6)При
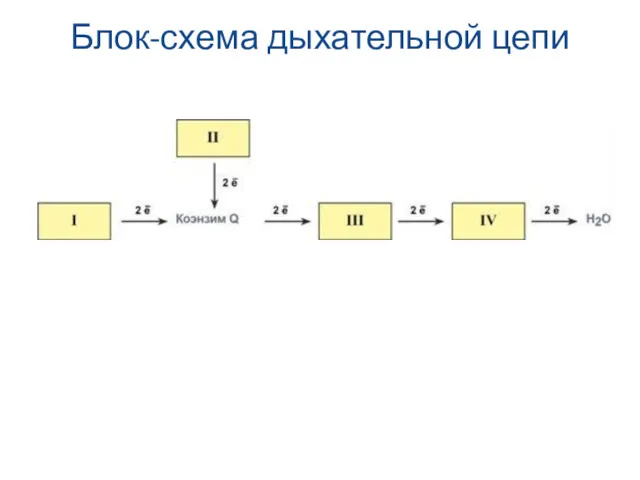
- 8. Всего цепь переноса электронов включает в себя около 40 разнообразных белков, которые организованы в 4 больших
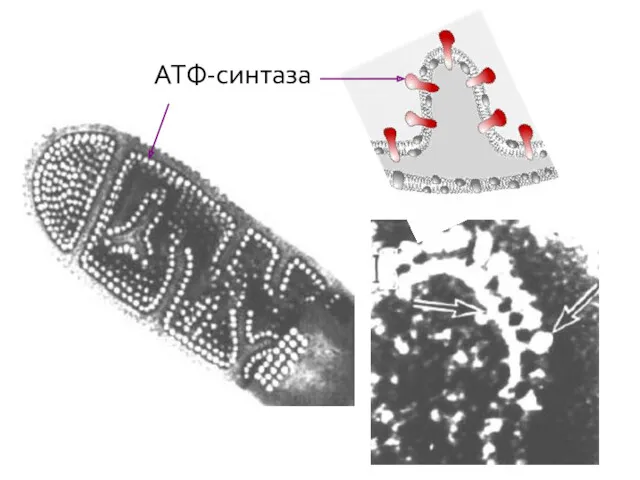
- 9. АТФ-синтаза
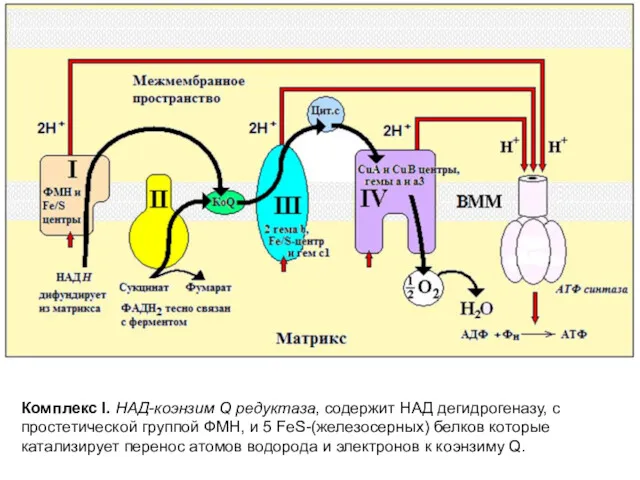
- 10. Комплекс I. НАД-коэнзим Q редуктаза, содержит НАД дегидрогеназу, с простетической группой ФМН, и 5 FeS-(железосерных) белков
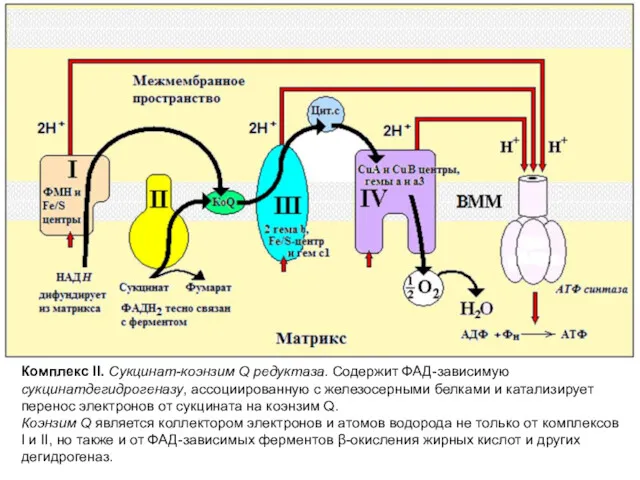
- 11. Комплекс II. Сукцинат-коэнзим Q редуктаза. Содержит ФАД-зависимую сукцинатдегидрогеназу, ассоциированную с железосерными белками и катализирует перенос электронов
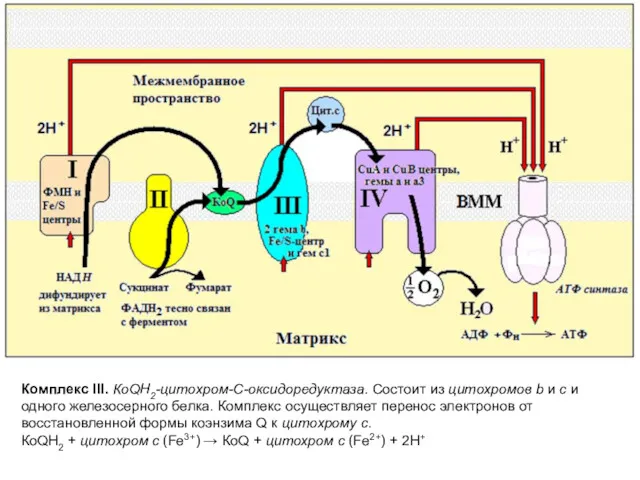
- 12. Комплекс III. КоQН2-цитохром-С-оксидоредуктаза. Состоит из цитохромов b и c и одного железосерного белка. Комплекс осуществляет перенос
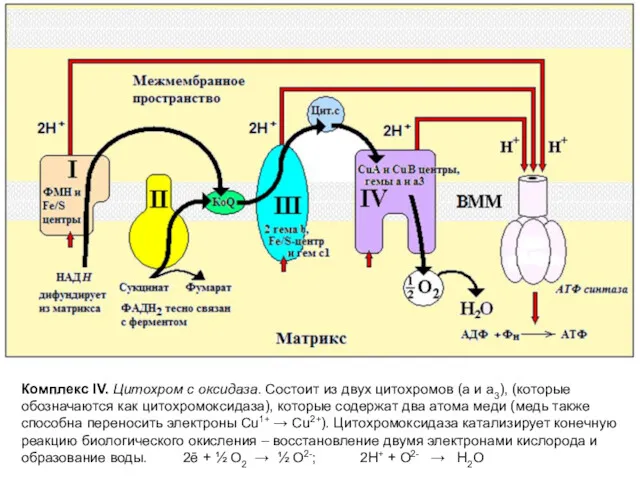
- 13. Комплекс IV. Цитохром c оксидаза. Состоит из двух цитохромов (а и а3), (которые обозначаются как цитохромоксидаза),
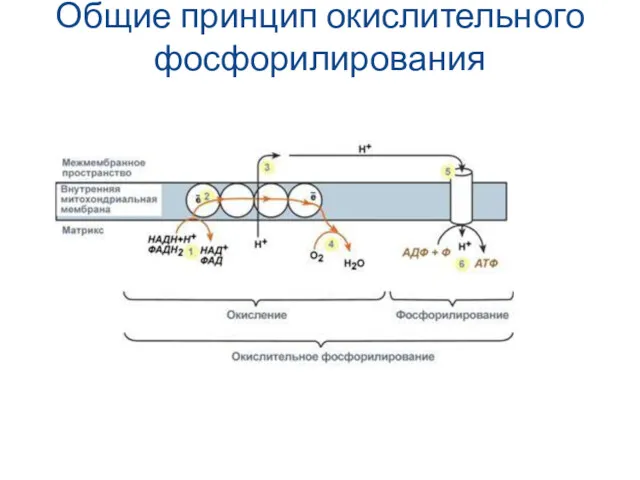
- 14. Общие принцип окислительного фосфорилирования
- 15. Блок-схема дыхательной цепи
- 16. Первый комплекс. 1 комплекс - НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 22
- 17. Второй комплекс 2 комплекс - ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно.
- 18. Третий комплекс 3 комплекс - КоQ-цитохром с-оксидоредуктаза Данный комплекс включает цитохромы b и c1. Кроме цитохромов
- 19. Четвёртый комплекс 4 комплекс. - Цитохром с-кислород-оксидоредуктаза В этом комплексе находятся цитохромы а и а3, он
- 20. Пятый комплекс 5 комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две
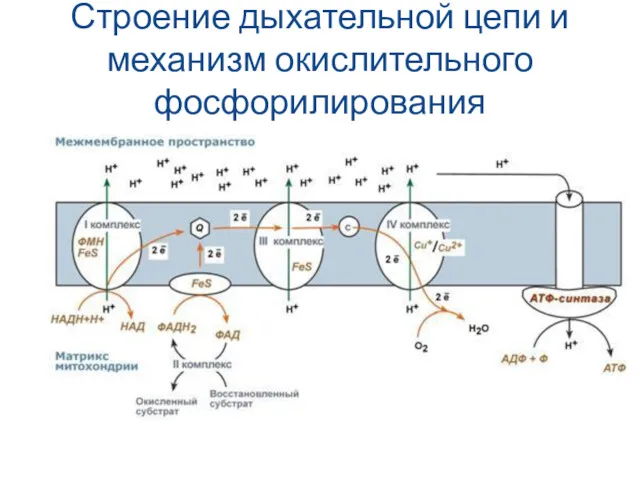
- 21. Строение дыхательной цепи и механизм окислительного фосфорилирования
- 22. Механизм окислительного фосфорилирования На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования: 1)
- 23. Механизм окислительного фосфорилирования (продолжение) 3) На внутренней мембране митохондрий атомы водорода (от НАДН и ФАДН2) передают
- 24. Використання енергії електронів Спрощено сказане можна представити у вигляді рівняння:
- 25. Участки сопряжения 5) Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных
- 26. Участки сопряжения Участки сопряжения представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов
- 27. Наработка АТФ 6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы
- 28. На клеточное дыхание можно влиять В клетке часто может создаваться ситуация, когда реакции окислительного фосфорилирования идут
- 29. Гипоэнергетические состояния Причины: гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно
- 30. Разобщители окисления и фосфорилирования К разобщителям в первую очередь относят "протонофоры" – вещества переносящие ионы водорода.
- 31. Ингибиторы ферментов дыхательной цепи Ряд веществ может ингибировать ферменты дыхательной цепи и блокировать движение электронов от
- 33. Скачать презентацию






















 Газообмен рыб
Газообмен рыб Хвощи. Внешний вид хвоща
Хвощи. Внешний вид хвоща Принципы и механизмы регуляции онтогенеза
Принципы и механизмы регуляции онтогенеза Урок-презентция по биологи 8 класс Строение клетки
Урок-презентция по биологи 8 класс Строение клетки Турбота про потомство
Турбота про потомство Нервная система
Нервная система Растительные ткани
Растительные ткани Стебель, его значение и строение. Многообразие стеблей
Стебель, его значение и строение. Многообразие стеблей Дыхание. Органы дыхательной системы
Дыхание. Органы дыхательной системы Мир комнатных растений. Окружающий мир 2 класс
Мир комнатных растений. Окружающий мир 2 класс Годовой цикл жизни земноводных
Годовой цикл жизни земноводных Всё о Кушнаренковском винограде
Всё о Кушнаренковском винограде Микроорганизмдердің морфологиясы
Микроорганизмдердің морфологиясы Онтогенез. Эмбриогенез. Постэмбриогенез
Онтогенез. Эмбриогенез. Постэмбриогенез Дикие животные Г. Бирска
Дикие животные Г. Бирска Презентация к Дню космонавтики Что едят космонавты?
Презентация к Дню космонавтики Что едят космонавты? Эволюция дыхательной системы
Эволюция дыхательной системы Терінің қосалқы мүшелері: тері және май бездері, шаш, тырнақ
Терінің қосалқы мүшелері: тері және май бездері, шаш, тырнақ Что нужно знать улитководу
Что нужно знать улитководу Нуклеиновые кислоты. ДНК, РНК
Нуклеиновые кислоты. ДНК, РНК Химический состав клетки
Химический состав клетки Загадочный Иван-чай или чудесное превращение Кипрея
Загадочный Иван-чай или чудесное превращение Кипрея Систематика растений
Систематика растений Обмен веществ и энергии в клетке
Обмен веществ и энергии в клетке Сравнение характеристик процессов фотосинтеза и дыхания
Сравнение характеристик процессов фотосинтеза и дыхания Анатомия, физиология и гигиена сенсорных систем
Анатомия, физиология и гигиена сенсорных систем Ядовитые растения Крыма
Ядовитые растения Крыма История развития экологических связей человечества
История развития экологических связей человечества