Содержание
- 2. Ферменты или энзимы - особые белки, выполняющие функцию катализаторов химических реакций; Практически все химические реакции в
- 3. Участок молекулы фермента, на котором происходит катализ, получил название «активный центр»; Если фермент по строению является
- 4. В активном центре обычно выделяют два участка – адсорбционный и каталитический
- 5. Адсорбционный участок (центр связывания) по своему строению соответствует структуре реагирующих соединений, и поэтому к нему легко
- 6. Ферментативный катализ обычно протекает в три стадии.
- 7. I стадия – образование фермент-субстратного комплекса На этой стадии молекулы реагирующих веществ (субстрата) присоединяются к адсорбционному
- 8. II стадия – химическое преобразование фермент-субстратного комплекса На второй стадии с участием каталитического участка активного центра
- 9. III стадия - образование конечного продукта На третьей стадии происходит отделение продукта реакции от активного центра
- 10. Общая схема ферментативного катализа
- 11. В некоторых случаях в катализе наряду с белком-ферментом еще участвует низкомолекулярное (небелковое) соединение, называемое коферментом; Большинство
- 12. Специфичность ферментов Различают два вида специфичности ферментов: специфичность действия и субстратную специфичность; Специфичность действия – это
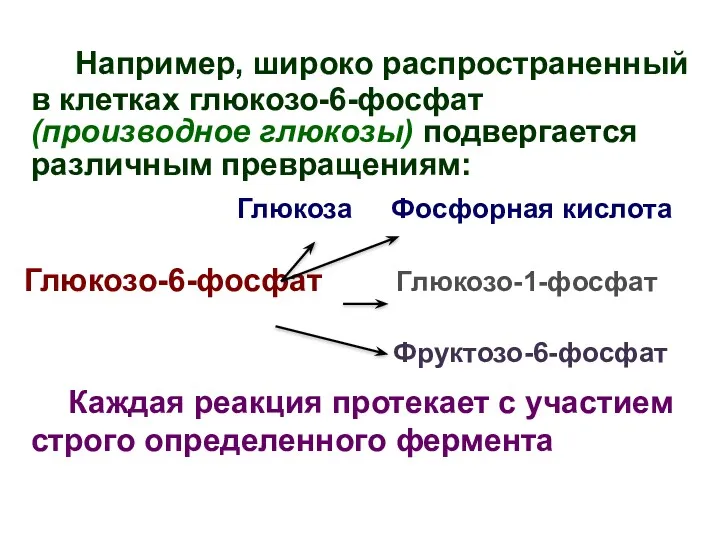
- 13. Например, широко распространенный в клетках глюкозо-6-фосфат (производное глюкозы) подвергается различным превращениям: Глюкоза Фосфорная кислота Глюкозо-6-фосфат Глюкозо-1-фосфат
- 14. Таким образом, каждый фермент катализирует только одну из всех возможных реакций, в которые может вступать субстрат;
- 15. Субстратная специфичность – способность фермента действовать только на определенные субстраты; Различают две разновидности субстратной специфичности: абсолютную
- 16. Фермент, обладающий абсолютной субстратной специфичностью, катализирует превращения только одного субстрата; На другие вещества, даже очень близкие
- 17. Относительная (групповая) субстратная специфичность – это способность фермента катализировать превращения нескольких похожих по строению веществ; Обычно
- 18. Кинетика ферментативного катализа Скорость ферментативных реакций существенно зависит от многих факторов; К ним относятся концентрации участников
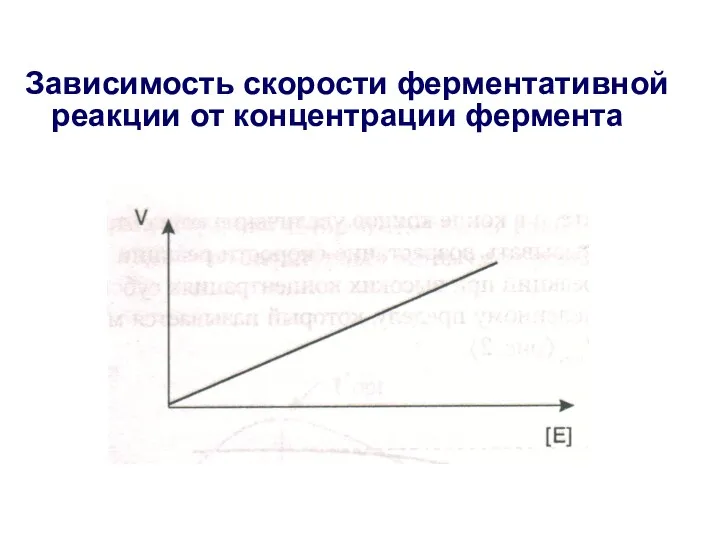
- 19. Зависимость скорости ферментативной реакции от концентрации фермента
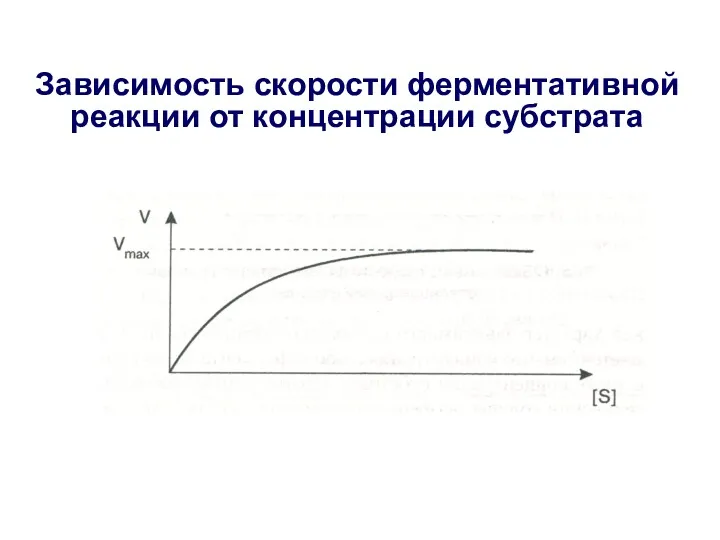
- 20. Зависимость скорости ферментативной реакции от концентрации субстрата
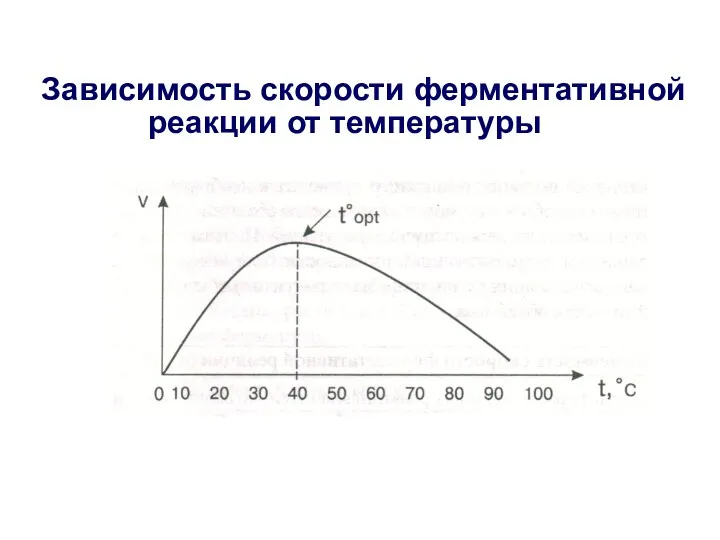
- 21. Зависимость скорости ферментативной реакции от температуры
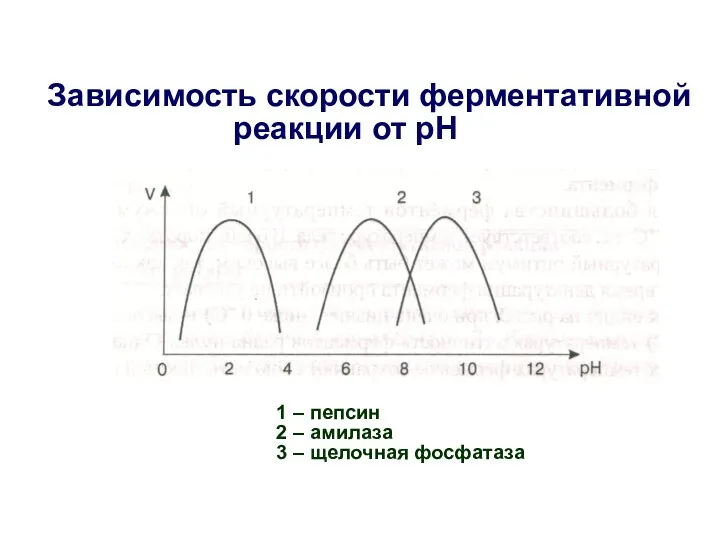
- 22. Зависимость скорости ферментативной реакции от рН 1 – пепсин 2 – амилаза 3 – щелочная фосфатаза
- 23. Ингибиторы и активаторы ферментов Ингибиторы (I) - это химические соединения (обычно низкомолекулярные), которые, находясь в низких
- 24. Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает
- 25. Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не
- 26. Обратимые ингибиторы конкурентные неконкурентные
- 27. Конкурентные ингибиторы присоединяются к активному центру фермента, т.е. к тому же участку поверхности фермента, что и
- 28. Неконкурентные ингибиторы присоединяются к ферменту вне активного центра; Этот участок поверхности фермента называется аллостерический центр (т.е.
- 29. Неконкурентные ингибиторы участвуют в регуляции скорости ферментативных реакций, протекающих в организме; В роли неконкурентных ингибиторов могут
- 30. Активаторы - вещества, избирательно повышающие скорость определенных ферментативных реакций; Активаторы, подобно неконкурентным ингибиторам, присоединяются обратимо к
- 31. В организме активаторами являются некоторые гормоны, промежуточные продукты обмена веществ, ионы металлов, а также лекарственные препараты.
- 32. Регуляция скорости ферментативных реакций Особенностью ферментативных реакций является наличие механизмов регуляции их скорости; Благодаря регуляторным механизмам
- 33. Основные механизмы регуляции скорости ферментативных реакций Изменение скорости синтеза ферментов; Модификация ферментов; Изменение конформации ферментов;
- 34. Классификация и индексация ферментов Современная классификация ферментов основывается на характере химической реакции, катализируемой ферментом; Все ферменты
- 35. I класс – оксидоредуктазы Ферменты, катализирующие окислительно-восстановительные реакции. Схематично действие ферментов I класса можно записать: A
- 36. III класс – гидролазы Ферменты, расщепляющие химические связи путем присоединения воды, т.е. путем гидролиза: AB +
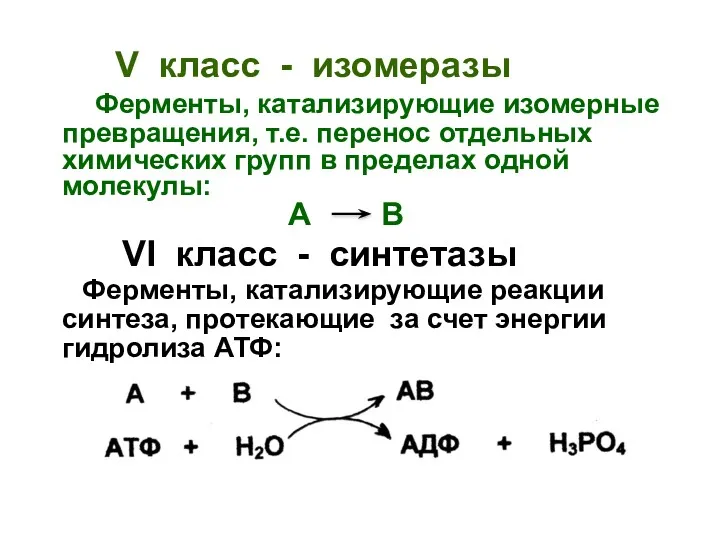
- 37. V класс - изомеразы Ферменты, катализирующие изомерные превращения, т.е. перенос отдельных химических групп в пределах одной
- 38. Каждый класс, в свою очередь, делится на подклассы, внутри подклассов выделены подподклассы; Каждый подподкласс содержит список
- 39. Индексация (нумерация) ферментов Индекс (шифр) каждого фермента состоит из четырех чисел, разделенных точками, и составляется по
- 40. Например, фермент слюны – амилаза, расщепляющий крахмал, имеет индекс 3.2.1.1., что свидетельствует о принадлежности этого фермента
- 41. Тест 1 Ферменты в организме выполняют функцию: а) каталитическую б) структурную в) транспортную г) энергетическую
- 42. Тест 2 Ферменты проявляют оптимальную активность при температуре: а) 0-10 ̊̊̊С б) 35-40 ̊̊̊С в) 55-75
- 43. Тест 3 Первой стадией ферментативного катализа является: а) возвращение фермента в исходное состояние б) образование фермент-субстратного
- 44. Тест 4 Ферменты обладают наибольшей активностью: а) в кислой среде б) в нейтральной среде в) в
- 45. Тест 5 Скорость ферментативной реакции зависит от: а) аминокислотного состава фермента б) концентрации фермента в) молекулярной
- 46. Тест 6 Конкурентные ингибиторы снижают скорость ферментативных реакций вследствие: а) присоединения к активному центру фермента б)
- 47. Тест 7 Неконкурентные ингибиторы снижают скорость ферментативных реакций вследствие: а) изменения конформации фермента б) изменения химического
- 48. Тест 8 В состав коферментов входят: а) α-аминокислоты б) витамины в) гормоны г) жирные кислоты
- 49. Тест 9 Название класса ферментов указывает на: а) конформацию фермента б) молекулярную массу фермента в) тип
- 50. Тест 10 Ферменты, катализирующие реакции расщепления с участием воды, относятся к классу: а) гидролаз б) изомераз
- 51. Тест 11 Ферменты, катализирующие реакции внутримолекулярного переноса, относятся к классу: а) гидролаз б) изомераз в) оксидоредуктаз
- 52. Тест 12 Ферменты, катализирующие реакции межмолекулярного переноса, относятся к классу: а) гидролаз б) изомераз в) оксидоредуктаз
- 53. Тест 13 Ферменты, катализирующие окислительно-восстановительные реакции, относятся к классу: а) гидролаз б) изомераз в) оксидоредуктаз г)
- 54. Тест 14 Каждый фермент имеет индекс: а) двухзначный б) трехзначный в) четырехзначный г) пятизначный
- 55. Тест 15 Фермент с индексом 1.1.1.27 относится к классу: а) гидролаз б) изомераз в) оксидоредуктаз г)
- 56. Тест 16 Фермент с индексом 3.1.1.7 относится к классу: а) гидролаз б) изомераз в) оксидоредуктаз г)
- 57. Тест 17 Фермент лактатдегидрогеназа имеет индекс: а) 1.1.1.1 б) 2.1.1.10 в) 3.1.1.3 г) 5.4.1.1
- 59. Скачать презентацию


















































 Дикие животные
Дикие животные Анатомо-физиологические особенности органа зрения
Анатомо-физиологические особенности органа зрения Естественный отбор
Естественный отбор Строение и функции клетки
Строение и функции клетки Органические вещества клетки – нуклеиновые кислоты ДНК и РНК
Органические вещества клетки – нуклеиновые кислоты ДНК и РНК Қол қаңқасының сүйектер
Қол қаңқасының сүйектер ОПРЕДЕЛЕНИЕ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МОЕЙ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ (ССС). УРОК-ПРАКТИКУМ для учащихся 8- классов Учитель Фурса М.Н. ГБОУ гимназия № 209
ОПРЕДЕЛЕНИЕ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МОЕЙ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ (ССС). УРОК-ПРАКТИКУМ для учащихся 8- классов Учитель Фурса М.Н. ГБОУ гимназия № 209 Сущность жизни и свойства живого. Уровни организации живой материи
Сущность жизни и свойства живого. Уровни организации живой материи Особенности двудольных растений. Обобщение игра. 7 класс
Особенности двудольных растений. Обобщение игра. 7 класс Эволюционное учение
Эволюционное учение Любимые сад и огород. В.Н. Пастарнаков. Цикл: для начинающих. Часть 1. Посадка рассады
Любимые сад и огород. В.Н. Пастарнаков. Цикл: для начинающих. Часть 1. Посадка рассады Биология полорогих: дзерена, сайгака, горала
Биология полорогих: дзерена, сайгака, горала Кормление лошадей
Кормление лошадей Методы микробиологической диагностики вирусных инфекций. Профилактика вирусных инфекций
Методы микробиологической диагностики вирусных инфекций. Профилактика вирусных инфекций Общее учение о нервной системе (неврология). Развитие нервной системы. Спинной мозг
Общее учение о нервной системе (неврология). Развитие нервной системы. Спинной мозг Знакомство с внешним строением цветкового растения
Знакомство с внешним строением цветкового растения Скопа - птица 2018 года
Скопа - птица 2018 года Культура горох посевной
Культура горох посевной Моллюски
Моллюски Селекция и её достижения
Селекция и её достижения Развитие растения. Семя, плод, зародыш, прорастание
Развитие растения. Семя, плод, зародыш, прорастание Кислородсодержащие органические соединения. Органическая химия
Кислородсодержащие органические соединения. Органическая химия Высшие или плацентарные звери
Высшие или плацентарные звери Содержание кислорода в атмосфере
Содержание кислорода в атмосфере Дикие животные
Дикие животные Радиочувствительность тканей, органов, организма. Радиационные синдромы
Радиочувствительность тканей, органов, организма. Радиационные синдромы Презентация урока биологии Насекомые
Презентация урока биологии Насекомые Общий покров. Кожа и её производные
Общий покров. Кожа и её производные