Содержание
- 2. Ферменты – это биокатализаторы белковой природы, изменяющие скорость химических реакций в живых клетках
- 3. Свойства ферментов как белков Имеют высокую молекулярную массу Образуют коллоидные растворы Термолабильны Обладают высокой вязкостью, оптическими
- 4. Свойства ферментов как катализаторов Катализируют только термодинамически возможные реакции Не потребляются в ходе реакции и не
- 5. Собственные свойства ферментов Высокая биологическая активность Ферментная специфичность действия субстратная Иная зависимость от факторов, влияющих на
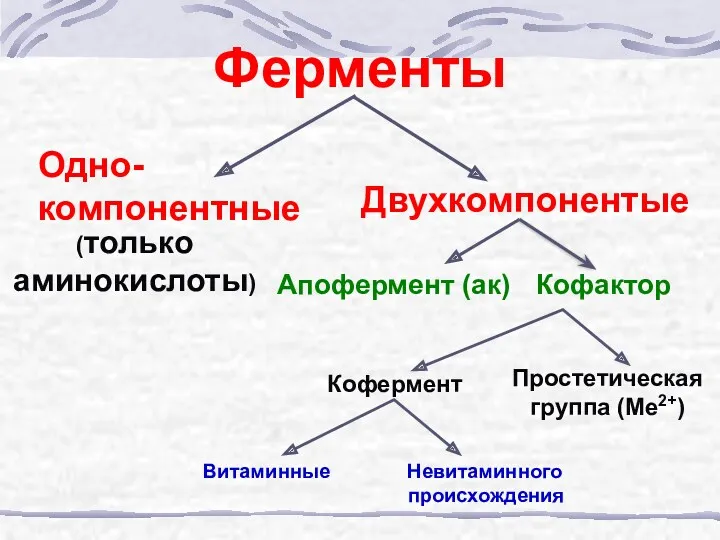
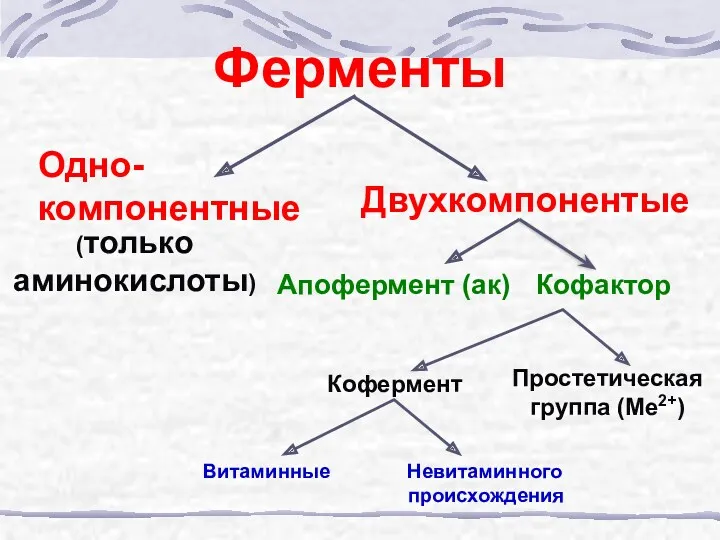
- 6. Ферменты Одно-компонентные (только аминокислоты) Двухкомпонентые Апофермент (ак) Простетическая группа (Ме2+) Кофактор Кофермент Витаминные Невитаминного происхождения
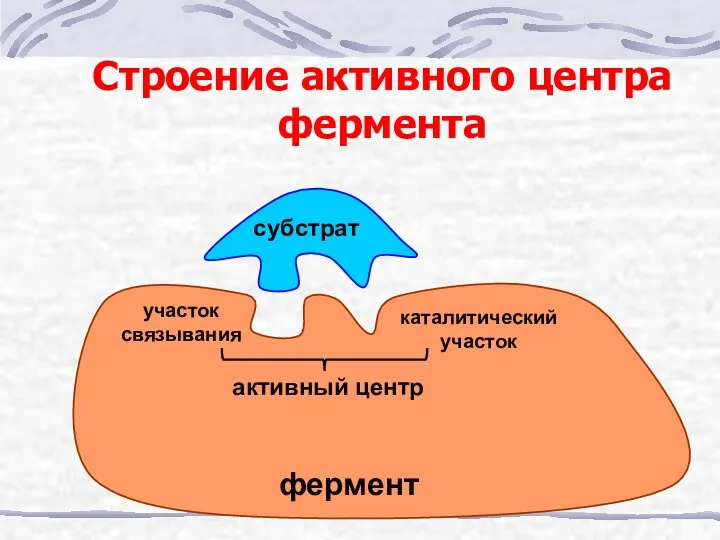
- 7. Строение активного центра фермента субстрат участок связывания каталитический участок активный центр фермент
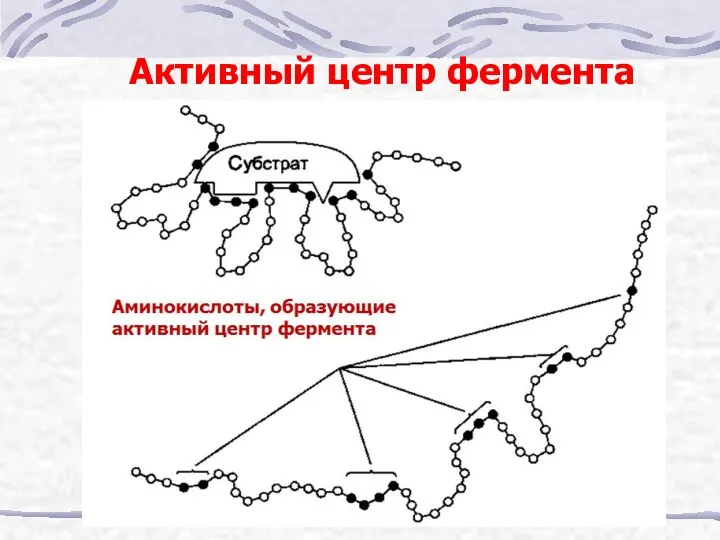
- 8. Активный центр – участок молекулы фермента, в котором происходит узнавание, связывание и химическое превращение молекулы субстрата.
- 9. Активный центр фермента
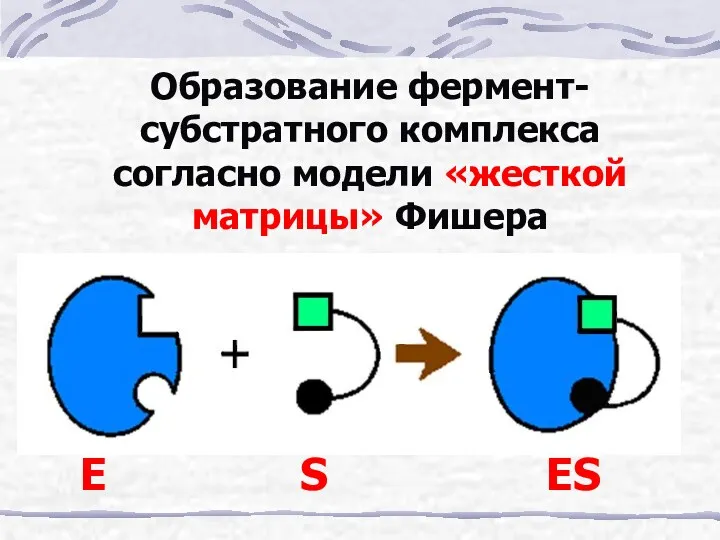
- 10. Образование фермент-субстратного комплекса согласно модели «жесткой матрицы» Фишера E S ES
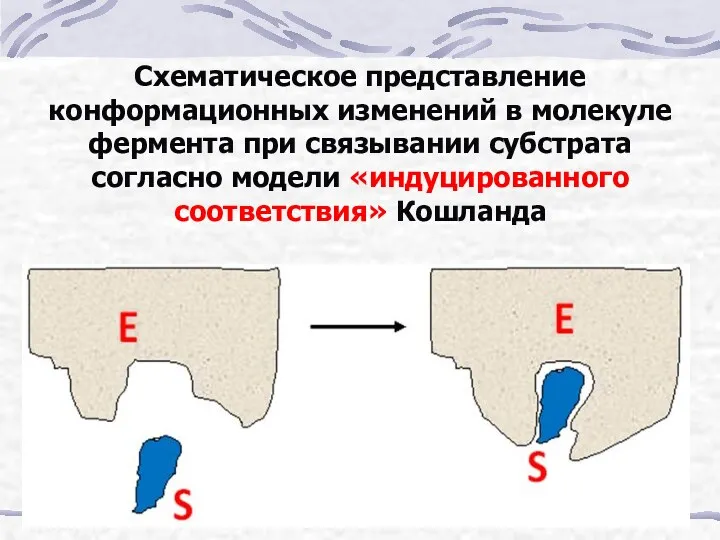
- 11. Схематическое представление конформационных изменений в молекуле фермента при связывании субстрата согласно модели «индуцированного соответствия» Кошланда
- 12. Общее уравнение ферментативной реакции: E + S ES EP E + P k2 k3 k1
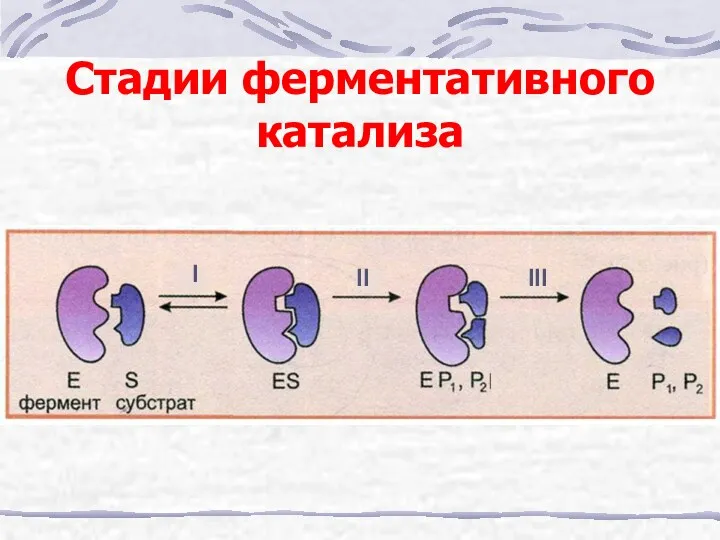
- 13. Стадии ферментативного катализа I III II
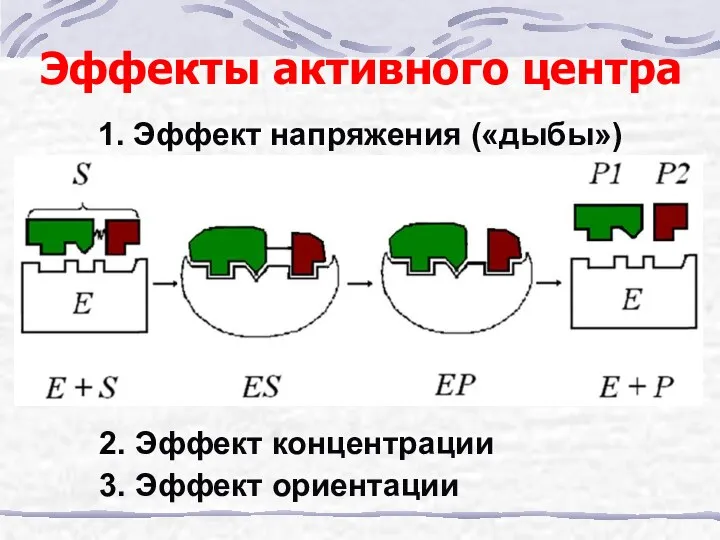
- 14. Эффекты активного центра 1. Эффект напряжения («дыбы») 3. Эффект ориентации 2. Эффект концентрации
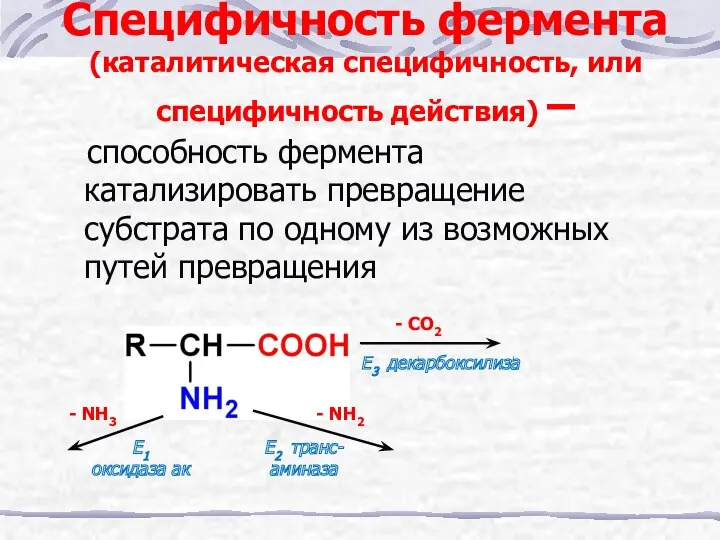
- 15. Специфичность фермента (каталитическая специфичность, или специфичность действия) – способность фермента катализировать превращение субстрата по одному из
- 16. Специфичность фермента (субстратная специфичность) – способность фермента узнавать, связывать и катализировать превращение только определённых субстратов, м.б.
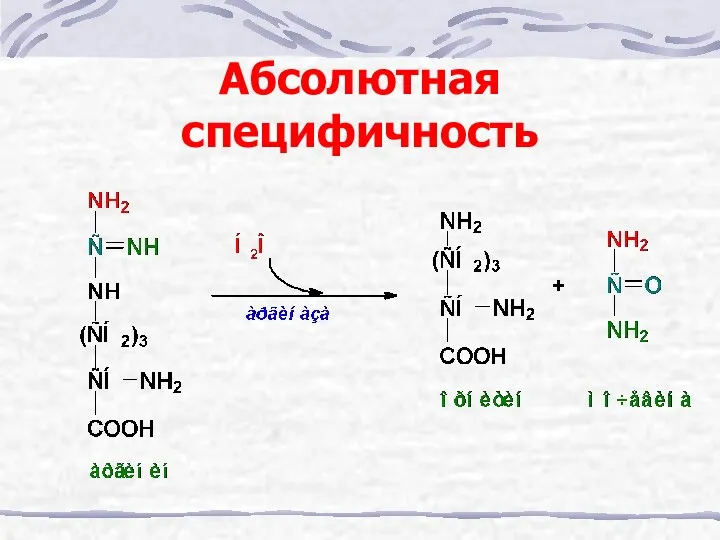
- 17. Абсолютная специфичность
- 18. Относительная специфичность
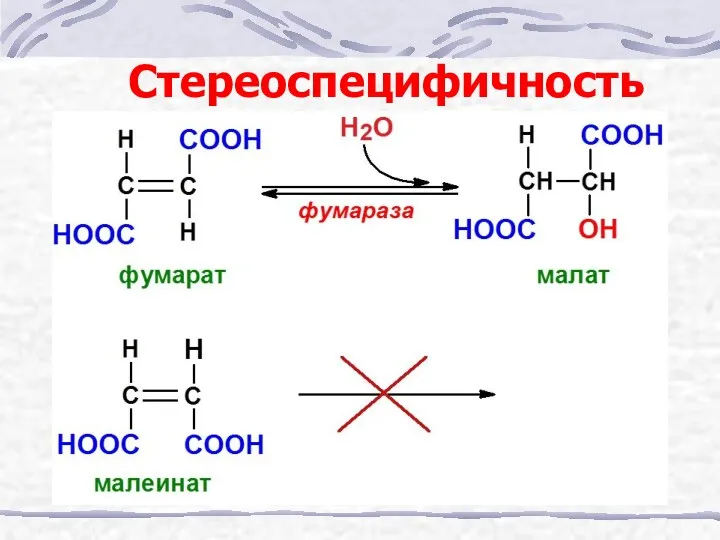
- 19. Стереоспецифичность
- 20. Общее уравнение ферментативной реакции: E + S ES EP E + P k2 k3 k1
- 21. Константа Михаэлиса
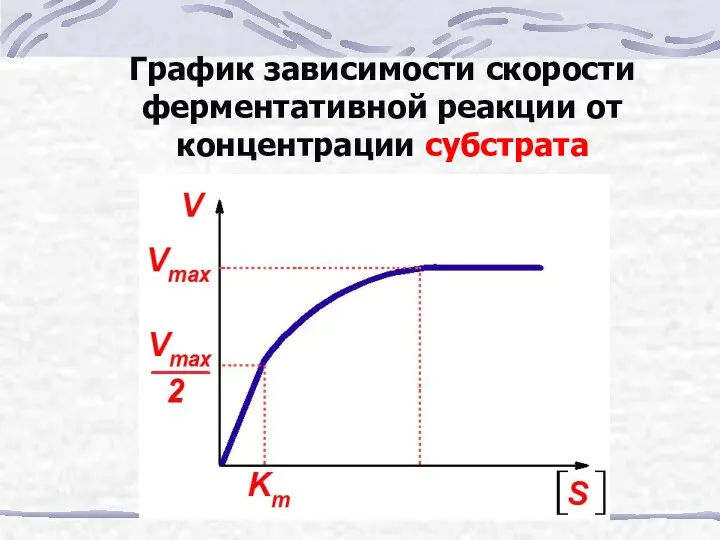
- 22. Зависимость скорости ферментативной реакции от концентрации субстрата
- 23. График зависимости скорости ферментативной реакции от концентрации субстрата
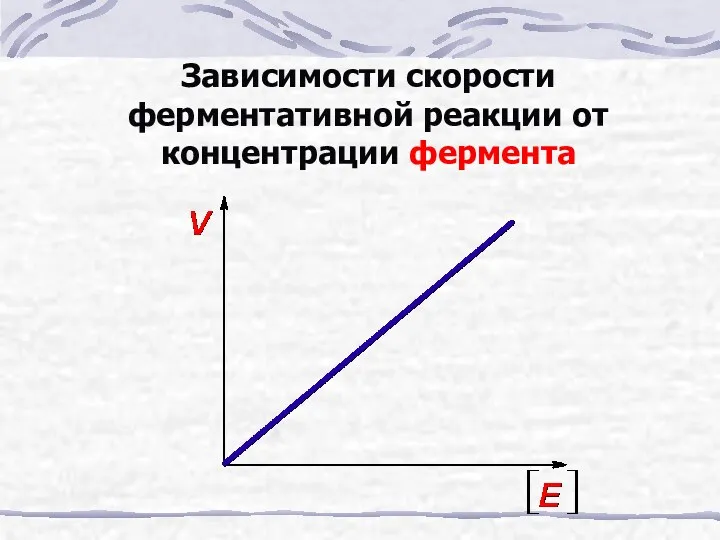
- 24. Зависимости скорости ферментативной реакции от концентрации фермента
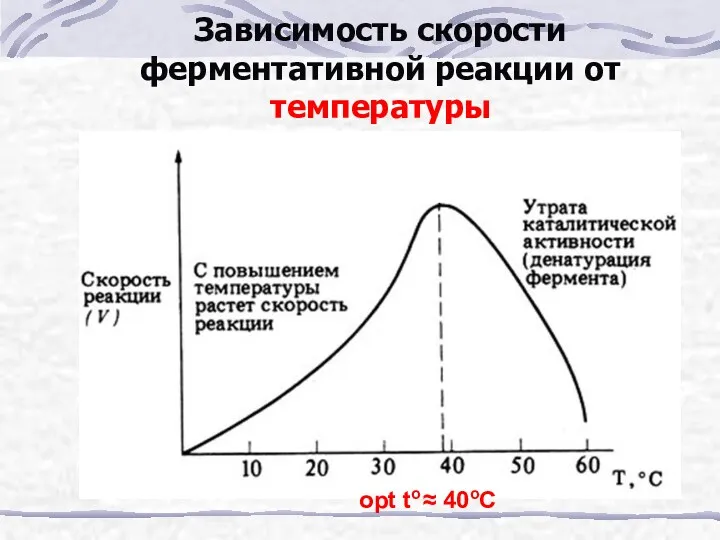
- 25. Зависимость скорости ферментативной реакции от температуры opt to ≈ 40oC
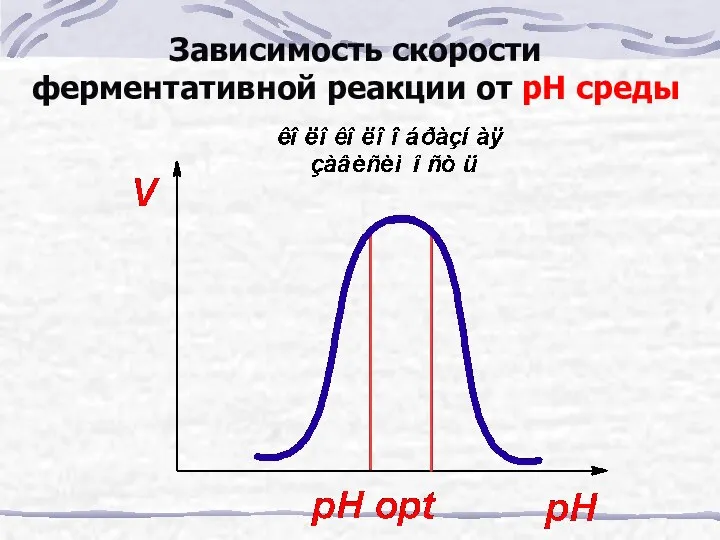
- 26. Зависимость скорости ферментативной реакции от рН среды
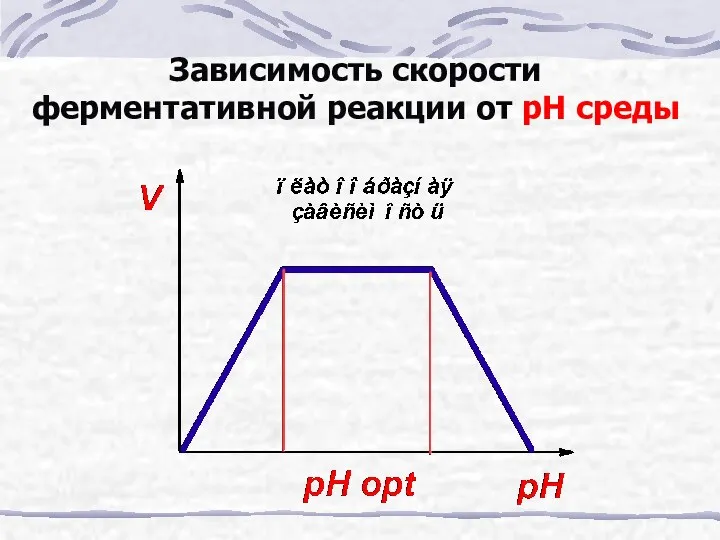
- 27. Зависимость скорости ферментативной реакции от рН среды
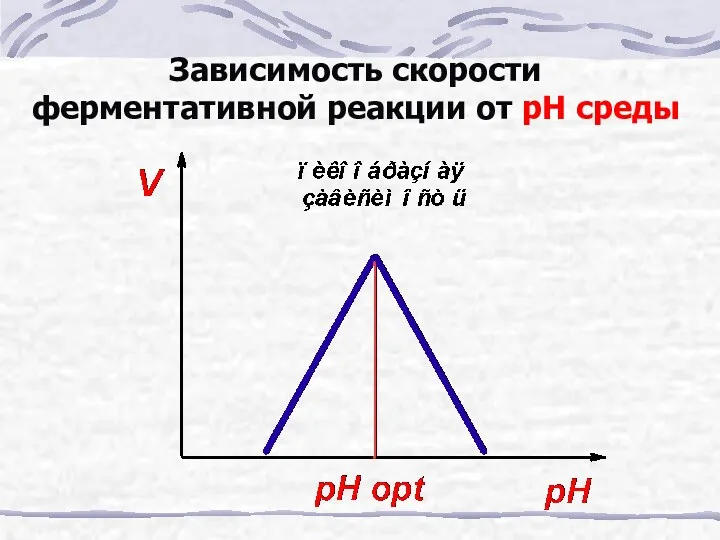
- 28. Зависимость скорости ферментативной реакции от рН среды
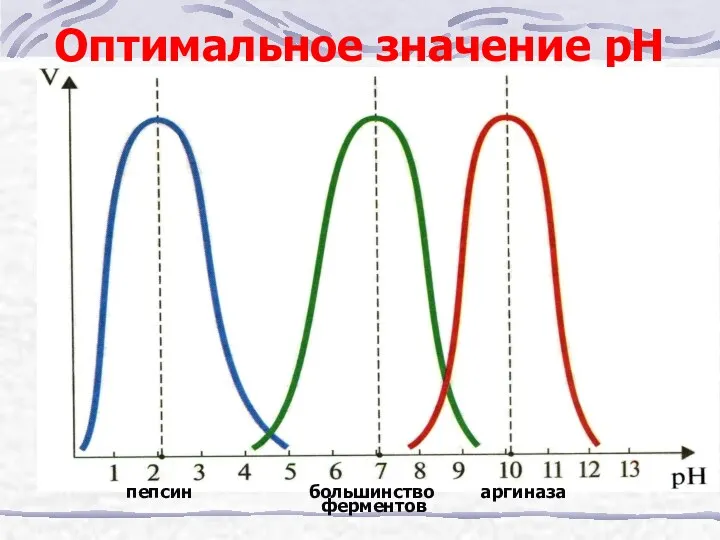
- 29. Оптимальное значение рН пепсин большинство аргиназа ферментов
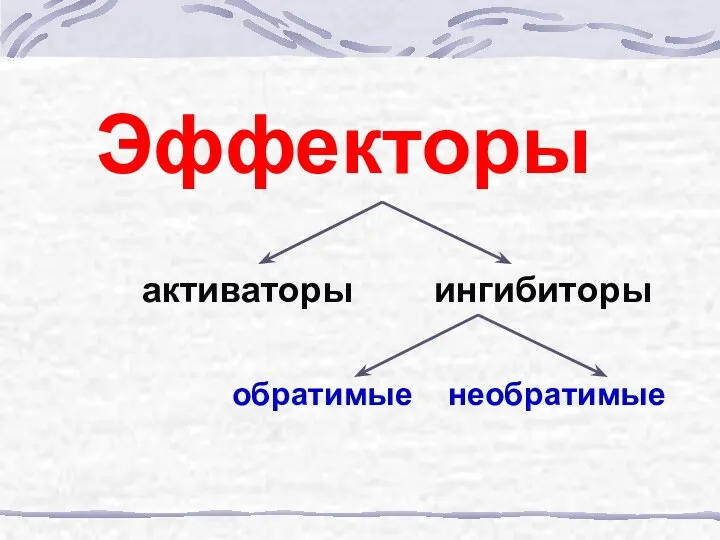
- 30. Эффекторы активаторы ингибиторы обратимые необратимые
- 31. Активаторы Неорганические вещества Низкомолекулярные органические вещества Белки
- 32. Основные механизмы действия активаторов «Площадка» для взаимодействия фермента и субстрата Повышение сродства фермента и субстрата Отщепление
- 33. Механизмы ингибирования Конкурентное Неконкурентное Бесконкурентное Субстратное Аллостерическое
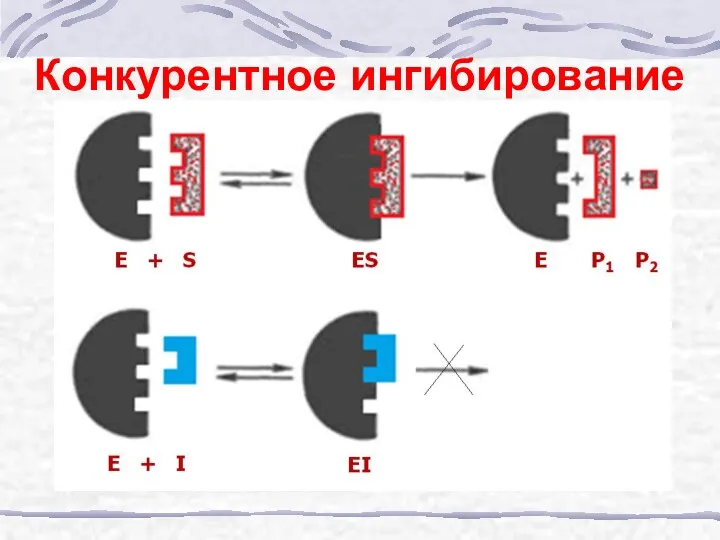
- 34. Конкурентное ингибирование
- 35. Конкурентное ингибирование E + S ES EP E + P E + I EI
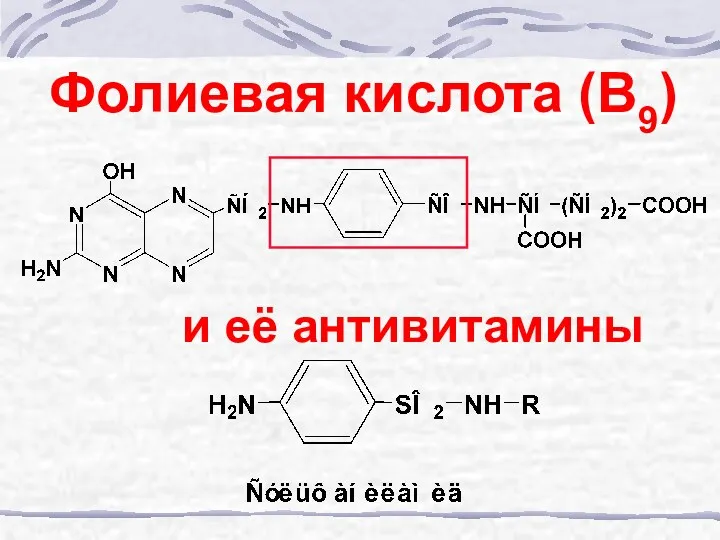
- 36. Фолиевая кислота (В9) и её антивитамины
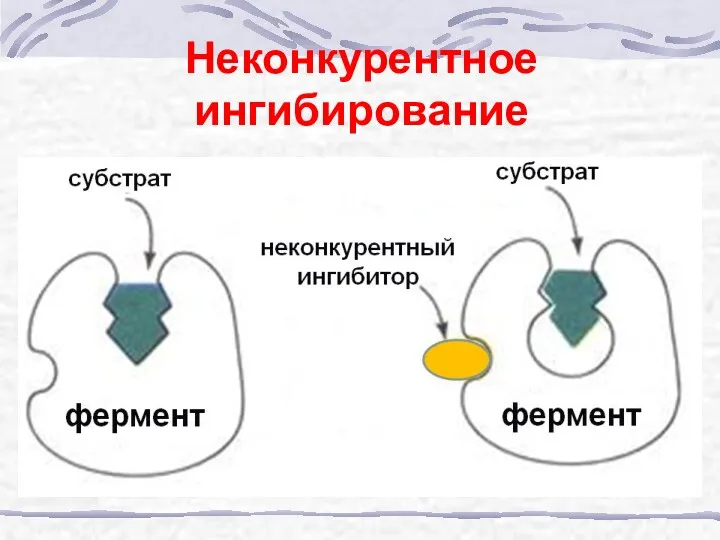
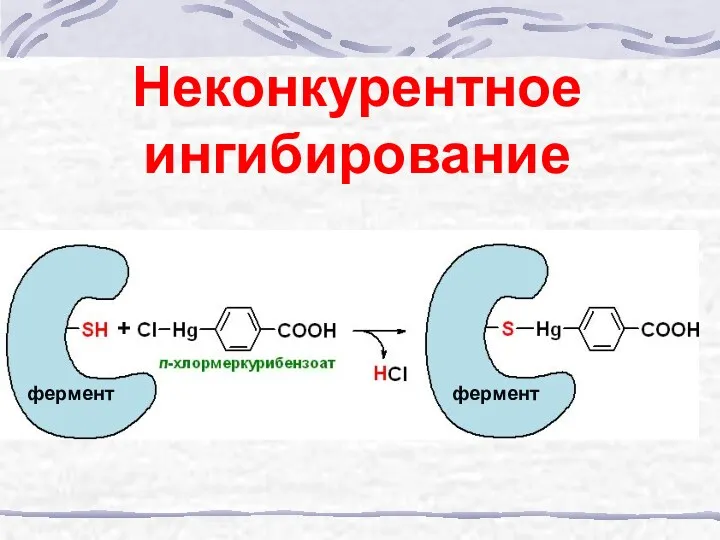
- 37. Неконкурентное ингибирование
- 38. Неконкурентное ингибирование фермент фермент +
- 39. Неконкурентное ингибирование E + S ES EP E + P E + I EI
- 40. Бесконкурентное ингибирование E + S ES EP E + P ES + I ESI
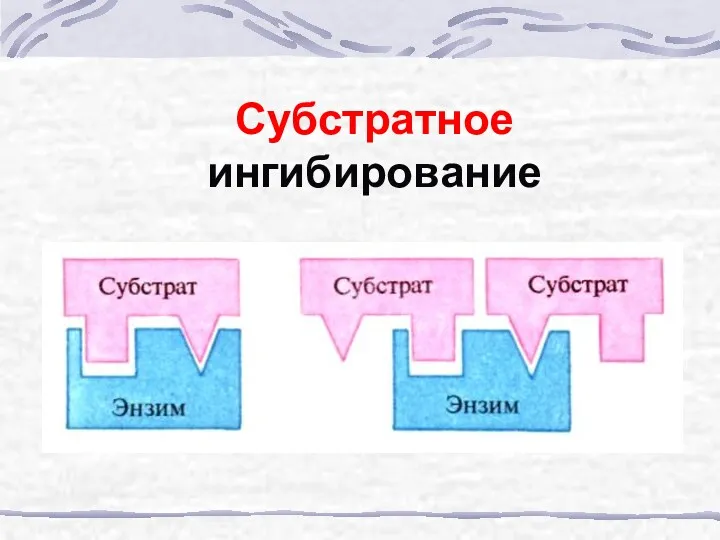
- 41. Субстратное ингибирование
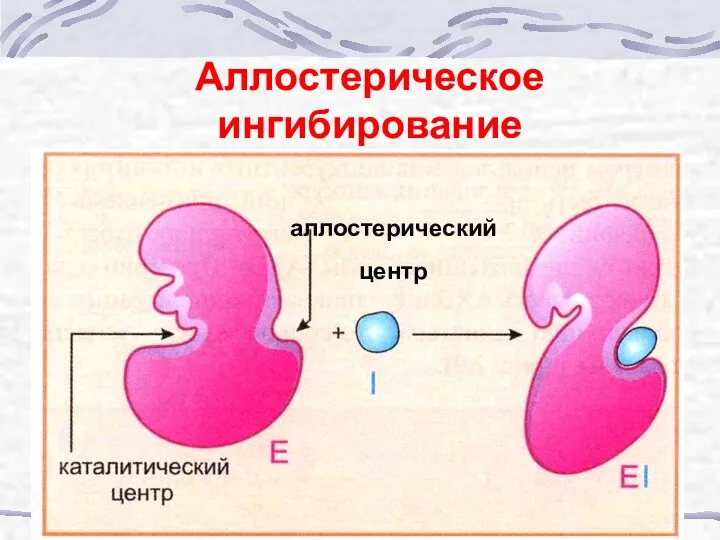
- 42. Аллостерическое ингибирование аллостерический центр
- 43. Ферменты Одно-компонентные (только аминокислоты) Двухкомпонентые Апофермент (ак) Простетическая группа (Ме2+) Кофактор Кофермент Витаминные Невитаминного происхождения
- 44. Металлы, содержащиеся в ферментах
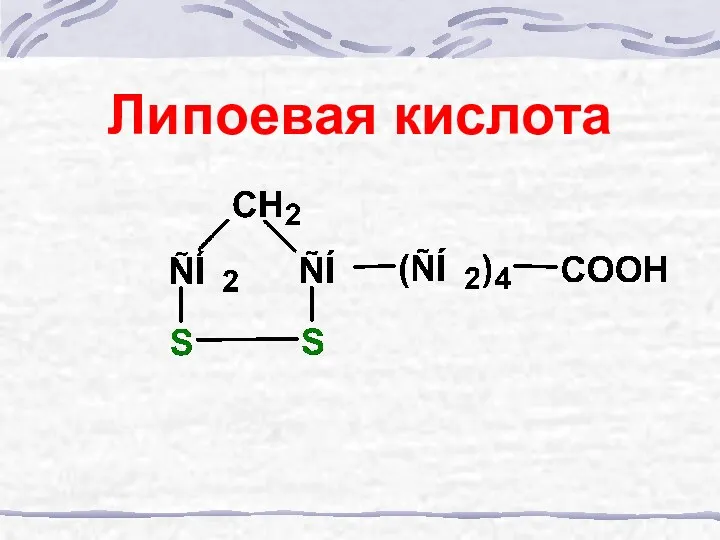
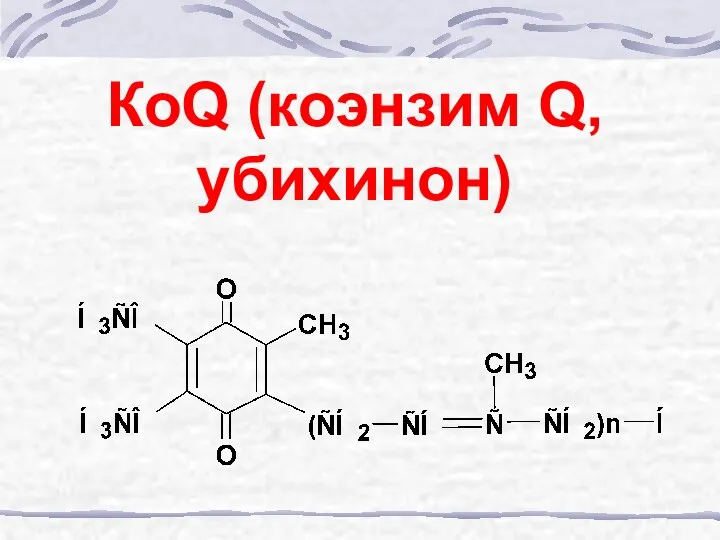
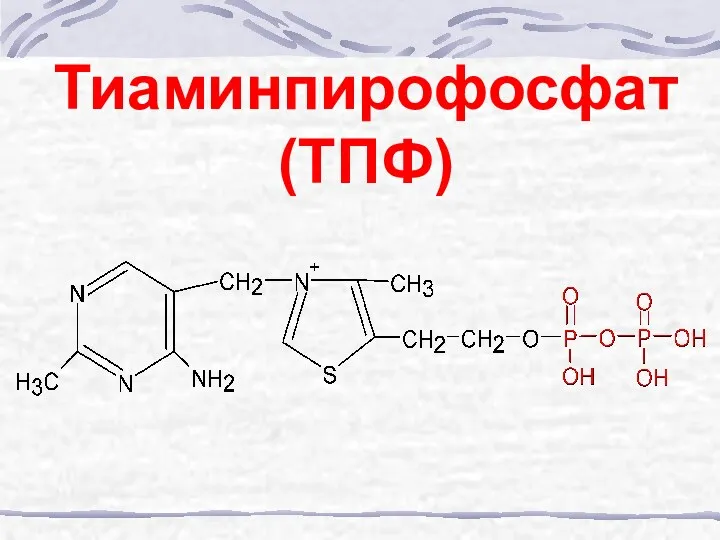
- 45. Классификация коферментов По химическому строению 1. Алифатические (липоевая кислота); 2. Ароматические (коэнзим Q); 3. Гетероциклические (ТПФ,
- 46. Липоевая кислота
- 47. КоQ (коэнзим Q, убихинон)
- 48. Тиаминпирофосфат (ТПФ)
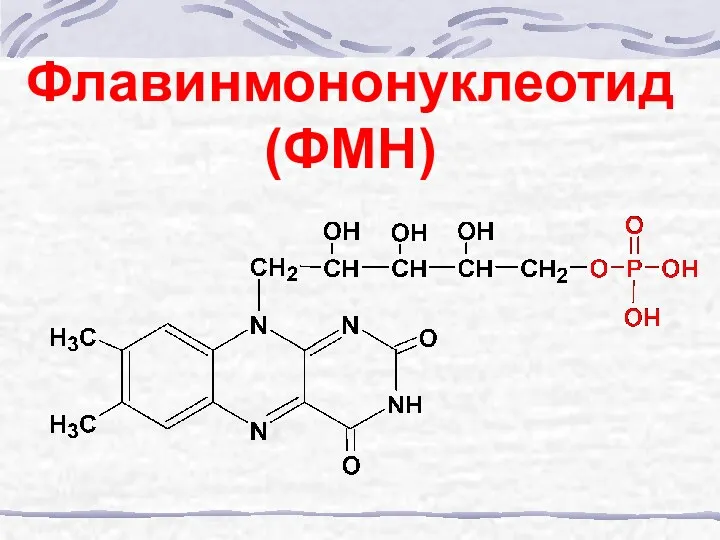
- 49. Флавинмононуклеотид (ФМН)
- 50. По выполняемым функциям 1. Переносчики протонов и электронов (НАД, ФАД, Ко Q); 2. Переносчики групп (ТПФ,
- 51. По механизму действия 1. Коферменты с высоким потенциалом переноса энергии (переносчики энергии); 2. Коферменты, участвующие в
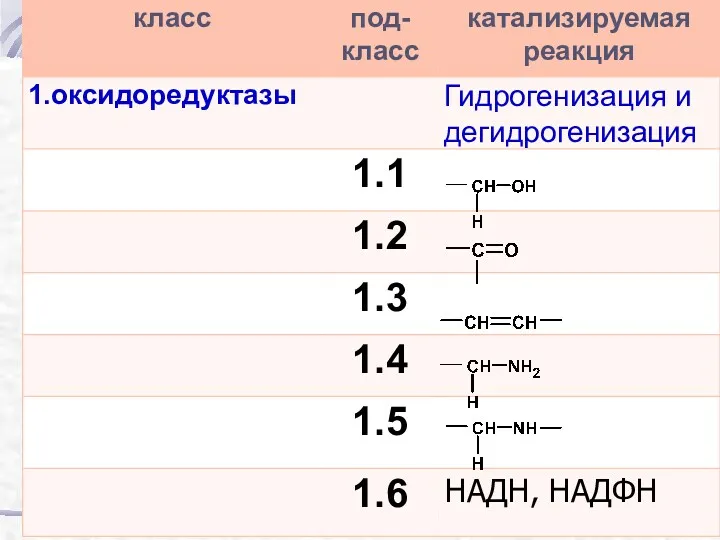
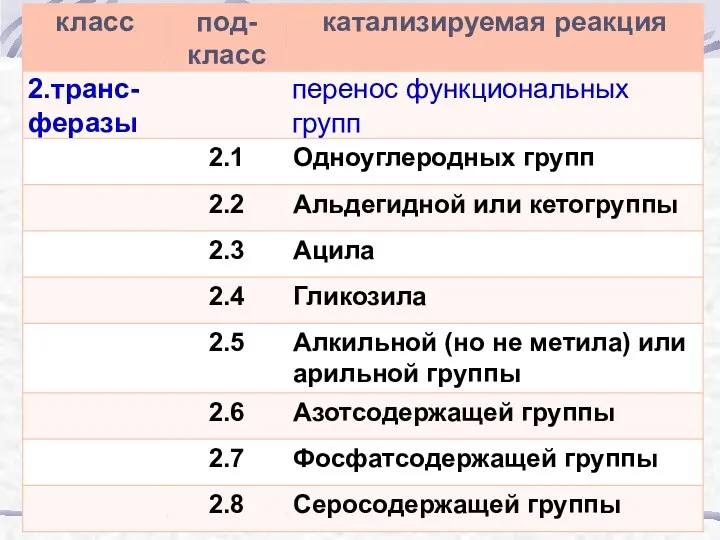
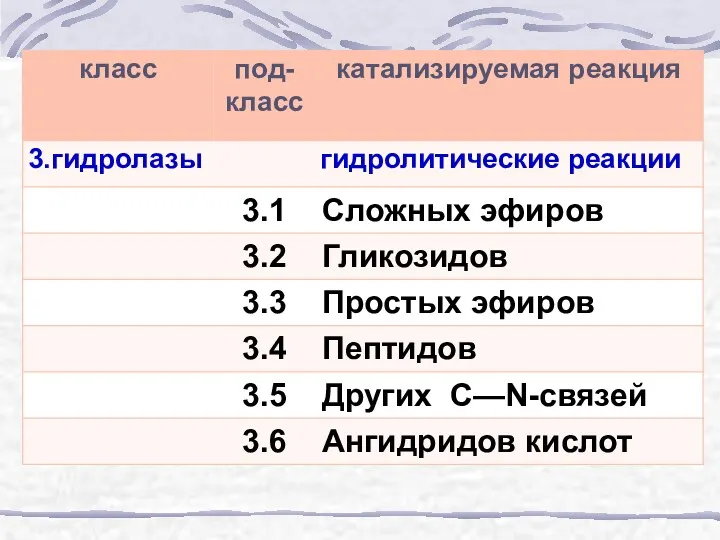
- 52. Классификация ферментов 1. Оксидоредуктазы 2. Трансферазы 3. Гидролазы
- 53. 4. Лиазы 5. Изомеразы 6. Лигазы (синтетазы)
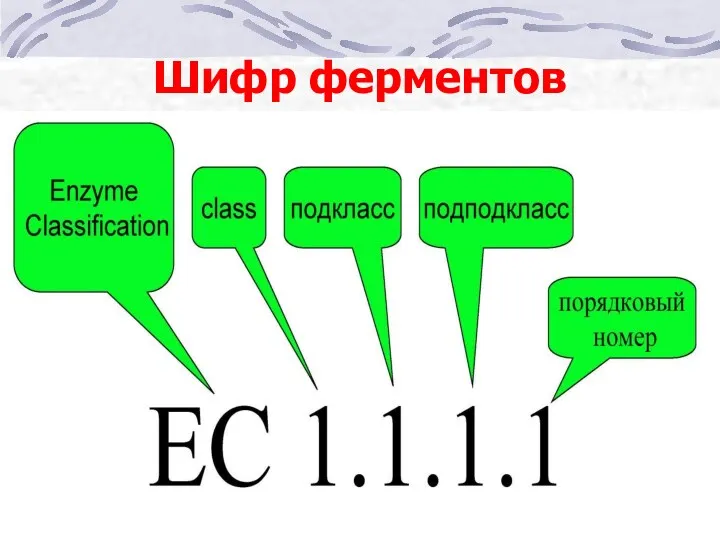
- 57. Шифр ферментов
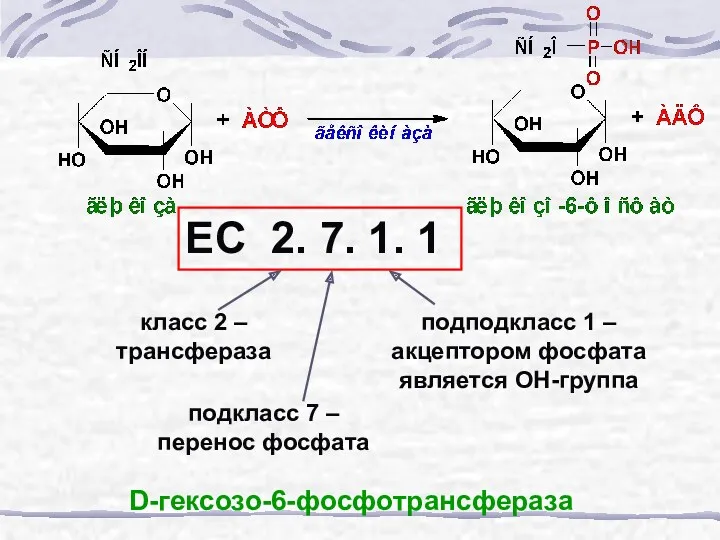
- 58. ЕС 2. 7. 1. 1 класс 2 – трансфераза подкласс 7 – перенос фосфата подподкласс 1
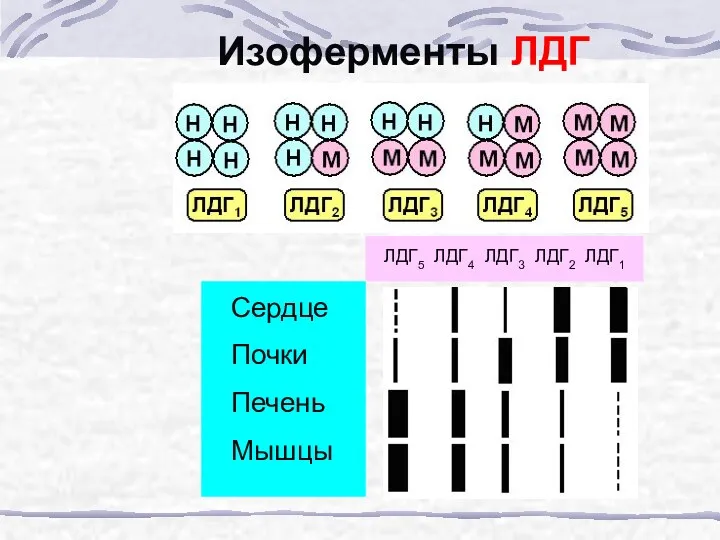
- 59. Изоферменты ЛДГ Сердце Почки Печень Мышцы ЛДГ5 ЛДГ4 ЛДГ3 ЛДГ2 ЛДГ1
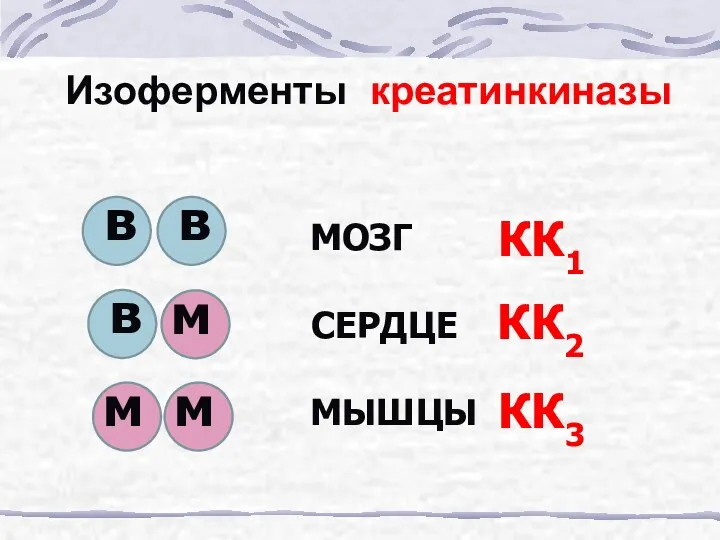
- 60. Изоферменты креатинкиназы в в в м м м МОЗГ СЕРДЦЕ МЫШЦЫ КК1 КК2 КК3
- 61. Единицы измерения количества и активности фермента 1 мкмоль превращенного S 1 мин 1МЕ =
- 62. nМЕ – количество единиц активности Кол-во превращенного S (мкмоль) nМЕ = Время (мин)
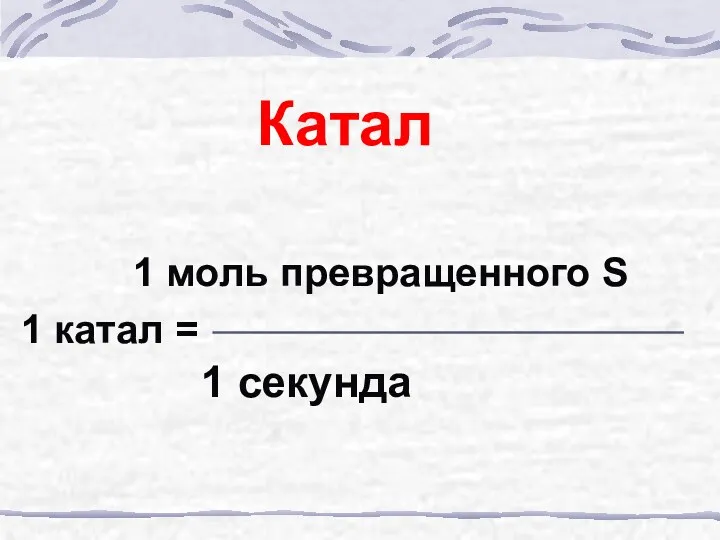
- 63. Катал 1 моль превращенного S 1 катал = 1 секунда
- 65. Скачать презентацию

























 Редкие виды растений в искусственных лесных насаждениях рядом с садоводческим товариществом Виктория
Редкие виды растений в искусственных лесных насаждениях рядом с садоводческим товариществом Виктория Методы изучения биологического круговорота веществ в фитоценозах
Методы изучения биологического круговорота веществ в фитоценозах Сахарозаменители. Натуральные сахарозаменители
Сахарозаменители. Натуральные сахарозаменители Қызынаққа зиян келтіретін бунақденелердің таралуы, биологиясы, зияндылығы және қолданатын күресу шаралар жүйесі
Қызынаққа зиян келтіретін бунақденелердің таралуы, биологиясы, зияндылығы және қолданатын күресу шаралар жүйесі Органы выделения у человека
Органы выделения у человека Животные. Простейшие
Животные. Простейшие Состав популяций
Состав популяций Итоговая контрольная работа. 6 класс
Итоговая контрольная работа. 6 класс Биотехнологическое производство сыра
Биотехнологическое производство сыра Слуховая сенсорная система
Слуховая сенсорная система Органы растений. Рост, развитие и размножение растений. Цветок
Органы растений. Рост, развитие и размножение растений. Цветок Адамның рефлекторлық реакциясын зерттеу
Адамның рефлекторлық реакциясын зерттеу Анатомия стебля растения
Анатомия стебля растения Животные холодных и жарких стран
Животные холодных и жарких стран Земледелие. Введение
Земледелие. Введение Хижі птахи
Хижі птахи Органеллы. Строение клеток эукариот
Органеллы. Строение клеток эукариот Презентация: Роль бактерий в природе и жизни человека.
Презентация: Роль бактерий в природе и жизни человека. Тест Полезные ископаемые (для 6 класса коррекционной школы 8 вида)
Тест Полезные ископаемые (для 6 класса коррекционной школы 8 вида) Движение крови по сосудам
Движение крови по сосудам Влажность воздуха
Влажность воздуха Бауырдың биохимиясы
Бауырдың биохимиясы Репликация ДНК
Репликация ДНК Митоздың биологиялық маңызы
Митоздың биологиялық маңызы Парнокопытные и непарнокопытные животные
Парнокопытные и непарнокопытные животные Гербициттер микология
Гербициттер микология Предмет и задачи цитологии
Предмет и задачи цитологии Тест. Поджелудочна железа
Тест. Поджелудочна железа