Содержание
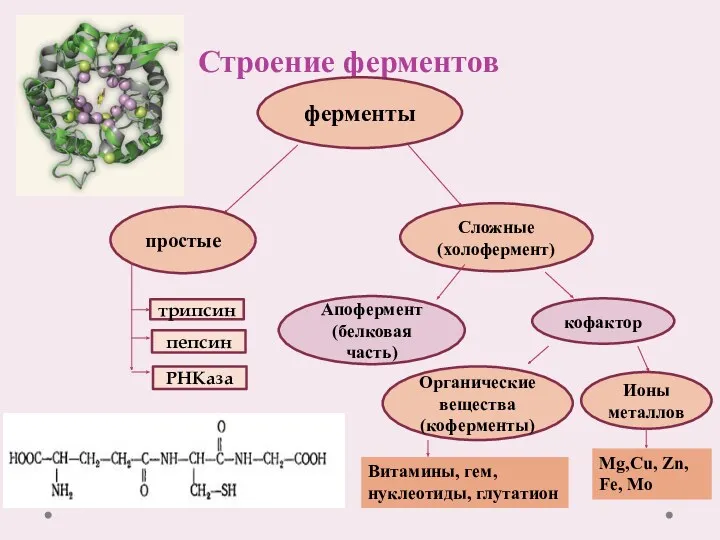
- 3. Строение ферментов ферменты простые Сложные (холофермент) трипсин пепсин РНКаза Апофермент (белковая часть) кофактор Органические вещества (коферменты)
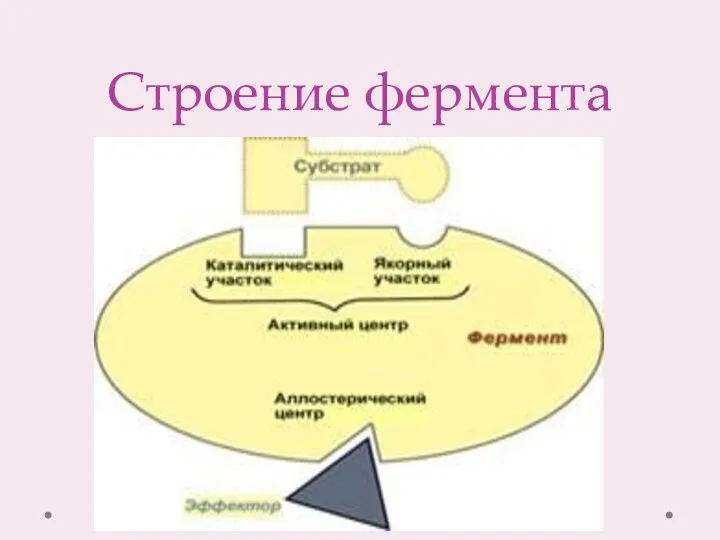
- 4. Строение фермента
- 5. Механизм действия ферментов Образование фермент-субстратного комплекса по принципу комплементарности (теория Фишера «ключ-замок»). 2.Дестабилизация связей в молекуле
- 6. Классификация ферментов 1. По химическому строению Простые и сложные 2. По специфичности – субстратная и специфичность
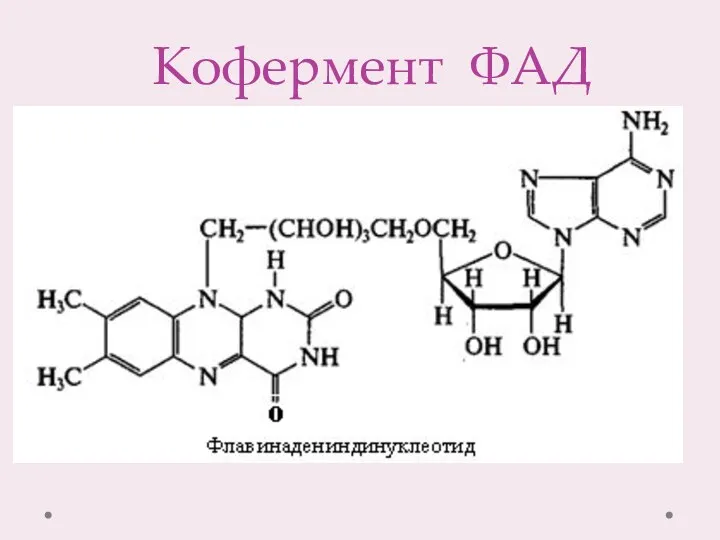
- 7. Кофермент ФАД
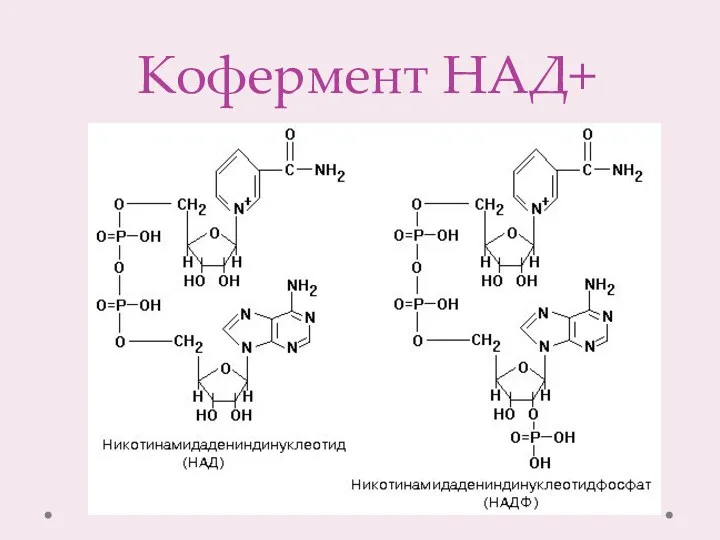
- 8. Кофермент НАД+
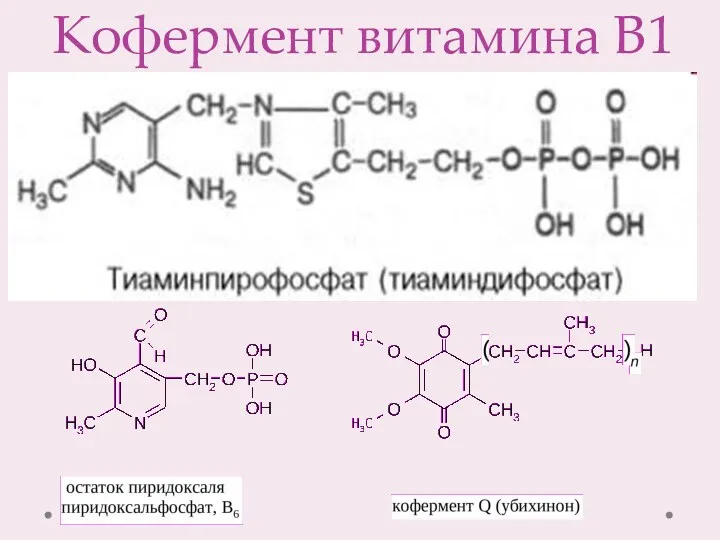
- 9. Кофермент витамина В1
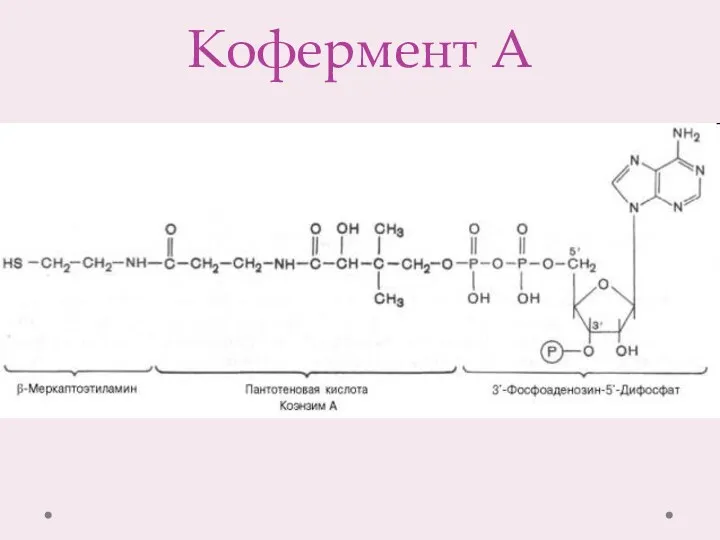
- 10. Кофермент А
- 11. Свойства ферментов Как и белки имеют первичную, вторичную, третичную, четвертичную структуру, изоэлектрическую точку, способность к денатурации.
- 12. Активность ферментов Активность ферментов – это наличие и количество ферментов в крови и биологических жидкостях (энзимодиагностика).
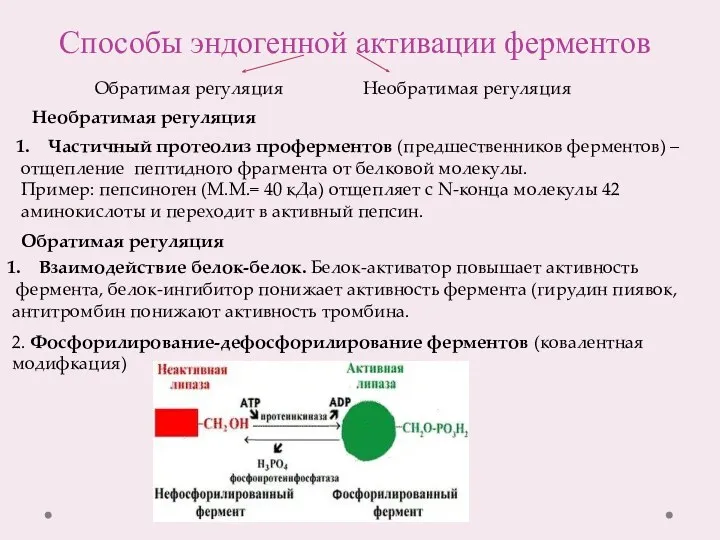
- 13. Способы эндогенной активации ферментов Частичный протеолиз проферментов (предшественников ферментов) – отщепление пептидного фрагмента от белковой молекулы.
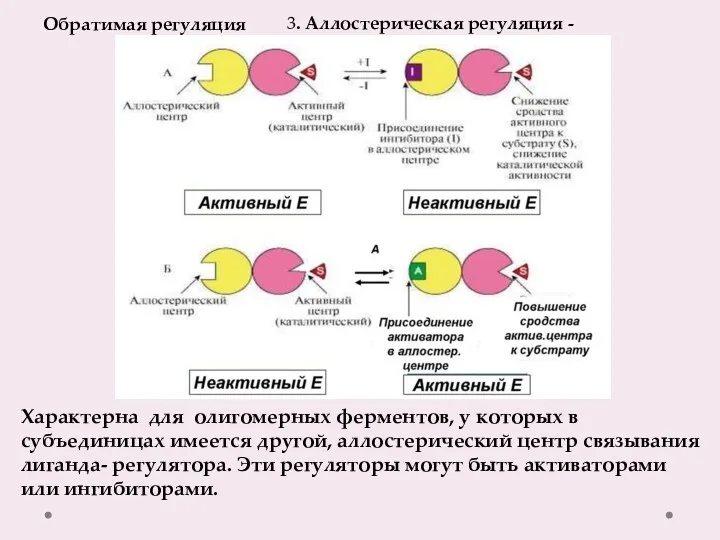
- 14. Обратимая регуляция 3. Аллостерическая регуляция - Характерна для олигомерных ферментов, у которых в субъединицах имеется другой,
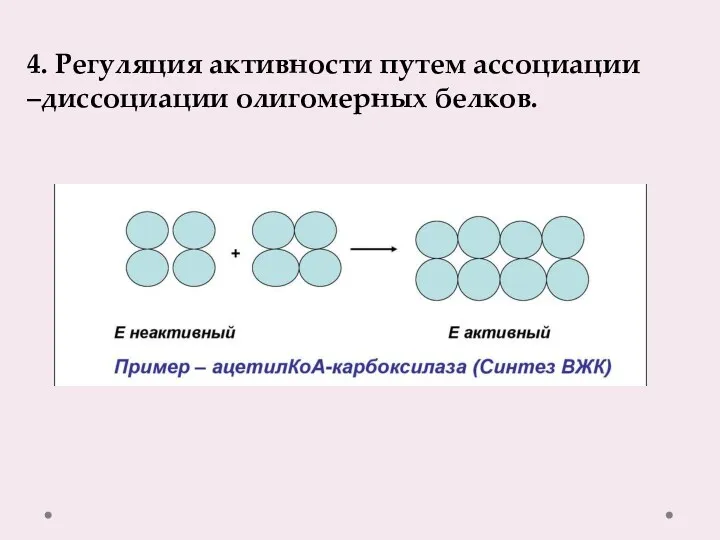
- 15. 4. Регуляция активности путем ассоциации –диссоциации олигомерных белков.
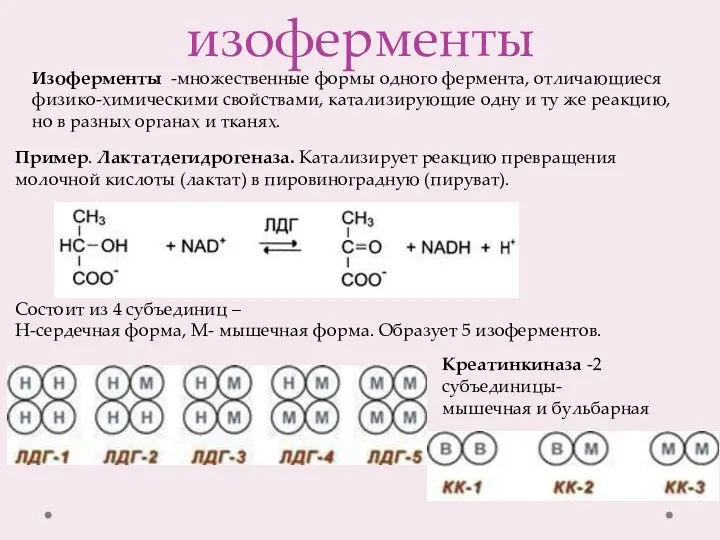
- 16. изоферменты Изоферменты -множественные формы одного фермента, отличающиеся физико-химическими свойствами, катализирующие одну и ту же реакцию, но
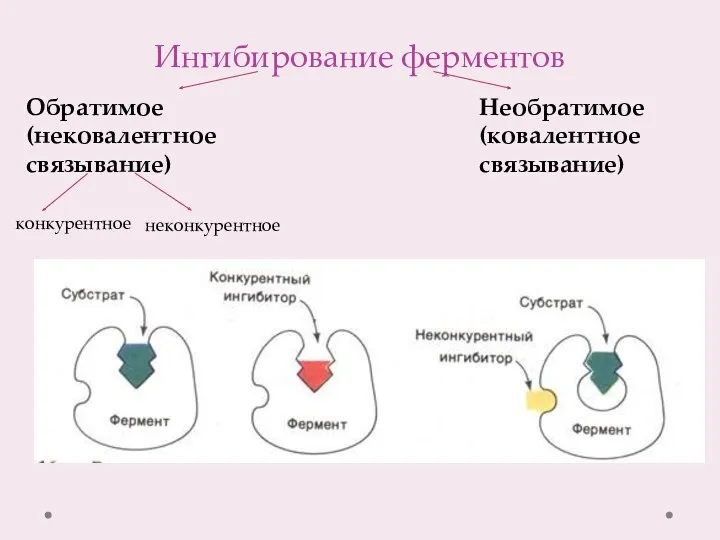
- 17. Ингибирование ферментов Обратимое (нековалентное связывание) Необратимое (ковалентное связывание) конкурентное неконкурентное
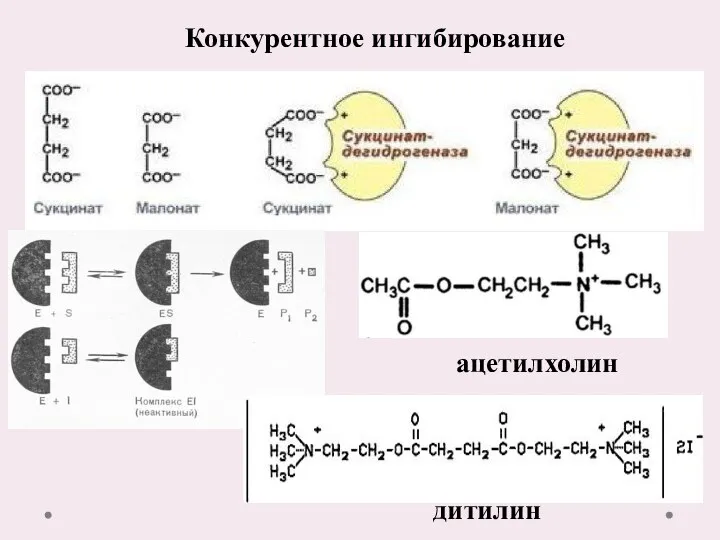
- 18. Конкурентное ингибирование дитилин ацетилхолин
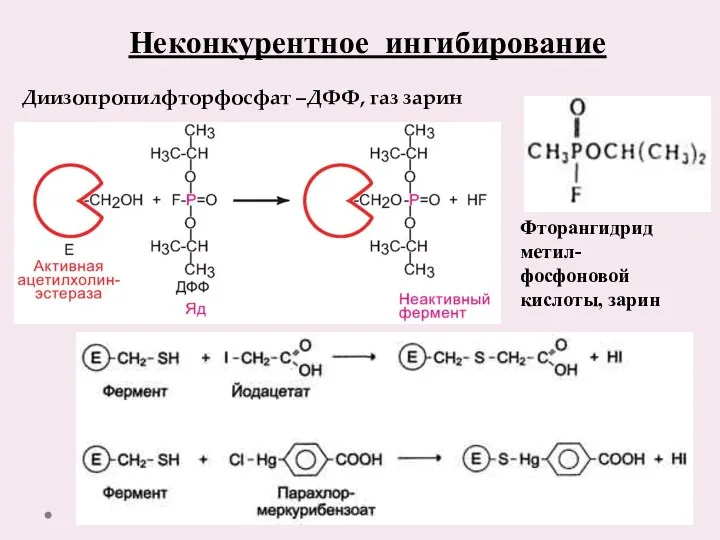
- 19. Неконкурентное ингибирование Диизопропилфторфосфат –ДФФ, газ зарин Фторангидрид метил- фосфоновой кислоты, зарин
- 20. Иммобилизованные ферменты Иммобилизованными называются ферменты, искусственно связанные с нерастворимым носителем, с полным или частичным ограничением свободы
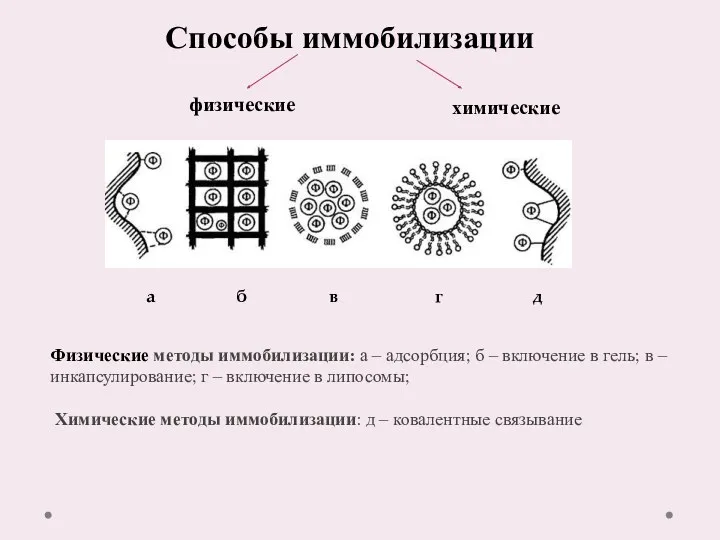
- 21. Способы иммобилизации физические химические Физические методы иммобилизации: а – адсорбция; б – включение в гель; в
- 23. Скачать презентацию






 Плесневые грибы
Плесневые грибы Автоматизированная гидропонная система периодического затопления
Автоматизированная гидропонная система периодического затопления Класс двудольные, семейство крестоцветные
Класс двудольные, семейство крестоцветные Презентация Хвощи, плауны, папоротники.
Презентация Хвощи, плауны, папоротники. Вирусы
Вирусы Общие представления о жизни. Уровни организации жизни. Организм. Признаки живых организмов
Общие представления о жизни. Уровни организации жизни. Организм. Признаки живых организмов Дикие и домашние животные
Дикие и домашние животные Pielea, organ tactil, termic, dureros și de presiune. (Lectie 11)
Pielea, organ tactil, termic, dureros și de presiune. (Lectie 11) Зимующие птицы
Зимующие птицы Строение вирусов. Жизненные циклы вирусов,
Строение вирусов. Жизненные циклы вирусов, Генетика популяции
Генетика популяции Эволюция кровеносной системы животных
Эволюция кровеносной системы животных Посевные качества семян
Посевные качества семян Метаболизм
Метаболизм Лесные опасности
Лесные опасности Презентация Исследование взаимосвязи здоровья человека и экологического состояния его жилья.
Презентация Исследование взаимосвязи здоровья человека и экологического состояния его жилья. Растительный мир Рязанской области
Растительный мир Рязанской области Водоросли. Разнообразие водорослей
Водоросли. Разнообразие водорослей Селекция растений
Селекция растений Tissues: group of cells that are similar in structure and function
Tissues: group of cells that are similar in structure and function Endangered species of lions
Endangered species of lions Үсемлек белән тукланучы һәм ерткыч хайваннар
Үсемлек белән тукланучы һәм ерткыч хайваннар Животные на службе у человека
Животные на службе у человека Физиология анализаторов
Физиология анализаторов Покрытосеменные или цветковые растения. 6 класс
Покрытосеменные или цветковые растения. 6 класс презентация по биологии на тему Строение и функции клеток для 9 класса
презентация по биологии на тему Строение и функции клеток для 9 класса Отделы головного мозга
Отделы головного мозга Незаменимые аминокислоты
Незаменимые аминокислоты