Содержание
- 2. Биохимия – образно говоря, наука о жизни. И очень важно, что основные химические вещества и важные
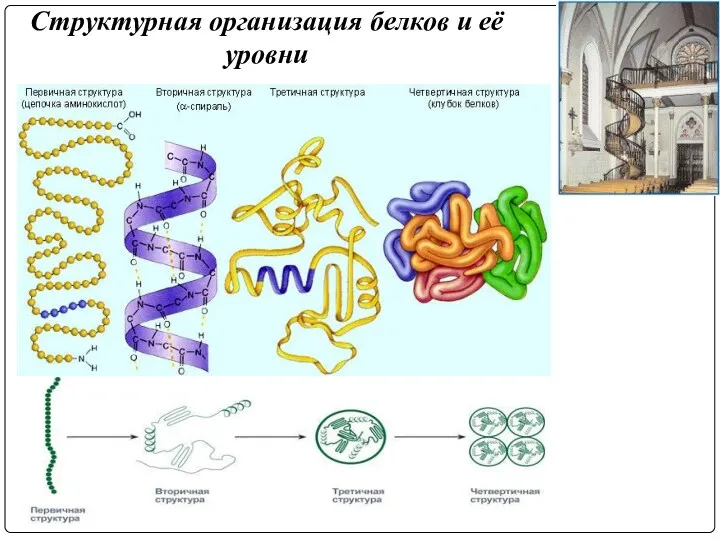
- 3. Структурная организация белков и её уровни
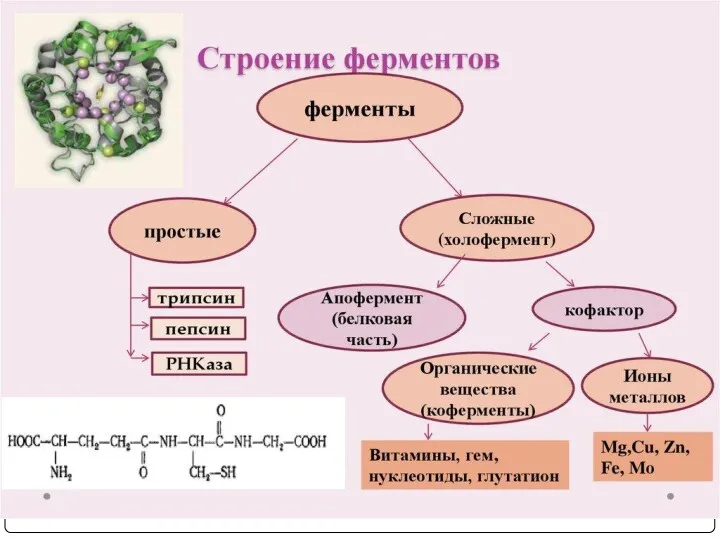
- 4. ФЕРМЕНТЫ или энзимы (Е) - биокатализаторы белковой природы, ускоряющие реакции в клетке. Лат. Fermentum –закваска, а
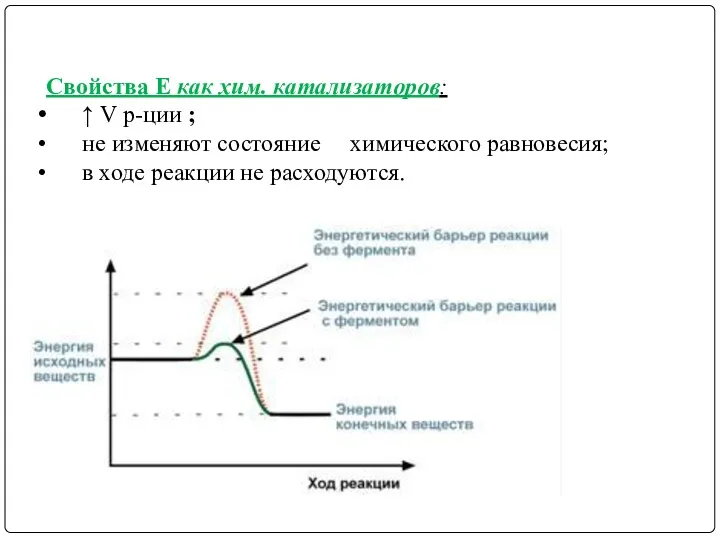
- 5. Свойства Е как хим. катализаторов: ↑ V р-ции ; не изменяют состояние химического равновесия; в ходе
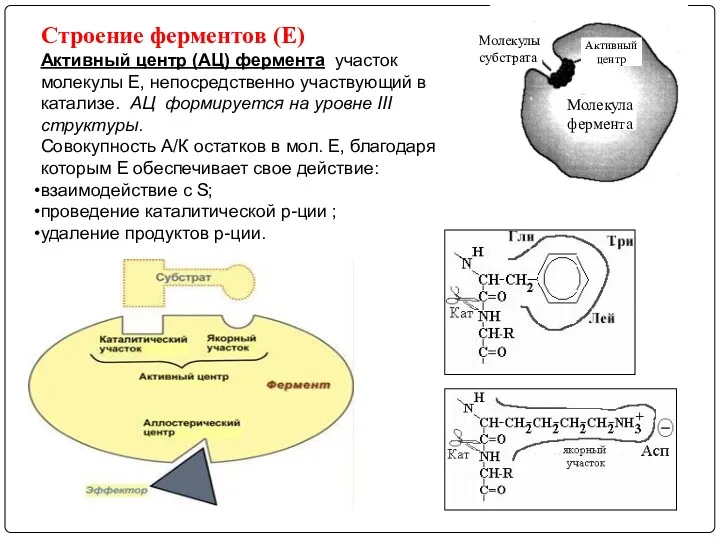
- 7. Строение ферментов (Е) Активный центр (АЦ) фермента участок молекулы Е, непосредственно участвующий в катализе. АЦ формируется
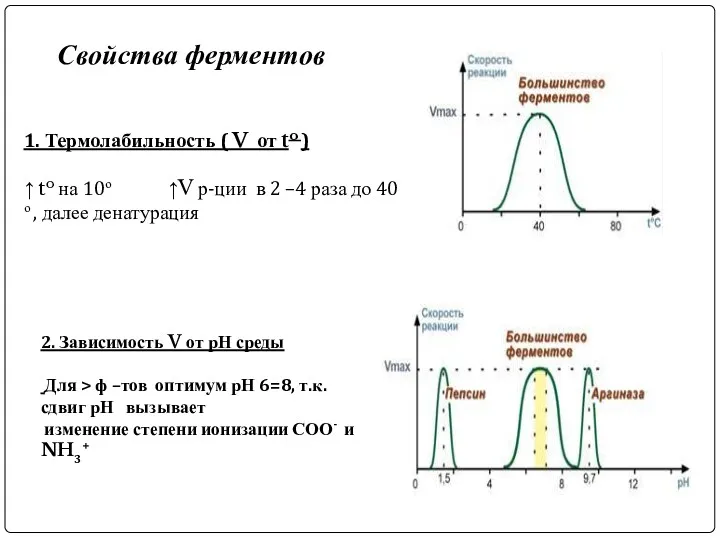
- 8. Свойства ферментов 1. Термолабильность ( V от to ) ↑ to на 10о ↑V р-ции в
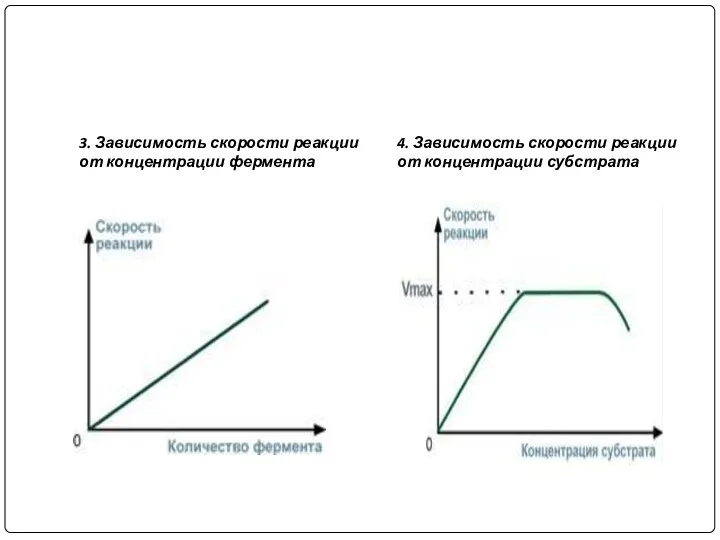
- 9. 3. Зависимость скорости реакции от концентрации фермента 4. Зависимость скорости реакции от концентрации субстрата
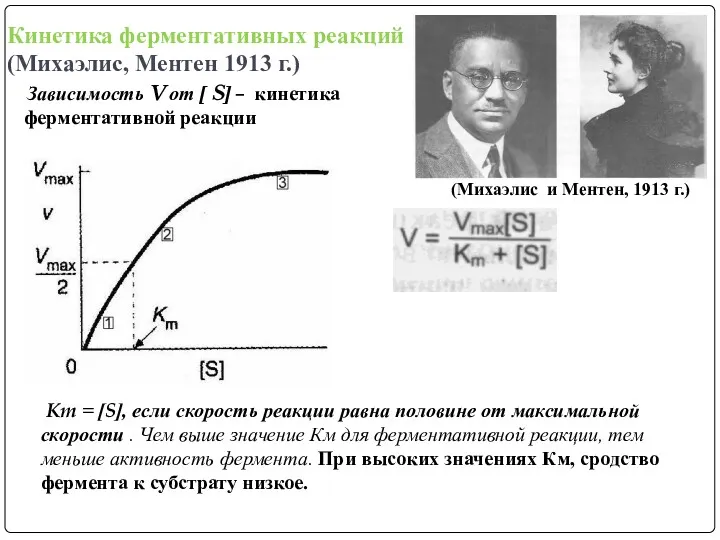
- 10. Кинетика ферментативных реакций (Михаэлис, Ментен 1913 г.) Зависимость V от [ S] – кинетика ферментативной реакции
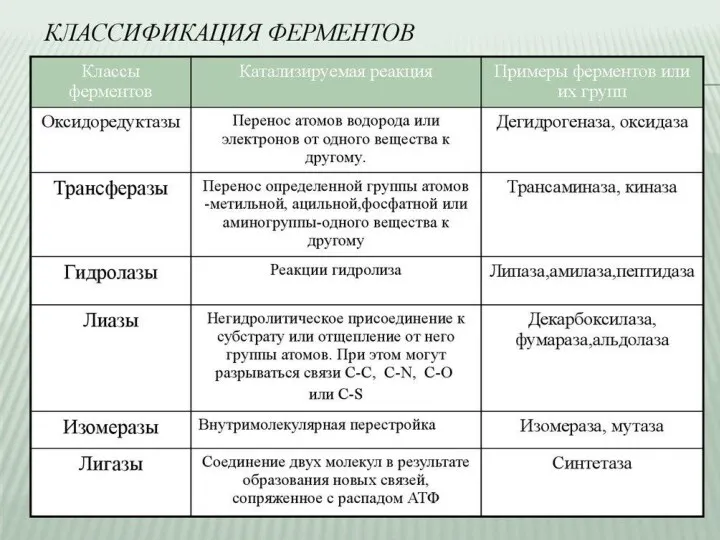
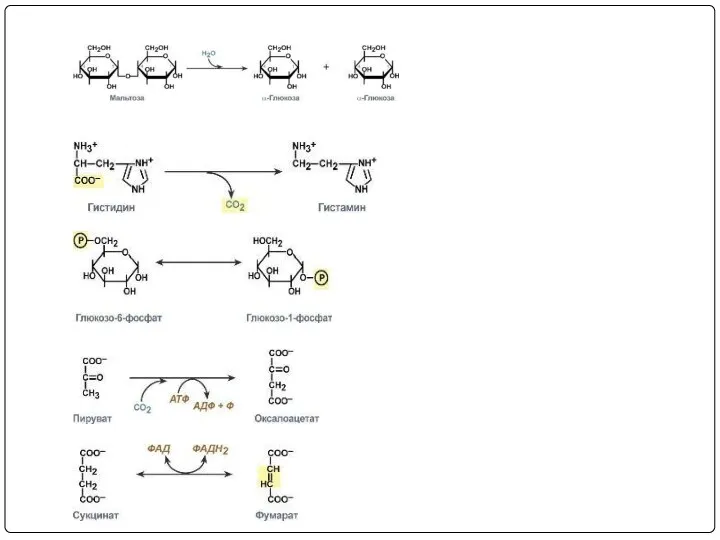
- 11. Классификация Е В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В
- 13. Название Е 1. Систематическое название – согласно современной классификации. Часто такое название длинно и сложно для
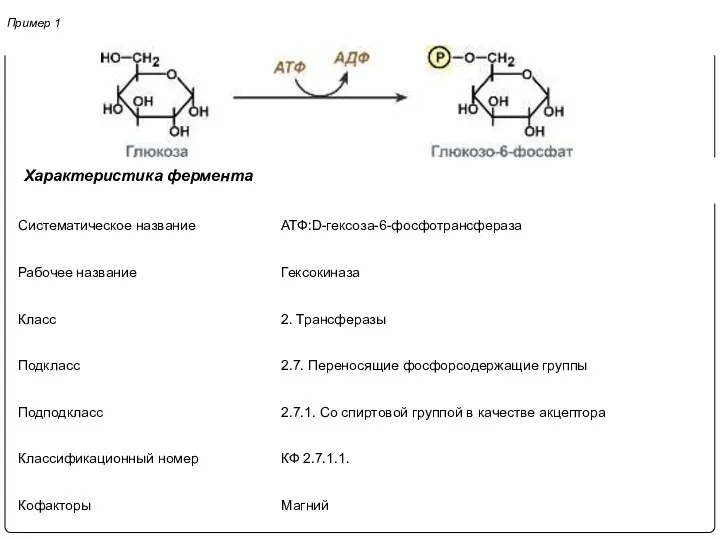
- 14. Пример 1 Характеристика фермента
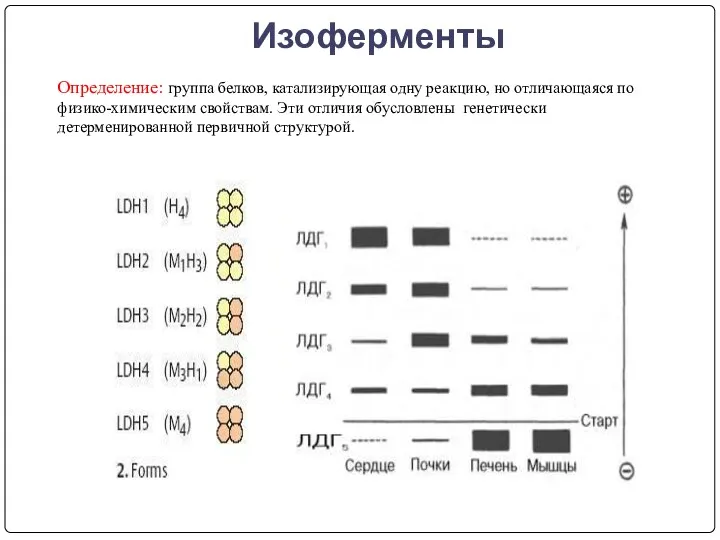
- 16. Изоферменты Определение: группа белков, катализирующая одну реакцию, но отличающаяся по физико-химическим свойствам. Эти отличия обусловлены генетически
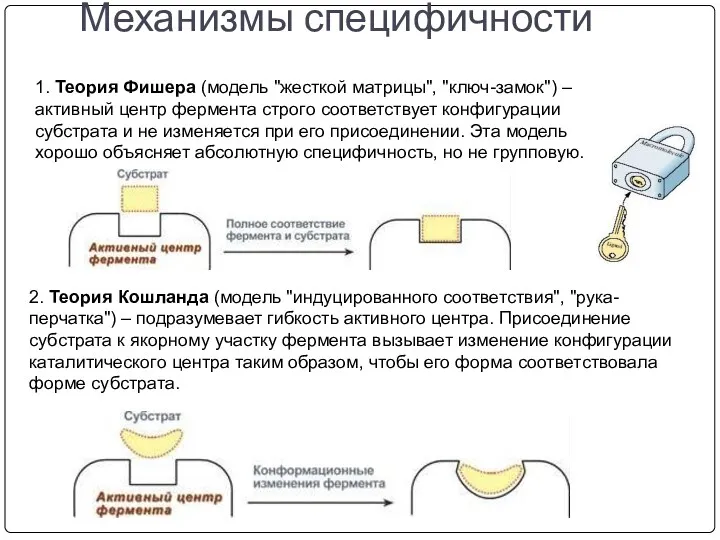
- 17. Ферменты проявляют специфичность Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного
- 18. 1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и
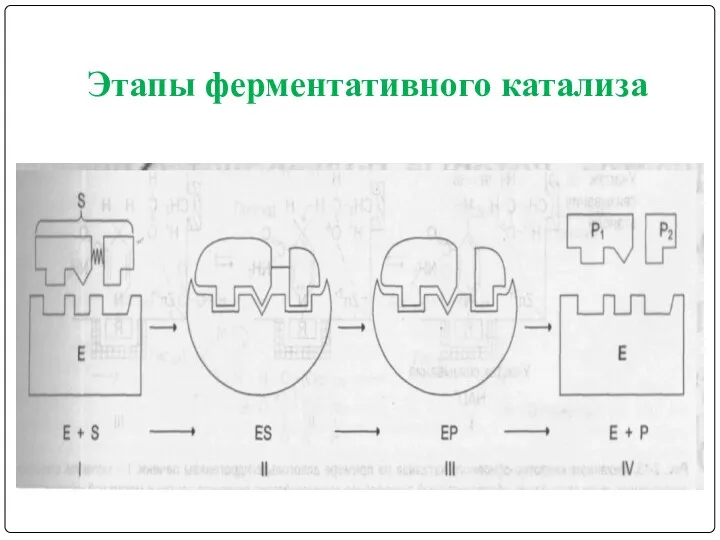
- 19. Этапы ферментативного катализа
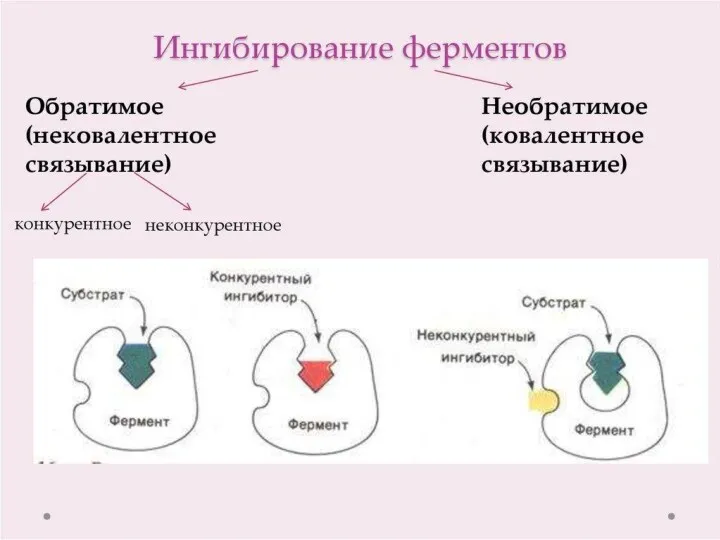
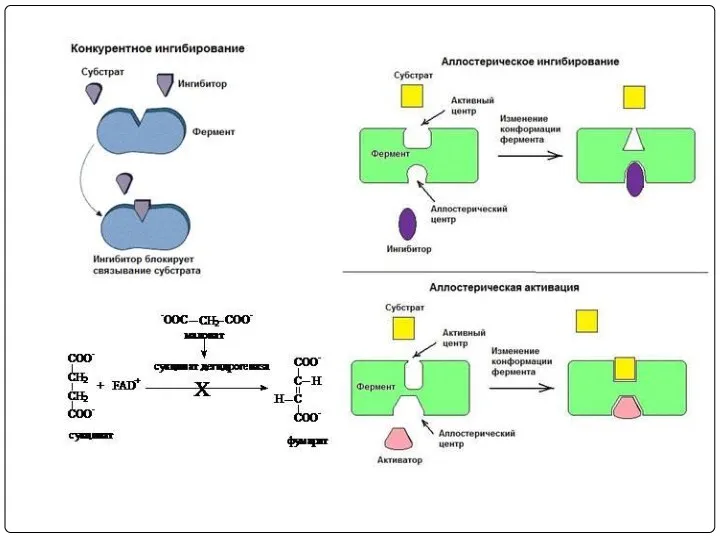
- 20. Регуляция активности ферментов Доступность субстрата или кофермента Изменение количества хотя бы одного из субстратов прекращает или
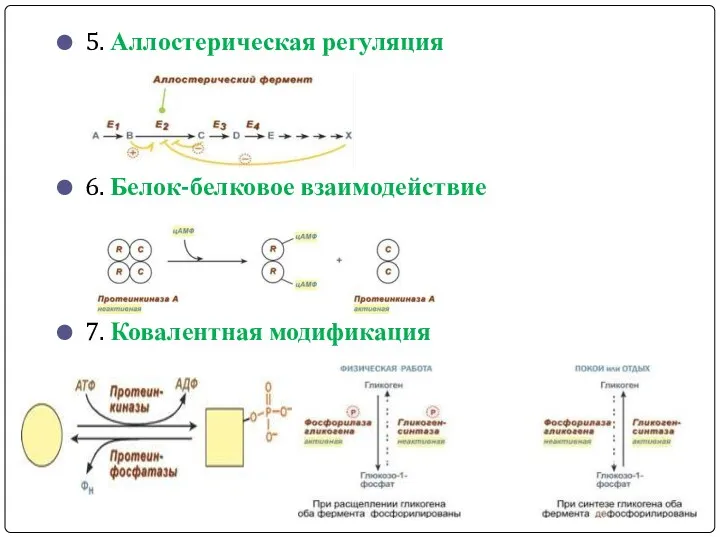
- 21. 5. Аллостерическая регуляция 6. Белок-белковое взаимодействие 7. Ковалентная модификация
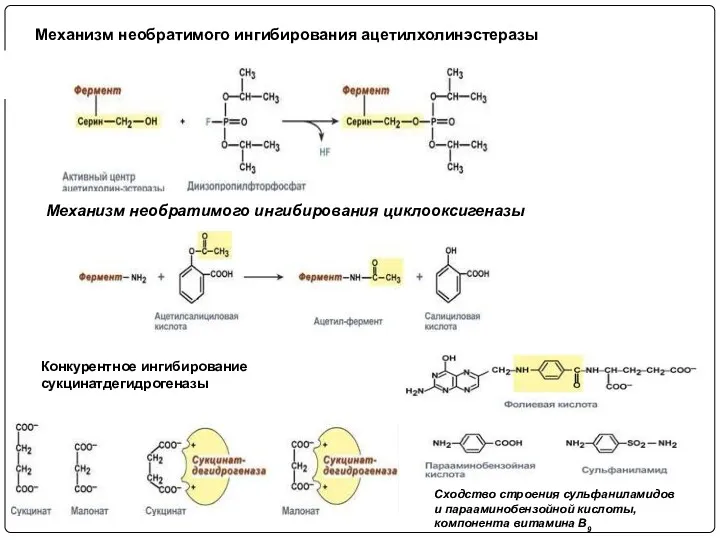
- 24. Механизм необратимого ингибирования ацетилхолинэстеразы Механизм необратимого ингибирования циклооксигеназы Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина
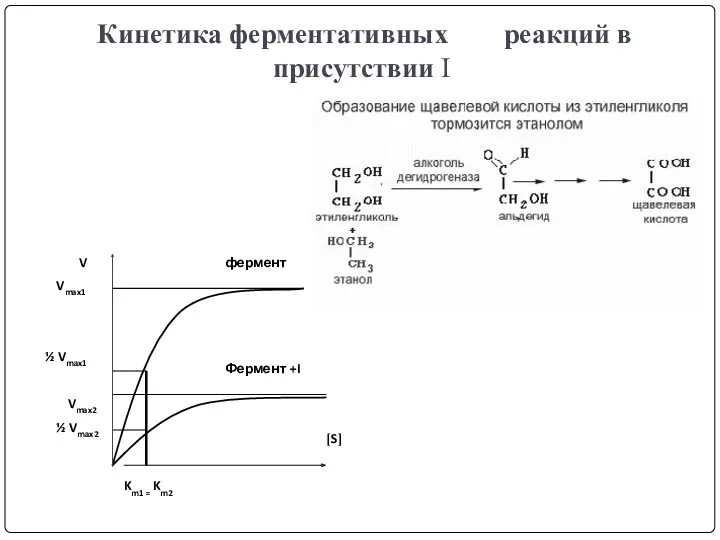
- 25. Кинетика ферментативных реакций в присутствии I
- 26. Ферменты в медицине: энзимодиагностика заболеваний; лечение: комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал
- 27. Использование ферментов в медицине происходит по четырем направлениям: энзимодиагностика, энзимотерапия, использование ферментов в медицинских технологиях и
- 28. Энзимотерапия Энзимотерапия – это использование ферментов в качестве лекарственных средств. Самыми распространенными ферментативными препаратами являются комплексы
- 30. Скачать презентацию









 Учёные, внёсшие вклад в развитие биологии с античности до наших дней
Учёные, внёсшие вклад в развитие биологии с античности до наших дней Отработка заданий части В и С ОГЭ. Биология 9 класс
Отработка заданий части В и С ОГЭ. Биология 9 класс Перелетные птицы весной. II младшая группа
Перелетные птицы весной. II младшая группа Скелет головы и туловища
Скелет головы и туловища Филэмбриогенез. Эволюционные преобразования
Филэмбриогенез. Эволюционные преобразования Клеточная теория
Клеточная теория Тип молюски. Клас двостулкові
Тип молюски. Клас двостулкові Природоохрана и защита живой природы
Природоохрана и защита живой природы Урок биологии 9 класс Звёздный час – Человек
Урок биологии 9 класс Звёздный час – Человек Задания ЕГЭ по биологии теме Формы достижения биологического прогресса
Задания ЕГЭ по биологии теме Формы достижения биологического прогресса Азотное питание растений
Азотное питание растений Разнообразие животных
Разнообразие животных Мужской ликбез. Все об уходе за внешностью
Мужской ликбез. Все об уходе за внешностью Пищеварительные железы
Пищеварительные железы Заочная экологическая викторина Чудо в перьях, 1 класс
Заочная экологическая викторина Чудо в перьях, 1 класс Класс Птицы
Класс Птицы Отруйнi гриби
Отруйнi гриби Движение крови по сосудам. Большой и малый круги кровообращения. 8 класс
Движение крови по сосудам. Большой и малый круги кровообращения. 8 класс Ткани растений
Ткани растений Химический состав клетки - технологическая карта урока.
Химический состав клетки - технологическая карта урока. Пропорции выражают характер. Птицы с разным характером пропорций
Пропорции выражают характер. Птицы с разным характером пропорций Предмет і завдання мікробіології. Основні етапи розвитку. Систематика номенклатура і класифікація мікроорганізмів
Предмет і завдання мікробіології. Основні етапи розвитку. Систематика номенклатура і класифікація мікроорганізмів Сезонные изменения в жизни организмов
Сезонные изменения в жизни организмов Анатомия глаза. Веки
Анатомия глаза. Веки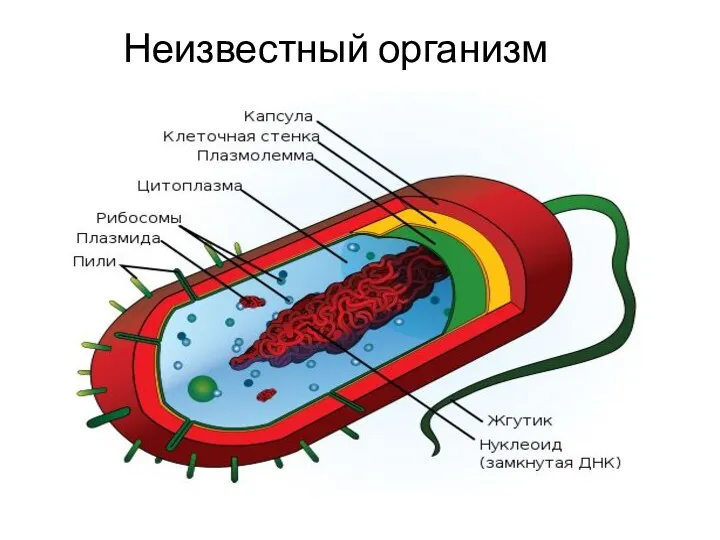 Бактерии. Строение бактериальной клетки. Формы бактерий. Распространение и условия обитания
Бактерии. Строение бактериальной клетки. Формы бактерий. Распространение и условия обитания Протерозойская эра
Протерозойская эра Клеточный сигналинг
Клеточный сигналинг Отряд Непарнокопытные
Отряд Непарнокопытные