Содержание
- 2. Ферменты / энзимы – особый класс белков, являющихся биологическими катализаторами.
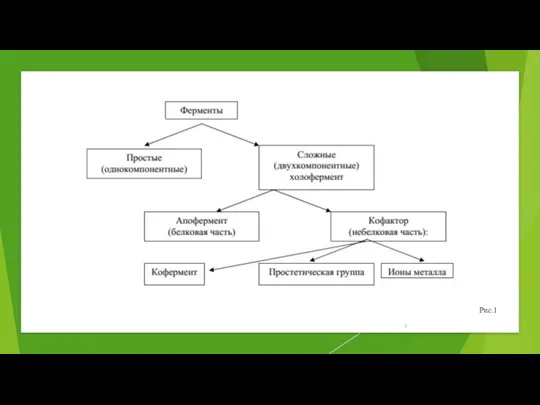
- 3. Рис.1
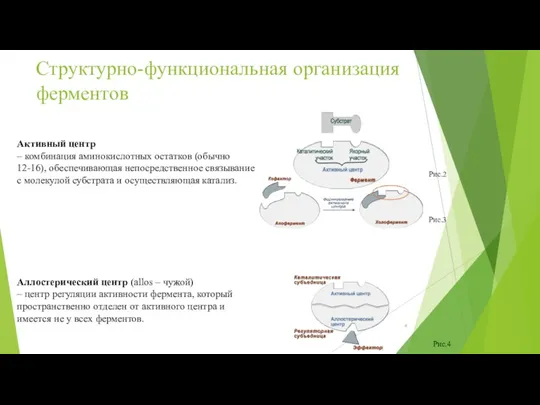
- 4. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая
- 5. Соответствие фермента и субстрата: 1 — гипотеза «ключ – замок»; 2 — гипотеза «рука - перчатка».
- 6. Изоферменты креатинкиназы Строение мульферментного комплекса Рис.9 Рис.8
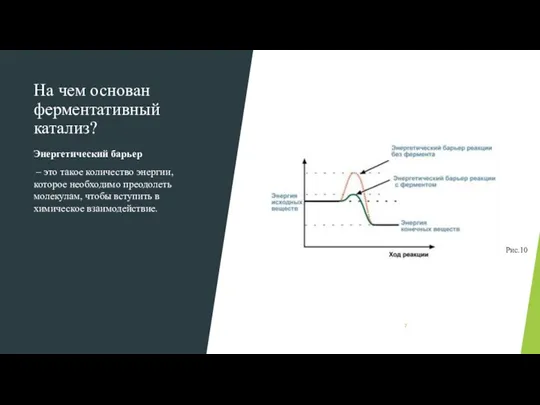
- 7. На чем основан ферментативный катализ? Энергетический барьер – это такое количество энергии, которое необходимо преодолеть молекулам,
- 8. Сущность ферментов / неорганических катализаторов: в активации молекул реагирующих веществ, в разбиении реакции на несколько стадий,
- 9. Особенности ферментативного катализа Этапы катализа: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса
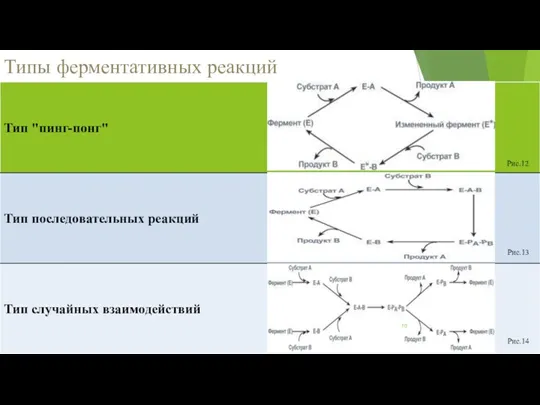
- 10. Типы ферментативных реакций Рис.14 Рис.13 Рис.12
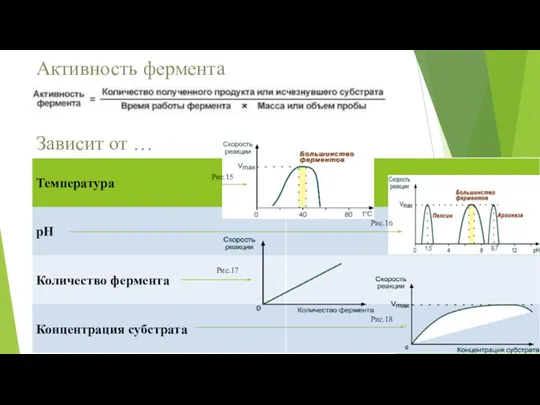
- 11. Активность фермента Зависит от … Рис.17 Рис.15 Рис.18 Рис.16
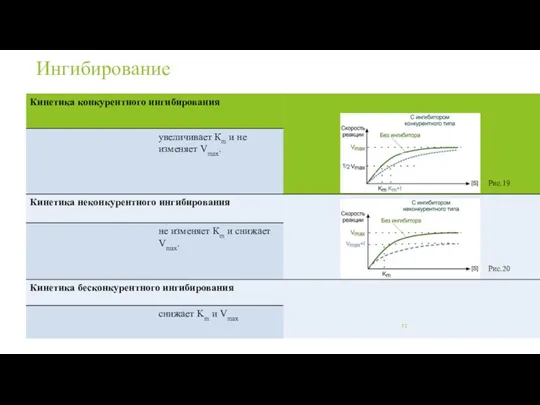
- 12. Ингибирование Рис.20 Рис.19
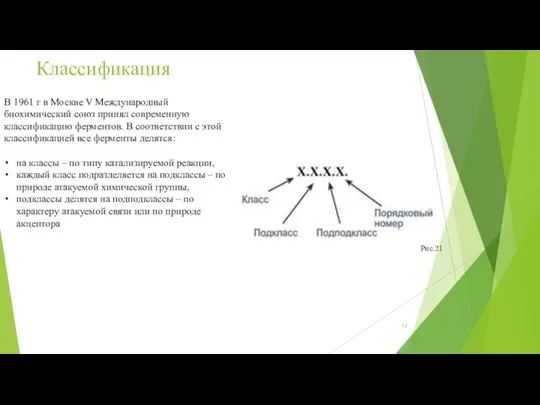
- 13. Классификация В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В соответствии
- 16. Скачать презентацию





 Северцов Николай Алексеевич. Биография.
Северцов Николай Алексеевич. Биография. Внутрішня будова птахів
Внутрішня будова птахів Введение в миологию
Введение в миологию Общие представления о жизни. Уровни организации жизни. Организм. Признаки живых организмов
Общие представления о жизни. Уровни организации жизни. Организм. Признаки живых организмов Компоненты центральной нервной системы
Компоненты центральной нервной системы Дыхательная функция крови
Дыхательная функция крови Царство Растения. Высшие семенные растения. Покрытосеменные ( = цветковые)
Царство Растения. Высшие семенные растения. Покрытосеменные ( = цветковые) Породы кошек и собак
Породы кошек и собак Экологический урок: Культура обращения с отходами, раздельный сбор отходов в 2014 году
Экологический урок: Культура обращения с отходами, раздельный сбор отходов в 2014 году Первая помощь при растяжении связок, вывихах суставов, переломах костей
Первая помощь при растяжении связок, вывихах суставов, переломах костей Загадки о животных и растениях (2 класс)
Загадки о животных и растениях (2 класс) Животные Южной Америки
Животные Южной Америки презентация к уроку Голосеменные растения
презентация к уроку Голосеменные растения Введение в высокопроизводительное секвенирование
Введение в высокопроизводительное секвенирование Морфология и ультраструктура бактерий
Морфология и ультраструктура бактерий Анатомия и физиология зрительного анализатора
Анатомия и физиология зрительного анализатора Биотехнология, клеточная и генная инженерия. Клонирование
Биотехнология, клеточная и генная инженерия. Клонирование Мастерская Зелёная лаборатория
Мастерская Зелёная лаборатория Опорно-двигательная система
Опорно-двигательная система Анимированный кроссворд Насекомые
Анимированный кроссворд Насекомые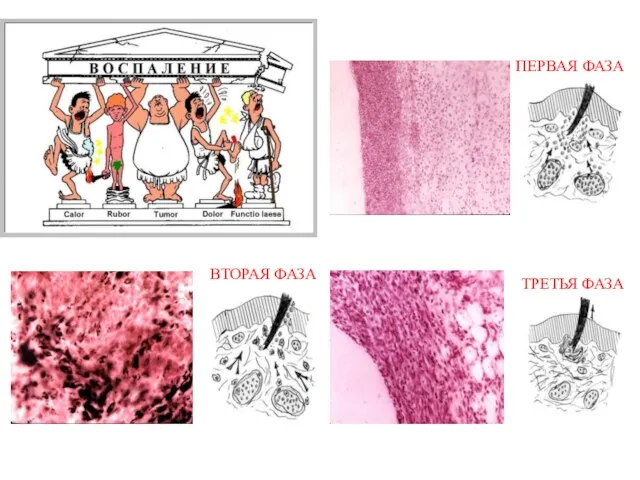 Стадии воспалительной реакции. Скелетные ткани
Стадии воспалительной реакции. Скелетные ткани ГМО в нашей жизни
ГМО в нашей жизни Место человека в системе органического мира
Место человека в системе органического мира Доказательтва животного происхождения человека. Антропология
Доказательтва животного происхождения человека. Антропология Сравнительная характеристика царств живой природы
Сравнительная характеристика царств живой природы Классификация пестицидов. (Лекция 2)
Классификация пестицидов. (Лекция 2) Царство грибы
Царство грибы Основные понятия генетики
Основные понятия генетики