Содержание
- 2. № 1 дәріс Гендік инженерияға кіріспе. Жоспары І. Гендік инженерия ғылымының даму тарихы ІІ. Гендік инженерия
- 3. Ген инженериясы молекулалық биологияның жаңа саласы. Ол лабораториялық әдіс арқылы генетикалық жүйелер мен тұқымы өзгерген организмдерді
- 4. І. Гендік инженерия ғылымының даму тарихы Ген инженериясының дүниеге келген уақыты 1972 ж. деп есептеледі. Сол
- 5. І. Гендік инженерия ғылымының даму тарихы 1945-1950 ж.ж. Бірінші рет жануарлар жасушаларының культуралары өсірілді. XX ғ.
- 6. І. Гендік инженерия ғылымының даму тарихы 1990 ж. Адамның генетикалық картасын құрастыру үшін халықаралық проект бастау
- 7. ІІ. Ген инженериясы шешетін мәселелер: 1) генді химиялық немесе ферментті қолдану жолымен синтездеу; 2) әр түрлі
- 8. ІІІ. Гендік инженерия пәнінің әдістері Ген инженериясында генді мынадай әдістермен алуға болады: клеткадағы ДНҚ-дан тікелей кесіп
- 9. ІІІ. Гендік инженерия пәнінің әдістері 2. Химиялық жолмен жасанды генді 1969 жылы Г. Корана синтездеген. Бірақ
- 10. ІІІ. Гендік инженерия пәнінің әдістері 3. Жасанды әдіспен генді ферменттік синтезге сүйене отырып, кері транскрипция механизмнің
- 11. № 2 дәріс Гендік инженерияда қолданылатын ферменттер. Жоспары І. Ферменттер класификациясы. ІІ. Рестриктазалар ІІІ. ДНК-лигаза ІV.
- 12. І. Ферменттер класификациясы. Гендік инженерия молекулалық генетикадан бастау алады, бірақ өзінің пайда болуымен генетикалық энзимология мен
- 13. ІІ. Рестриктазалар Рестрикция эндонулеазалары, рестриктазалар (лат. restrictio — шектеу) — Гидролаза классына жататы ферметтер тобы, нуклеин
- 14. ІІ. Рестриктазалар Рестрикция – белгілі бір тізбекте нуклеотиддтер қатарын танып 2 тізбекті ДНҚ-ны бөлшектерге кесу. Осы
- 15. ІІ. Рестриктазалар 1973 ж Смит және Натанс рестриктазалардын номенглатурасын ұсынды, ол келесі тармақтардан тұрды : Әр
- 16. ІІ. Рестриктазалар Жаңа рестриктазалардың ашылуына байланысты, 1978 ж Робертс номенглатураға өзгерістер енгізді: егер қысқартулар бірнеше фермент
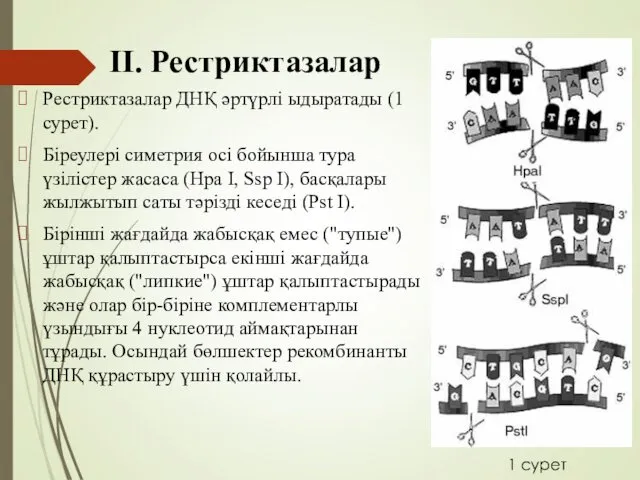
- 17. ІІ. Рестриктазалар Рестриктазалар ДНҚ әртүрлі ыдыратады (1 сурет). Біреулері симетрия осі бойынша тура үзілістер жасаса (Hpa
- 18. ІІ. Рестриктазалар Рестриктазаларды 3 негізгі классқа бөледі. 1 –ші класс рестриктазалары ерікті жерлерде үзінділер жасайды. Мысалы
- 19. ІІ. Рестриктазалар 1 және 3 класс ферменттері күрделі суббірлікті құрылымға ие, олар екі белсенділікке ие: модификациялық
- 20. ІІ. Рестриктазалар Әртүрлі микроорганизімдерден бөлінген ферменттер арасынан ДНҚ-да бірдей (одни и те же последовательности) тізебктерді танып
- 21. ІІ. Рестриктазалар Рестриктазаның әсер ету механизімі және ДНҚ-ны метилдеу системасы. Рестрикцианың нысана ретінде көбіне 4-6 полиндромды
- 22. ІІІ. ДНК-лигаза Лигаза (лат. ligāre — тігу, біріктіру) әртүрлі молекулалардың (белоктардың, нуклеин қышқылының, пептидтердің т. б.)
- 23. ІІІ. ДНК-лигаза Гендік инженерияда ДНҚ-лигазаның екі түрін қолданады. Олар бір-бірінен әсер етуі және кофакторды қажет етуі
- 24. ІV. ДНК-полимераза Бірінші рет ДНҚ-полимераза 1958 ж E. Coli-дан Коренберг және қызметкерлермен бірге бөлініп алынды. ДНК-полимераза
- 25. ІV. ДНК-полимераза 1. 5’-3’ полемиразалық белсенділікке ие. Реакция үшін бір тізбекті ДНК-матрица және осы бөлікке көмплементарлы
- 26. V. Кері транскриптаза Ревертаза — кері транскриптаза. Кері транскрипция (яғни РНҚ негізінде ДНҚ түзу) жүргізетін фермент.
- 27. V. Кері транскриптаза Кері транскриптаза үш ферментативті белсенділікке ие. 1. ДНК-полимеразалық, ол матрица ретінде ДНҚ-ны да
- 28. V. Кері транскриптаза Кері транскрипция реакцияларын арнайы тандалған жағдайларда және РНҚазалық белсенділікке ие күшті ингбиторларды қолдану
- 29. № 3 дәріс Векторлар Жоспары І. Векторлар және оларға қойылатын талаптар ІІ. Вектор түрлері
- 30. І. Векторлар және оларға қойылатын талаптар Вектор деп бөтен генетикалық материалды (ДНҚ фрагментін) клеткаға (реципиенттің) тасымалдауға
- 31. І. Векторлар және оларға қойылатын талаптар Векторларды эксперименттік жолмен құрастырады және оларға келесі талаптар қойылады: 1)
- 32. І. Векторлар және оларға қойылатын талаптар Векторлық молекуланың шығу козі болып бактериялық плазмидалар мен вирустар (әсіресе
- 33. 1. Плазмида Плазмидалар — хромосомадан тыс реплекацияланатын ДНҚ молеукуласы. Плазмидалар көбінесе бактерияларда кездеседі, ол екі тізбекті
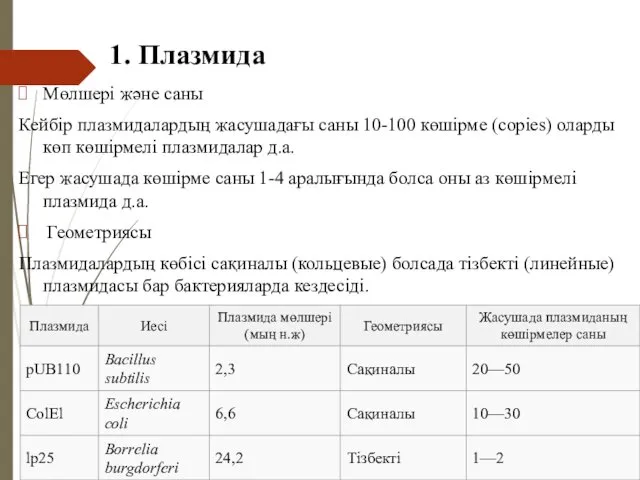
- 34. 1. Плазмида Мөлшері және саны Кейбір плазмидалардың жасушадағы саны 10-100 көшірме (copies) оларды көп көшірмелі плазмидалар
- 35. 1. Плазмида Плазмиданы жасушаға тасмалдау жолдары. Конъюгация Трансдукция трансформация
- 36. 1. Плазмида Плазмидалар қызметі Плазмидалардың көбісі иесінің фенотипінде айтарлықтай өзгерістер әкелмейді. Басқалары керсінше жасуша иесіне белгілі
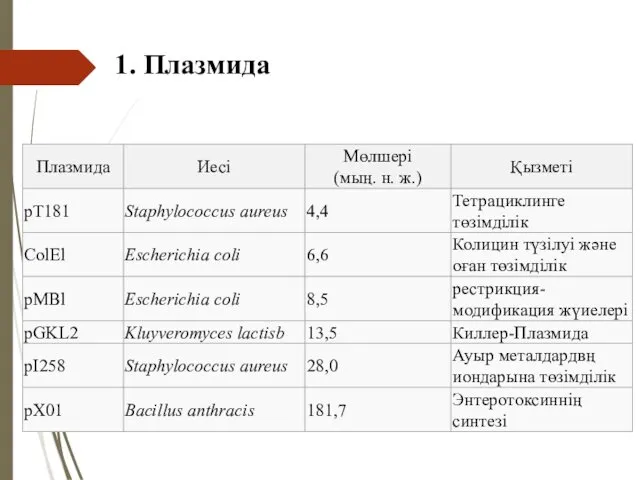
- 37. 1. Плазмида Плазмидалардың жасушадағы қызметі әралуан түрлі, оларға келесілер жатады: Гемолизин синтезі - Hly-плазмида; Ауыр металдарға
- 38. 1. Плазмида F-плазмида - Escherichia coli K-12 жасушасының конъюгативті эписомасы, бактериялялардың жыныстық көбиюінің бірт түрі –
- 39. 1. Плазмида
- 40. 1. Плазмида Плазмидаларды классификациялайтын бірнеше системалар бар, олар келесі ерекшеліктерге негізделген: топология (тізбекті немес сақиналы), Репликация
- 41. 2. Космида Космида (Cosmides) — құрамында лябда фагтың ДНҚ сының фрагменті және соs-телімі (участок) бар плазмида.
- 42. 3. Фазмида Фазмида (phasmid) [грек. pha(gos) — жеуші және plasma — құрастырылған] — гибридті вектор, фаг
- 43. 4. Шаттл вектор Рекомбинанты вектор, прокариот және эукариот жасушаларында репликациаланатын аймақтары бар. Мысалы pFH7 плазмидасы екі
- 44. 5. Жасанды бактериалды хромосомалар ВАС F-фактордың репликация инициация нүктесі мен екі жас жасушаға плазмидтердің ажыратылуын қамтамасыз
- 45. 6. Жасанды ашытқы хромосомалар S. Cerevisiae үшін экспресияланатын 3 вектор түрі бар: 1. Эписомалық, немесе плазмидалық
- 46. 6. Жасанды ашытқы хромосомалар 1. Плазмидалық векторлар секреттелетін және секреттелмейтін гетерологиялық ақуыздарды алу үшін кен қолданылады.
- 47. № 4 дәріс Геннің химиялық синтезі. 1. Ашылу тарихы. 2. ДНҚ Синтезатор 2. Химиялық синтездің фосфорамидиті
- 48. 1. Ашылу тарихы. Берілген нуклеотидтер тізбегі бойынша ДНҚ - синтездеу әдісін 1969 жылы Г. Корана ұсынған
- 49. 2. ДНҚ Синтезатор Қазіргі кезде гендерді автоматты синтездейтін құралдар бар. 1980 ж. Итакура алғаш өзі алдын
- 50. ДНҚ синтезатор. (Biosset)
- 51. 2. Химиялық синтездің фосфорамидиті әдіс Кәзіргі уақытта химиялық синтездің ен кен атарлған әдісі. Бастапқы құрушы блоктар
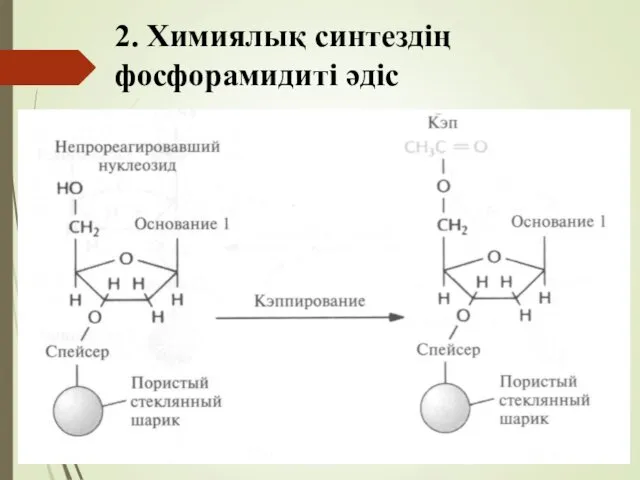
- 52. 2. Химиялық синтездің фосфорамидиті әдіс 1. Бірінші нуклеозидті қатқыл (твердый носител) тасымалдаушыға бекіту. 2. Шаю (Отмывание).
- 53. 2. Химиялық синтездің фосфорамидиті әдіс 1. Синтездің бірінші сатысында өсіп келе жатқан ДНҚ тізбегі қатқыл инерты
- 54. 2. Химиялық синтездің фосфорамидиті әдіс 2. Сатыда колонкадан су мен басқада нуклеофилді заттарды жою үшін сусыздандырығлан
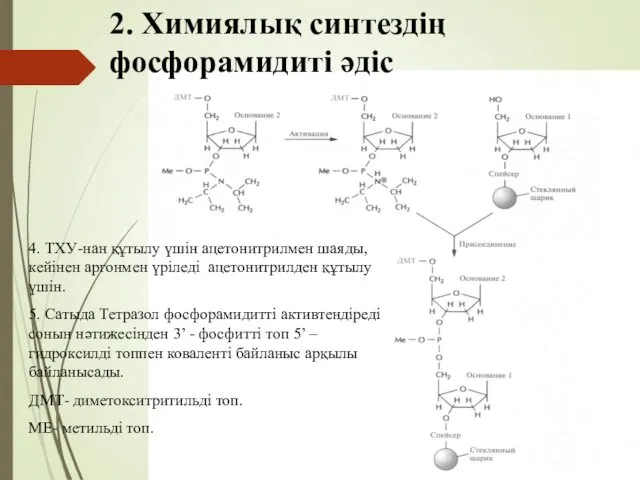
- 55. 2. Химиялық синтездің фосфорамидиті әдіс 4. ТХУ-нан құтылу үшін ацетонитрилмен шаяды, кейінен аргонмен үріледі ацетонитрилден құтылу
- 56. 2. Химиялық синтездің фосфорамидиті әдіс 6. Сатыда қосылмаған фосфорамидит және теразол аргонмен үрлеп шығарады. 7. Сатыда
- 57. 2. Химиялық синтездің фосфорамидиті әдіс
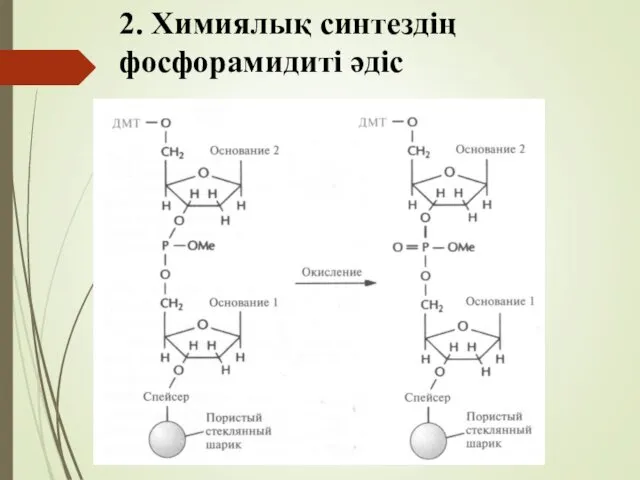
- 58. 2. Химиялық синтездің фосфорамидиті әдіс 8. Сатыда нуклеотидер арасында қалыптасқан фосфиттриэфирлі байланыс қалыпты болмауы мүмкін, осы
- 59. 2. Химиялық синтездің фосфорамидиті әдіс
- 60. 2. Химиялық синтездің фосфорамидиті әдіс Жоғарыдағы цикл бағдарламаға сәйкес өсіп келе жатқан тізбекке сонғы нуклеозид жалғанып
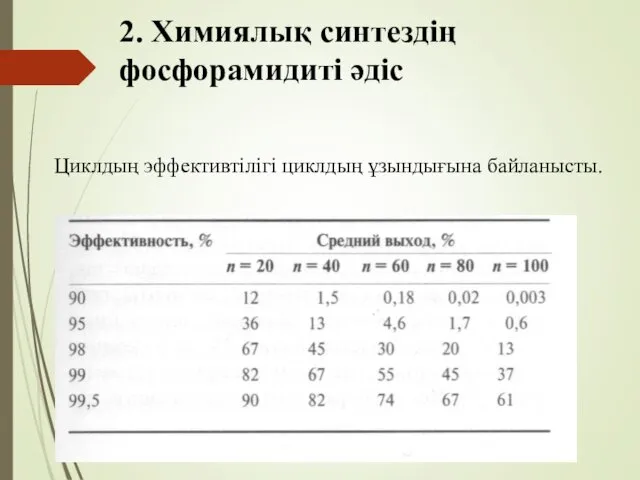
- 61. 2. Химиялық синтездің фосфорамидиті әдіс Циклдың эффективтілігі циклдың ұзындығына байланысты.
- 62. № 5 дәріс Генді инженериялық манипуляциялар. Генді инженериялық манипуляция кезендері: 1. Қажетті ДНҚ-ны бөліп алу. 2.
- 63. Генді инженериялық манипуляция кезендері: Биологиялық зерттеулердің көбісі бір қарапайым процестен басталады яғни – жасушаға бөгде генетикалық
- 64. 1. Қажетті ДНҚ-ны бөліп алу. Біздің мақсатымыз жасушаға белгілі бір генді енгізу болғандықтан, ең бірінші бізге
- 65. 2. Вектор. Жасушаға жалғыз енуші генді (insert) ешқандай қолдаусыз енгізу мәнсіз зат. Себебі жасушада көптеген қорғаушы
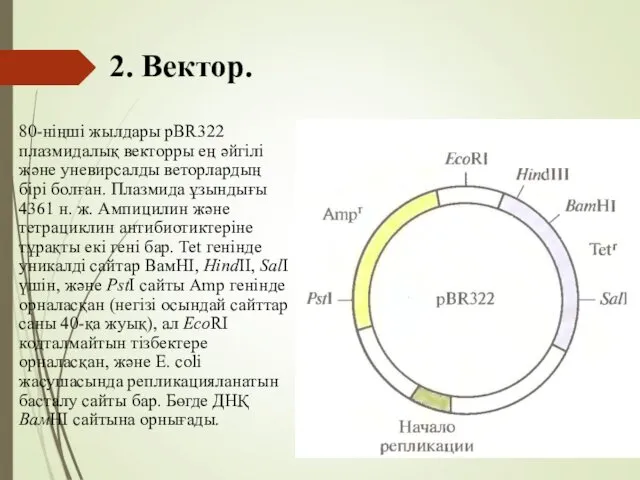
- 66. 2. Вектор. 80-ніңші жылдары pBR322 плазмидалық векторры ең әйгілі және уневирсалды веторлардың бірі болған. Плазмида ұзындығы
- 67. 2. Вектор. Промоторлар, Энхансерлер, сайленсерлер. Әрбір жұмыстеуші геннің алдында қысқа ДНҚ аймағы Промотор бар. Дәл сол
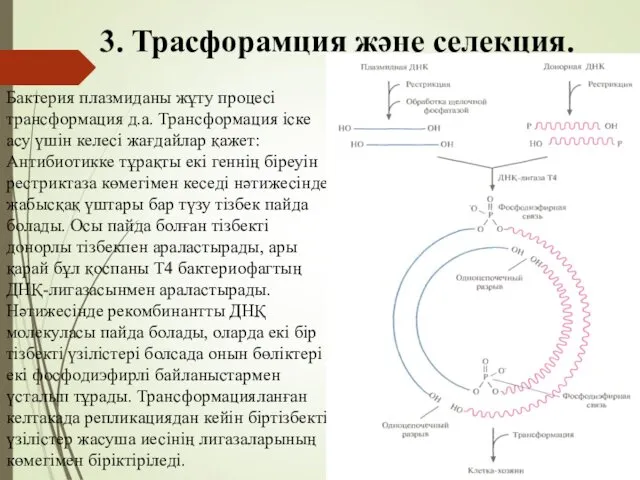
- 68. 3. Трасфорамция және селекция. Бактерия плазмиданы жұту процесі трансформация д.а. Трансформация іске асу үшін келесі жағдайлар
- 69. 3. Трасфорамция және селекция. Трансформация қасиет барлық бактерияларға тән емес, яғни тек компетентті жасушаларға ғана тән.
- 70. 3. Трасфорамция және селекция. Ол әдістің мәні келесі: Біз pBR322 плазмидасында Аmp және Tet антибиотикке төзімді
- 71. № 6 дәріс ДНҚ-ны секвенирлеу 1. Секвенирлеу тарихы 2. Сэнгер әдісі
- 72. 1. Секвенирлеу тарихы Секвенирлеу бұл – нуклеин қышқылдарынының нклеотидтік ретін анықтау әдісі. Жоғары эфиктивті секвенирлеу әдісінің
- 73. 1. Секвенирлеу тарихы ДНК-ның құрылымын анықтаудың көптеген әдістері белгілі, солардың ішінде Максам және Гильберт ұсынған химиялық
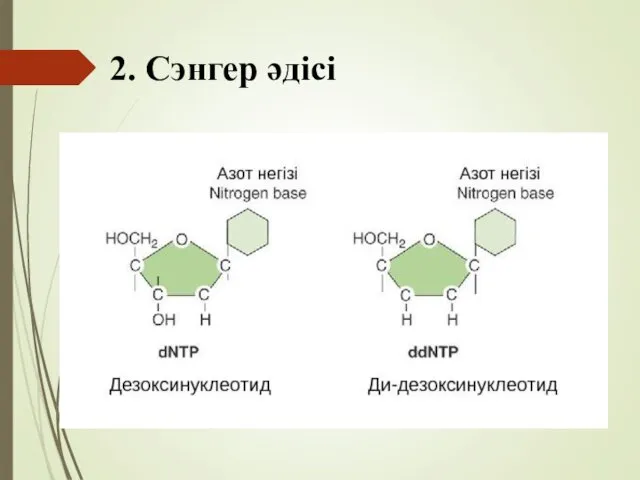
- 74. 2. Сэнгер әдісі Сэнгер ұсынған әдісте ерекше дидезоксирибонуклеотидтер (ddNTP) деп аталатын модификацияланған нуклеотидтер қолданылады. ddNTP-тердің кәдімгі
- 75. 2. Сэнгер әдісі
- 76. 2. Сэнгер әдісі Сэнгердің дәстүрлі тәсілінде 4 бөлек реакциялық пробиркалар алынады. Әр пробиркада праймер, 4 dNTP
- 78. Скачать презентацию

































































 Комнатные растения. О чем рассказали листья
Комнатные растения. О чем рассказали листья Дождевой червь. Опыты в детском саду
Дождевой червь. Опыты в детском саду Сущность жизни. Свойства живой материи
Сущность жизни. Свойства живой материи Royal Botanic Gardens — Kew World Heritage in London
Royal Botanic Gardens — Kew World Heritage in London Память. Исследование памяти
Память. Исследование памяти Эволюция, её доказательства. Переходные формы. Ископаемые виды. Рудименты. Атавизмы
Эволюция, её доказательства. Переходные формы. Ископаемые виды. Рудименты. Атавизмы Рождение современной биологии: новая анатомия (А. Везалий, Г. Фаллопий, Б. Эустахио)
Рождение современной биологии: новая анатомия (А. Везалий, Г. Фаллопий, Б. Эустахио) презентация к уроку биологии 7 класс
презентация к уроку биологии 7 класс Эвглена зеленая
Эвглена зеленая Міні-проект Тварини минулого
Міні-проект Тварини минулого Желудочно-кишечный тракт
Желудочно-кишечный тракт Сравнительная характеристика крыс и мышей
Сравнительная характеристика крыс и мышей Виды корней и типы корневых систем
Виды корней и типы корневых систем Клетка. Клеточная теория
Клетка. Клеточная теория Развитие эволюционного учения Ч. Дарвина
Развитие эволюционного учения Ч. Дарвина Түйеқұстар отряды
Түйеқұстар отряды Глаз и зрение
Глаз и зрение Передвижение веществ у растений
Передвижение веществ у растений Изменчивость: наследственная и ненаследственная. Мутации
Изменчивость: наследственная и ненаследственная. Мутации Зимующие птицы
Зимующие птицы Бактериология. Классификация бактерий. Морфология бактерий и методы её изучения. (Лекция 9)
Бактериология. Классификация бактерий. Морфология бактерий и методы её изучения. (Лекция 9) Тема 12.Навоз, воздух, вода
Тема 12.Навоз, воздух, вода УМК по теме: Стресс и стрессоустойчивость
УМК по теме: Стресс и стрессоустойчивость Биологическая роль и строение нуклеиновых кислот
Биологическая роль и строение нуклеиновых кислот Онтогенез и филогенез нервной системы
Онтогенез и филогенез нервной системы Органы и системы органов животных
Органы и системы органов животных Растение в интерьере жилого дома
Растение в интерьере жилого дома Ксенобиотики в окружающей среде и живых организмах. (Лекция 2)
Ксенобиотики в окружающей среде и живых организмах. (Лекция 2)