Содержание
- 2. ГЕННО-ИНЖЕНЕРНО-МОДИФИЦИРОВАННЫЕ ОРГАНИЗМЫ (ГМО) Официальное определение (Федеральный закон "О государственном регулировании в области генно-инженерной деятельности" от 05.07.1996
- 3. ВИДЫ ГМО ГМО микробного происхождения: бактерии, синтезирующие инсулин бактерии, синтезирующие ферменты ГМО животного происхождения: лактоферрин (козы)
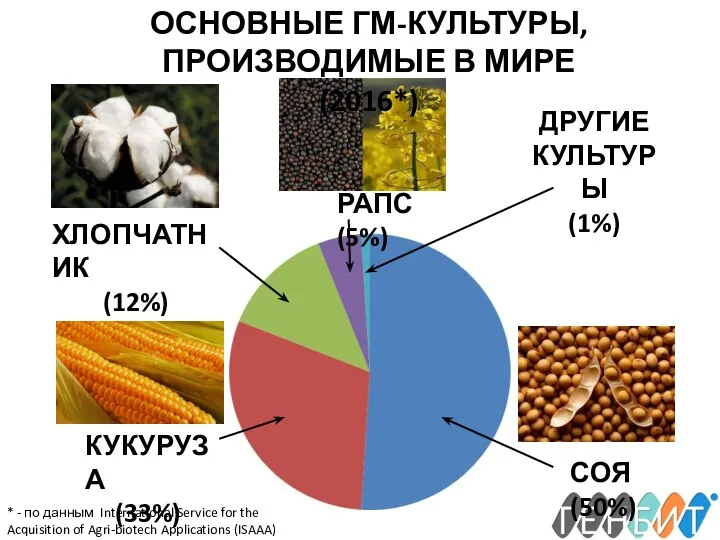
- 4. СОЯ (50%) КУКУРУЗА (33%) ХЛОПЧАТНИК (12%) РАПС (5%) ДРУГИЕ КУЛЬТУРЫ (1%) ОСНОВНЫЕ ГМ-КУЛЬТУРЫ, ПРОИЗВОДИМЫЕ В МИРЕ
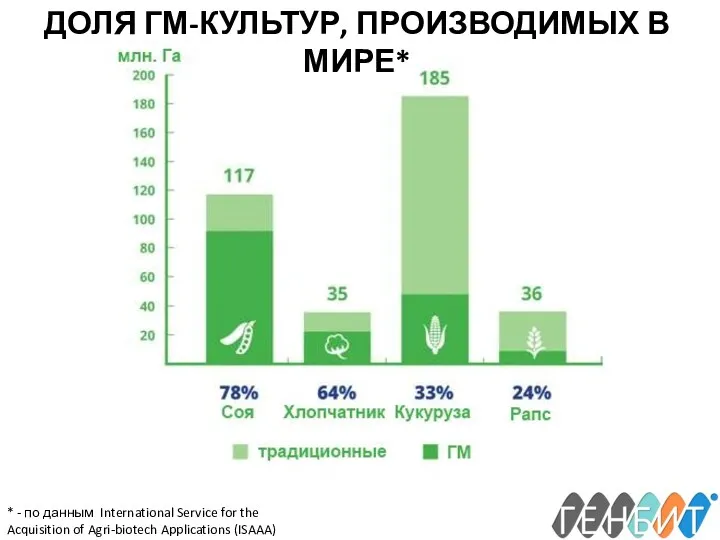
- 5. ДОЛЯ ГМ-КУЛЬТУР, ПРОИЗВОДИМЫХ В МИРЕ* * - по данным International Service for the Acquisition of Agri-biotech
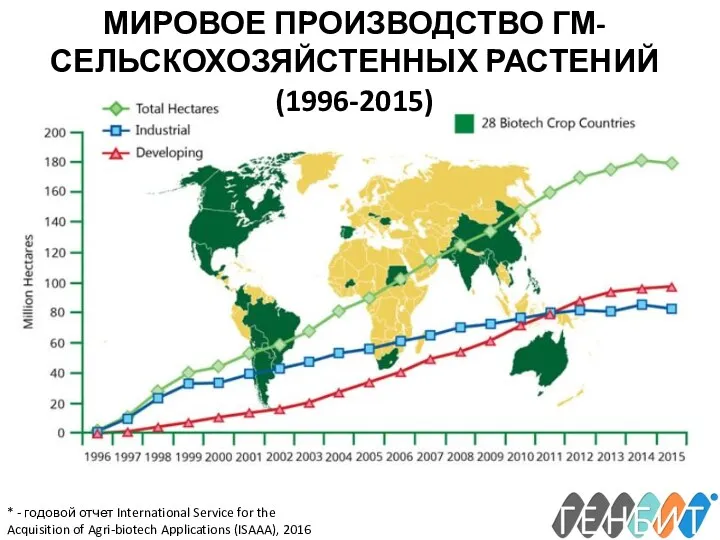
- 6. * - годовой отчет International Service for the Acquisition of Agri-biotech Applications (ISAAA), 2016 МИРОВОЕ ПРОИЗВОДСТВО
- 8. ГМО В РОССИИ Трансформационные события Соя: 8 линий + 1 комбинированное событие (GTS 40-3-2, MON89788, MON87701,
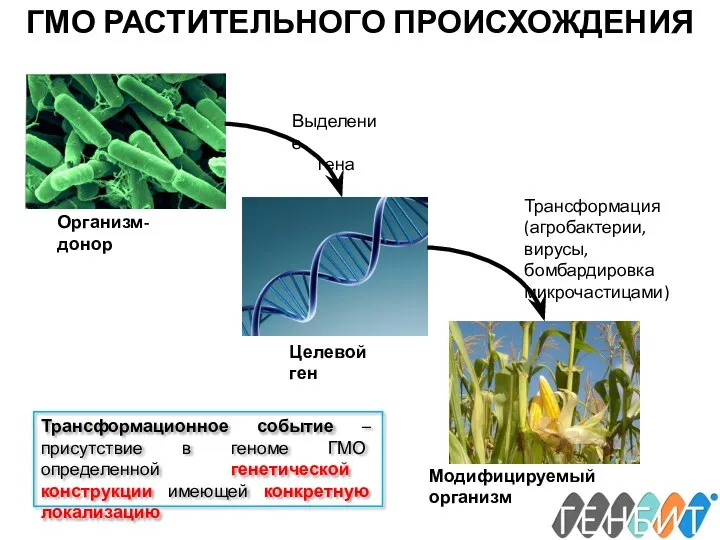
- 9. ГМО РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ Организм-донор Целевой ген Модифицируемый организм Выделение гена Трансформация (агробактерии, вирусы, бомбардировка микрочастицами) Трансформационное
- 10. НОВЫЕ ГЕНЫ И ПРИЗНАКИ ГМ РАСТЕНИЙ 1. Устойчивость к гербицидам: гены cp4 epsps, mepsps, 2mepsps, gox
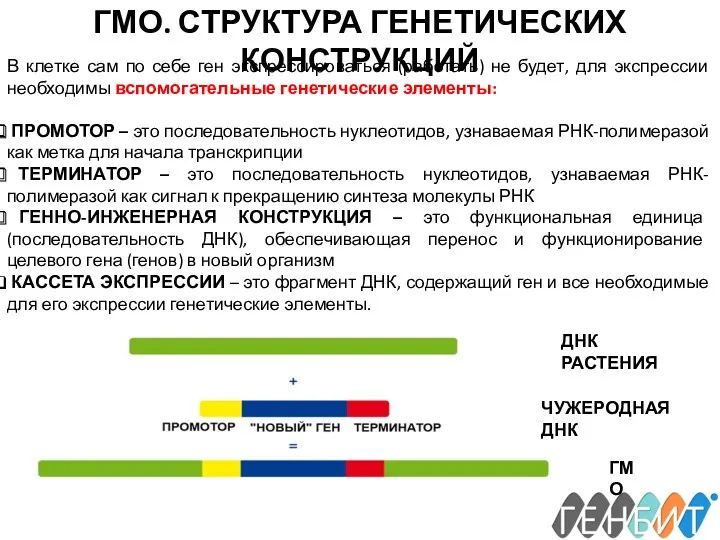
- 11. ГМО. СТРУКТУРА ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ В клетке сам по себе ген экспрессироваться (работать) не будет, для экспрессии
- 12. ОТКУДА БЕРУТСЯ НОВЫЕ ГЕНЫ И ВСПОМОГАТЕЛЬНЫЕ ЭЛЕМЕНТЫ? Целевые гены Бактерии: cp4 epsps – A. tumefaciens штамм
- 13. ОТКУДА БЕРУТСЯ НОВЫЕ ГЕНЫ И ВСПОМОГАТЕЛЬНЫЕ ЭЛЕМЕНТЫ? Промоторы Вирусы: p35S – вирус мозаики цветной капусты FMV
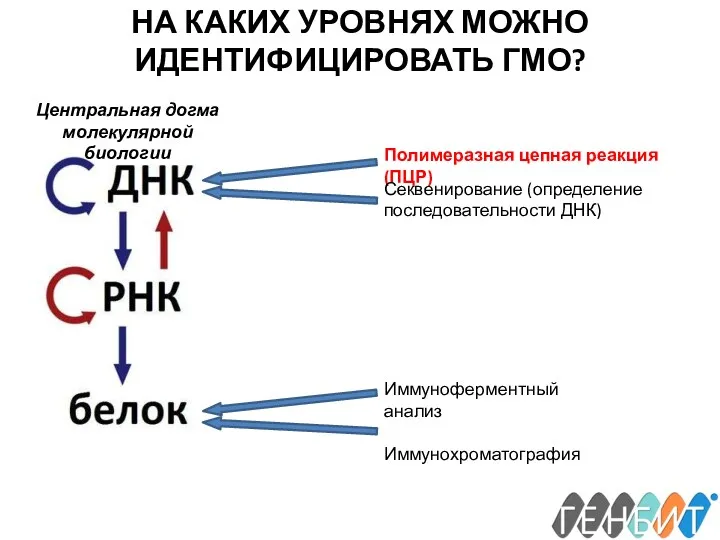
- 14. НА КАКИХ УРОВНЯХ МОЖНО ИДЕНТИФИЦИРОВАТЬ ГМО? Центральная догма молекулярной биологии Полимеразная цепная реакция (ПЦР) Иммуноферментный анализ
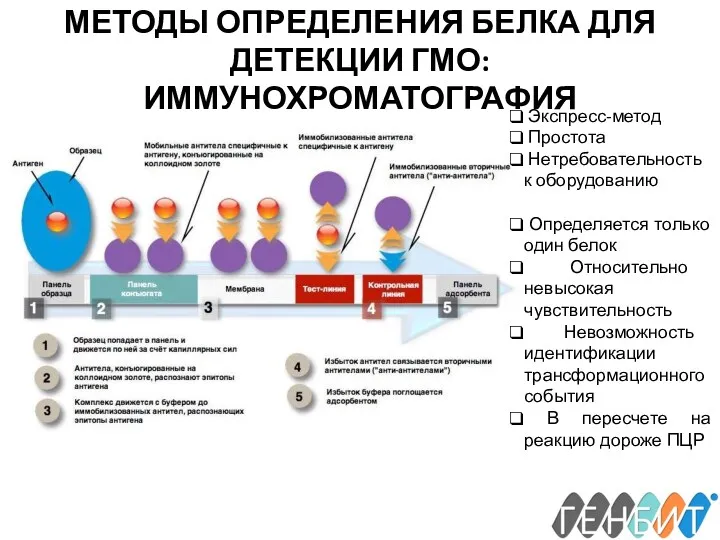
- 15. МЕТОДЫ ОПРЕДЕЛЕНИЯ БЕЛКА ДЛЯ ДЕТЕКЦИИ ГМО: ИММУНОХРОМАТОГРАФИЯ Экспресс-метод Простота Нетребовательность к оборудованию Определяется только один белок
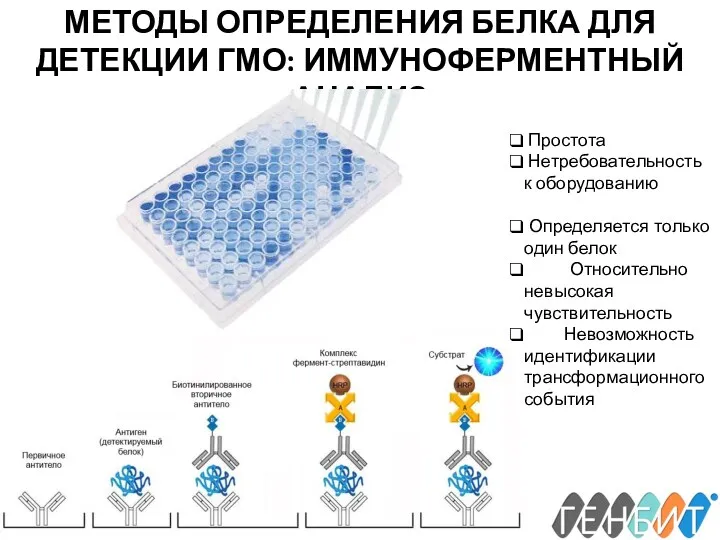
- 16. МЕТОДЫ ОПРЕДЕЛЕНИЯ БЕЛКА ДЛЯ ДЕТЕКЦИИ ГМО: ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ Простота Нетребовательность к оборудованию Определяется только один белок
- 17. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР) — метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов
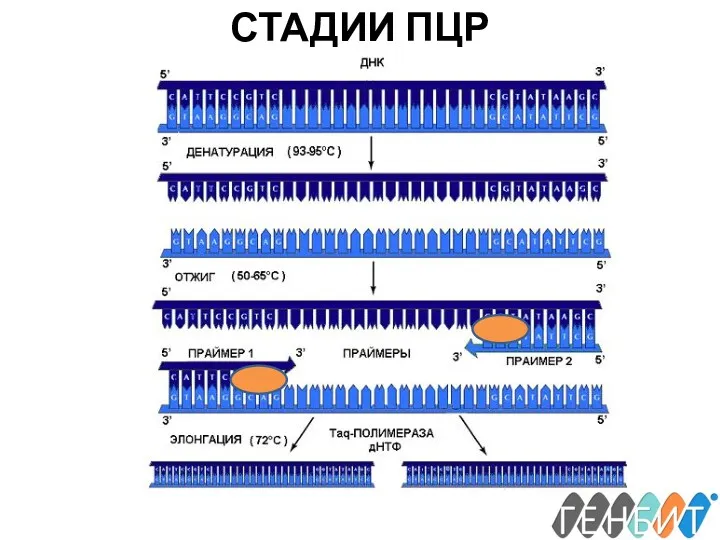
- 18. СТАДИИ ПЦР
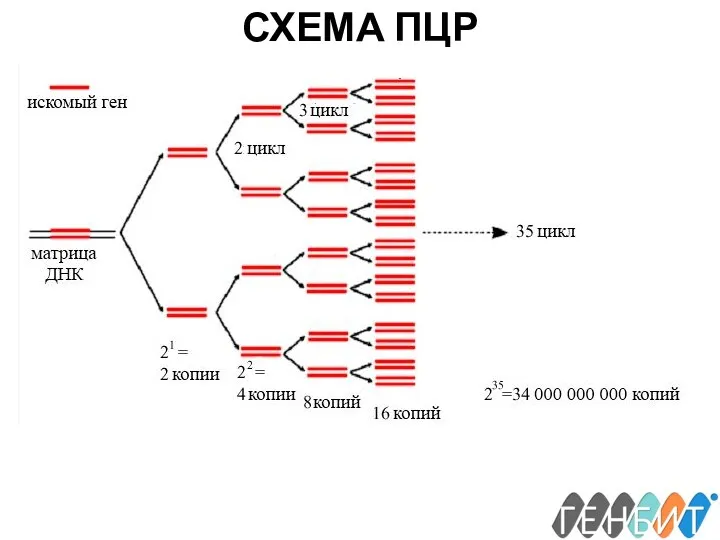
- 19. СХЕМА ПЦР
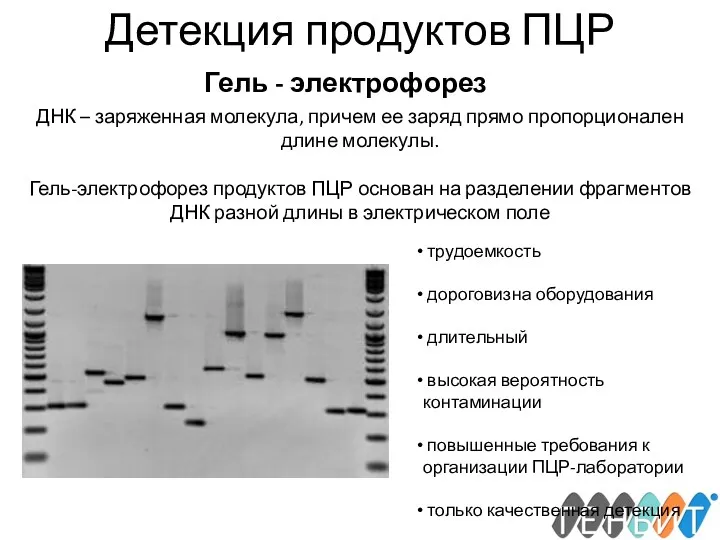
- 20. ДЕТЕКЦИЯ ПРОДУКТОВ ПЦР Традиционный метод: гель-электрофорез Флуоресцентные методы детекции: Интеркалирующие красители Флуоресцентные зонды
- 21. Детекция продуктов ПЦР Гель - электрофорез ДНК – заряженная молекула, причем ее заряд прямо пропорционален длине
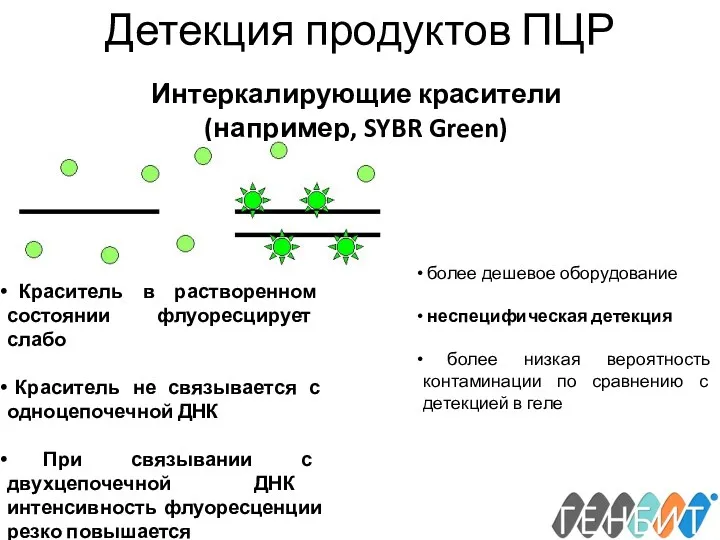
- 22. Детекция продуктов ПЦР Интеркалирующие красители (например, SYBR Green) Краситель в растворенном состоянии флуоресцирует слабо Краситель не
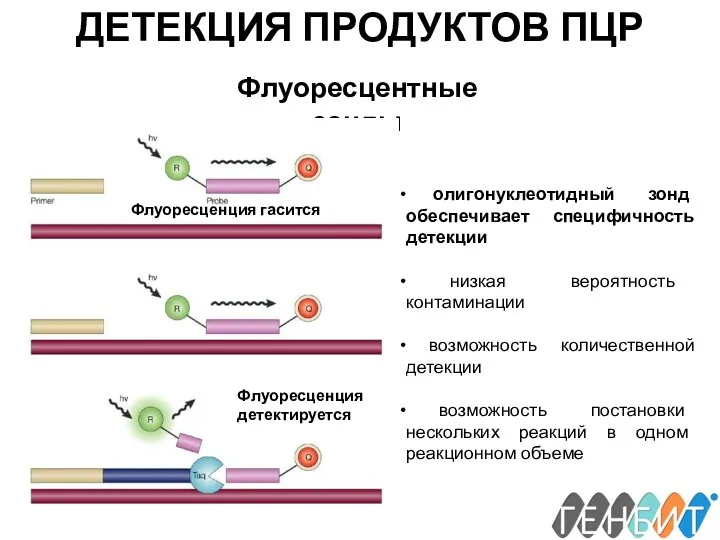
- 23. ДЕТЕКЦИЯ ПРОДУКТОВ ПЦР Флуоресцентные зонды Флуоресценция гасится Флуоресценция детектируется олигонуклеотидный зонд обеспечивает специфичность детекции низкая вероятность
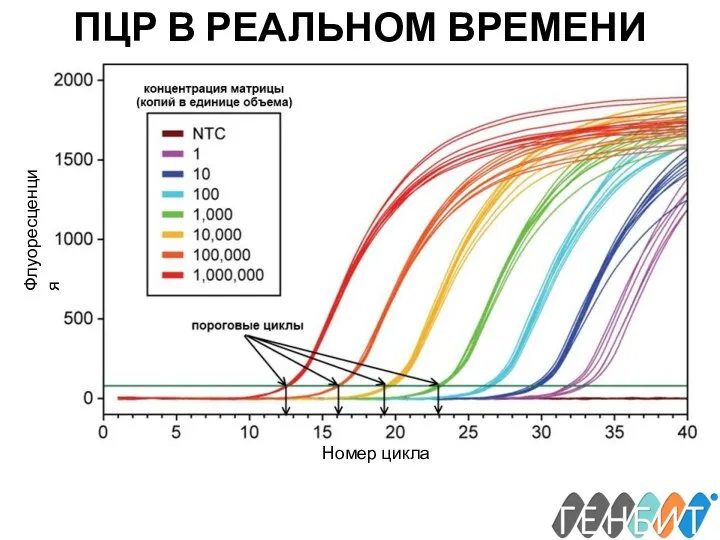
- 24. ПЦР В РЕАЛЬНОМ ВРЕМЕНИ
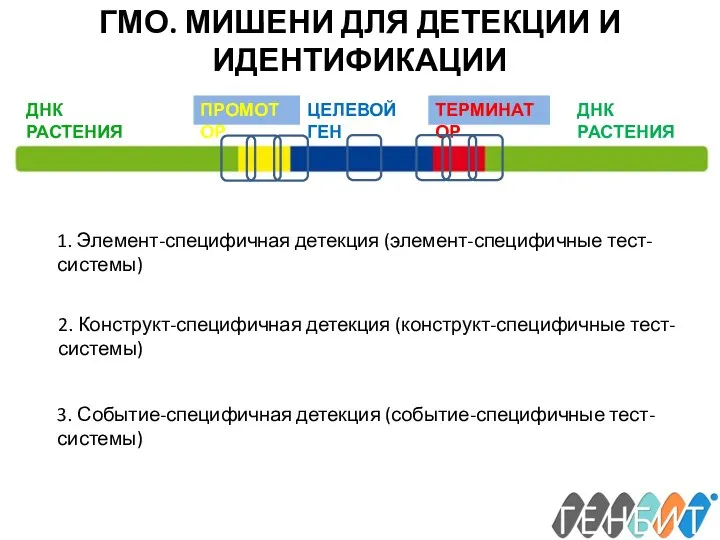
- 25. ГМО. МИШЕНИ ДЛЯ ДЕТЕКЦИИ И ИДЕНТИФИКАЦИИ 1. Элемент-специфичная детекция (элемент-специфичные тест-системы) 2. Конструкт-специфичная детекция (конструкт-специфичные тест-системы)
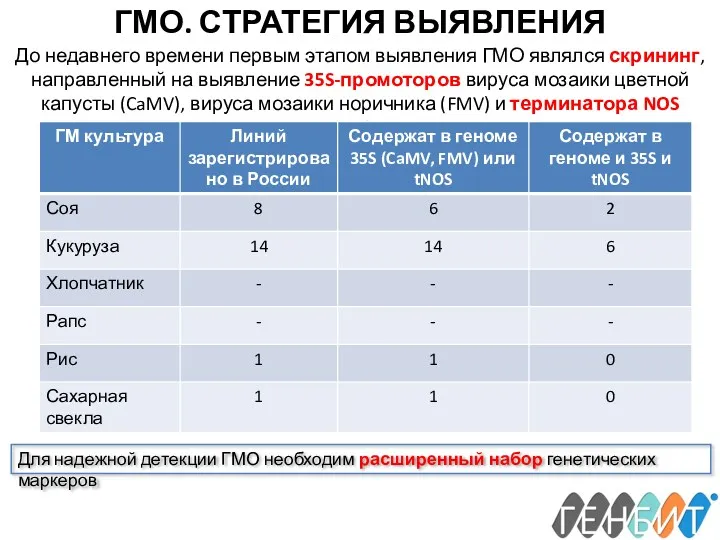
- 26. ГМО. СТРАТЕГИЯ ВЫЯВЛЕНИЯ До недавнего времени первым этапом выявления ГМО являлся скрининг, направленный на выявление 35S-промоторов
- 27. МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ГОСТ Р 53244-2008 Продукты пищевые. Методы анализа для обнаружения генетически модифицированных организмов и полученных
- 28. ИДЕНТИФИКАЦИЯ ГМО ПО КОМБИНАЦИИ ВЫЯВЛЕННЫХ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ База данных ГМО Center for Environmentsl Risk Assessment (http://cera-gmc.org/GMCropDatabase)
- 29. ИДЕНТИФИКАЦИЯ ГМО ПО КОМБИНАЦИИ ВЫЯВЛЕННЫХ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ База данных ГМО International Service for Acquisition of Agri-biotech
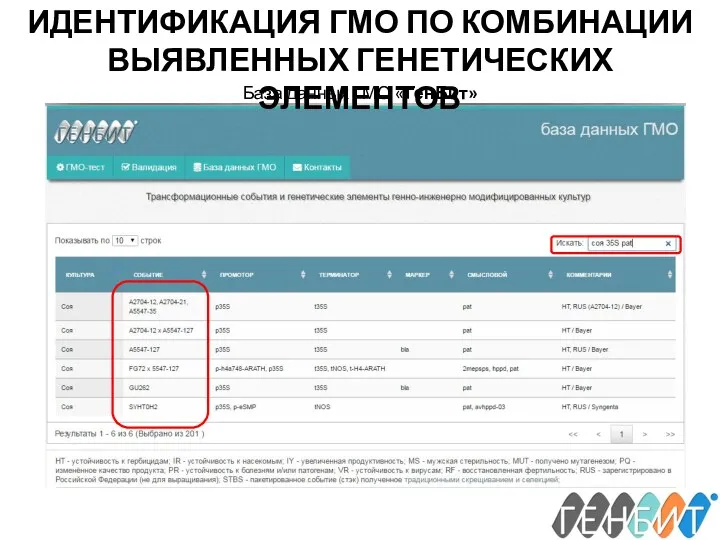
- 30. ИДЕНТИФИКАЦИЯ ГМО ПО КОМБИНАЦИИ ВЫЯВЛЕННЫХ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ База данных ГМО «ГенБит»
- 32. Скачать презентацию









 Учёные, внёсшие вклад в развитие биологии с античности до наших дней
Учёные, внёсшие вклад в развитие биологии с античности до наших дней Отработка заданий части В и С ОГЭ. Биология 9 класс
Отработка заданий части В и С ОГЭ. Биология 9 класс Перелетные птицы весной. II младшая группа
Перелетные птицы весной. II младшая группа Скелет головы и туловища
Скелет головы и туловища Филэмбриогенез. Эволюционные преобразования
Филэмбриогенез. Эволюционные преобразования Клеточная теория
Клеточная теория Тип молюски. Клас двостулкові
Тип молюски. Клас двостулкові Природоохрана и защита живой природы
Природоохрана и защита живой природы Урок биологии 9 класс Звёздный час – Человек
Урок биологии 9 класс Звёздный час – Человек Задания ЕГЭ по биологии теме Формы достижения биологического прогресса
Задания ЕГЭ по биологии теме Формы достижения биологического прогресса Азотное питание растений
Азотное питание растений Разнообразие животных
Разнообразие животных Мужской ликбез. Все об уходе за внешностью
Мужской ликбез. Все об уходе за внешностью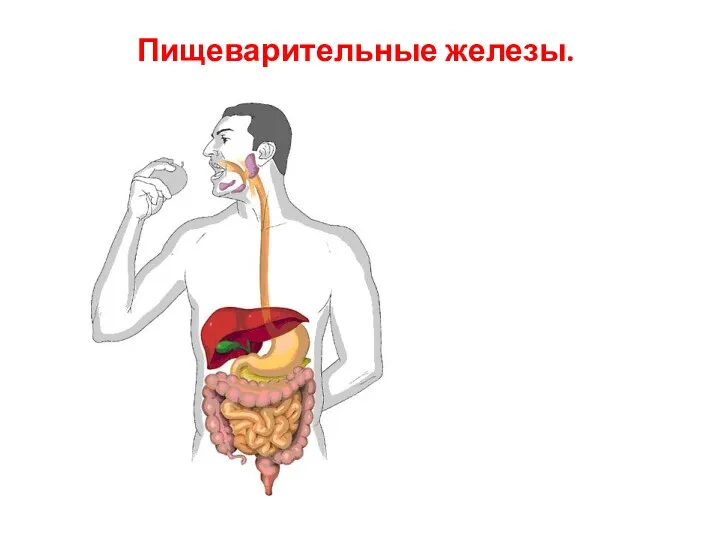 Пищеварительные железы
Пищеварительные железы Заочная экологическая викторина Чудо в перьях, 1 класс
Заочная экологическая викторина Чудо в перьях, 1 класс Класс Птицы
Класс Птицы Отруйнi гриби
Отруйнi гриби Движение крови по сосудам. Большой и малый круги кровообращения. 8 класс
Движение крови по сосудам. Большой и малый круги кровообращения. 8 класс Ткани растений
Ткани растений Химический состав клетки - технологическая карта урока.
Химический состав клетки - технологическая карта урока. Пропорции выражают характер. Птицы с разным характером пропорций
Пропорции выражают характер. Птицы с разным характером пропорций Предмет і завдання мікробіології. Основні етапи розвитку. Систематика номенклатура і класифікація мікроорганізмів
Предмет і завдання мікробіології. Основні етапи розвитку. Систематика номенклатура і класифікація мікроорганізмів Сезонные изменения в жизни организмов
Сезонные изменения в жизни организмов Анатомия глаза. Веки
Анатомия глаза. Веки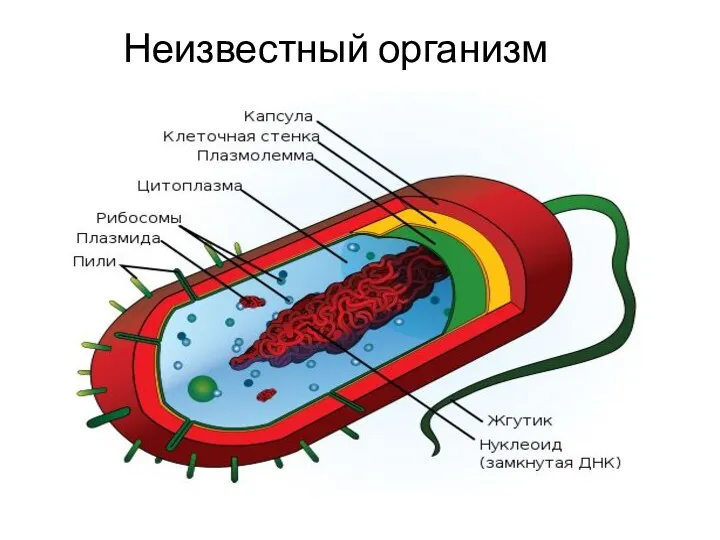 Бактерии. Строение бактериальной клетки. Формы бактерий. Распространение и условия обитания
Бактерии. Строение бактериальной клетки. Формы бактерий. Распространение и условия обитания Протерозойская эра
Протерозойская эра Клеточный сигналинг
Клеточный сигналинг Отряд Непарнокопытные
Отряд Непарнокопытные