Содержание
- 2. Mark A. Knepper, MD, PhD Laboratory of Kidney & Electrolyte Metabolism National Heart, Lung, and Blood
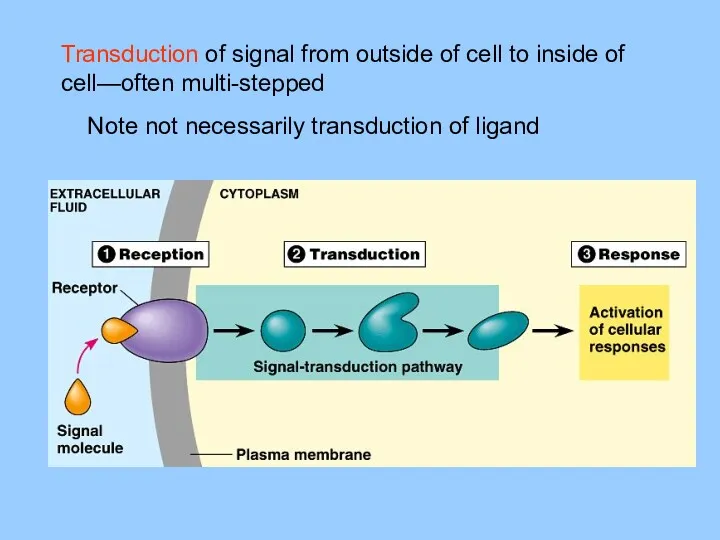
- 3. Reception of extracellular signal by cell Transduction of signal from outside of cell to inside of
- 4. Transduction of signal from outside of cell to inside of cell—often multi-stepped Note not necessarily transduction
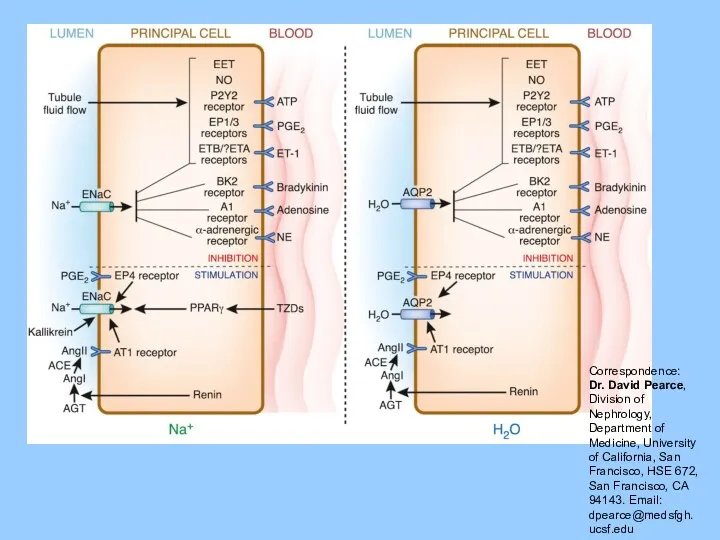
- 6. Correspondence: Dr. David Pearce, Division of Nephrology, Department of Medicine, University of California, San Francisco, HSE
- 7. Three general categories of chemical signaling: Cytoplasmic connections between cells Cell-to-cell contact-mediated signaling Free diffusion between
- 9. Природа биологических сигналов Chemical Signaling Between Cells
- 10. Высокая аффинность рецептора и лиганда , по-видимому, достигается за счет конгруэнтности участка молекулы рецептора, непосредственно входящего
- 11. Принципиальный момент: Передача сигнала происходит в результате физического контакта лиганда с рецептором. All of latter involves
- 12. Константа аффинности отражает энергию связи лиганд-рецептор. The equilibrium constant (association constant): Keq = KA Provides a
- 13. Энтропию термодинамической системы можно определить через множество возможных равновероятных (микро) конфигураций (Ω), соответствующих конкретному состоянию системы:
- 14. Энтальпия или энергия расширенной системы E равна сумме внутренней энергии газа U и потенциальной энергии E
- 15. Свободная энергия (функция) Гиббса: G = H – T S ΔG = ΔH – T ΔS
- 16. Классическим определением энергии Гиббса является выражение G = U + P V − T S Где:
- 17. The free energy enables us to do changes that occur at a constant temperature and pressure
- 18. Clark’s Theory Условия применимости классической модели взаимодействия лиганд-рецептор
- 19. 1 обратимость связывания 2 все рецепторы эквивалентны и независимы 3 биологический ответ пропорционален количеству занятых рецепторов
- 20. signals that are released from one cell and allowed to freely diffuse to a second (or
- 21. Взаимодействие молекулы лиганда (l) со связывающей молекулой (b) в условиях равновесия можно описать таким уравнением: k1
- 22. Ka (B0 - [bl]) = [bl]/ [l] ; Если: [bl] = B ; [l] = F
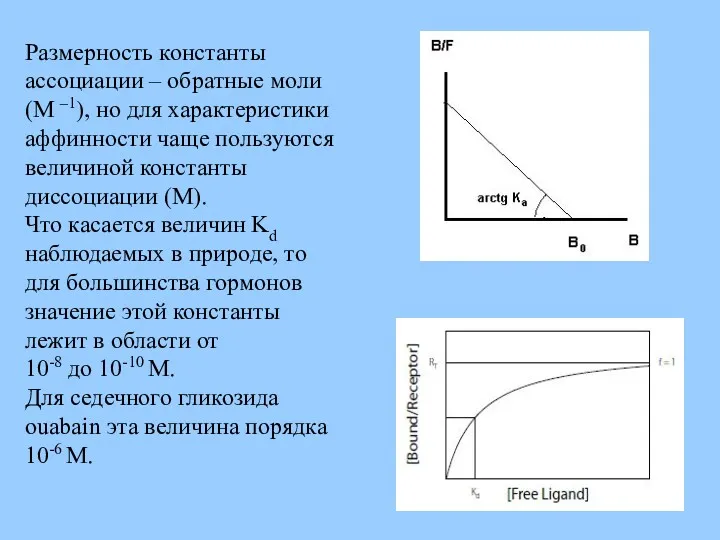
- 23. Размерность константы ассоциации – обратные моли (M –1), но для характеристики аффинности чаще пользуются величиной константы
- 24. The equilibrium constant (association constant): Keq = KA Provides a qualitative measure of the affinity ∆G=
- 25. Multiple Independent Binding Sites ν = nY ν - the moles of bound ligand over the
- 26. Ингибитор снижает Кass [I] - inhibitor concentration, KI - association constant of the inhibitor. The fractional
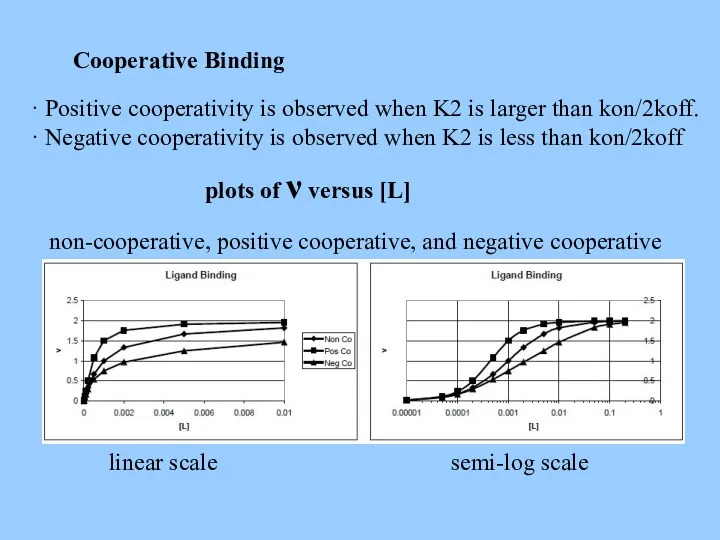
- 27. Cooperative Binding · Positive cooperativity is observed when K2 is larger than kon/2koff. · Negative cooperativity
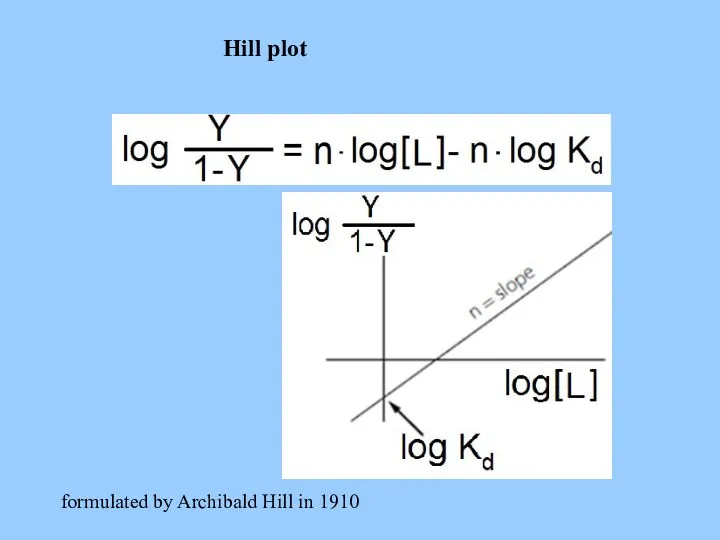
- 28. Hill plot formulated by Archibald Hill in 1910
- 30. Independent sites - microscopic and macroscopic binding affinities (binding of two ligands to an immunoglobulin) equilibrium
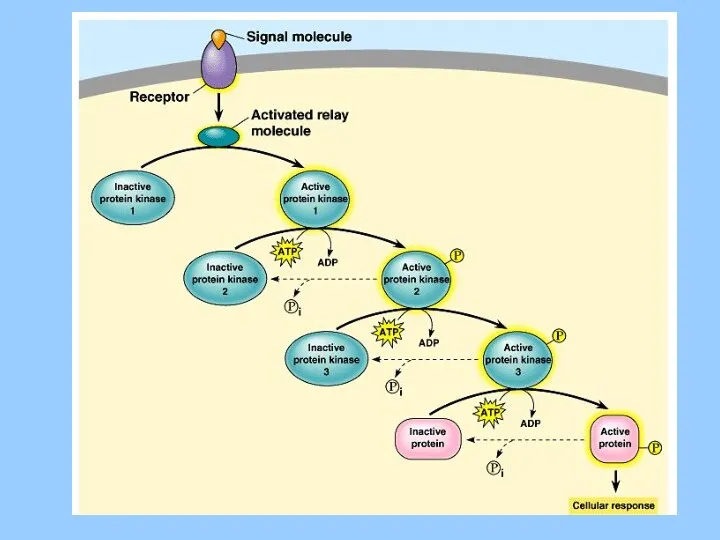
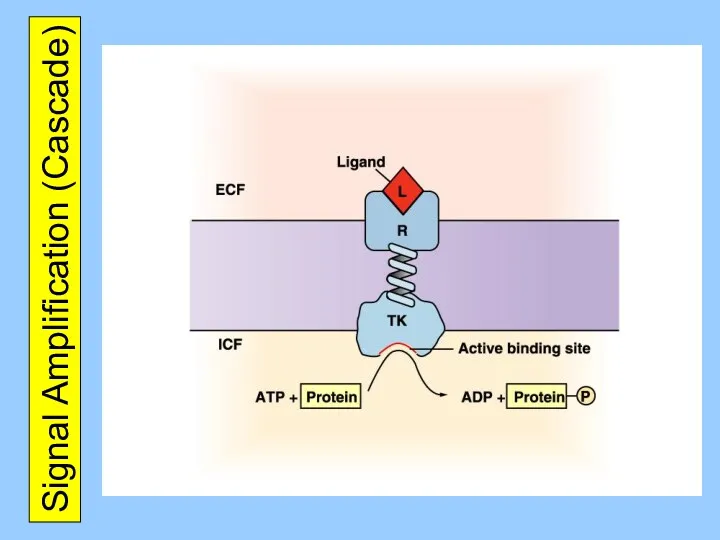
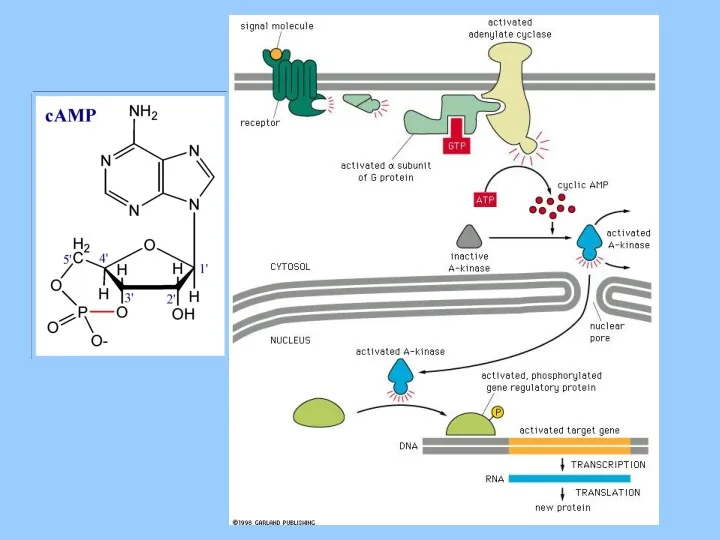
- 31. Signal Amplification (Cascade)
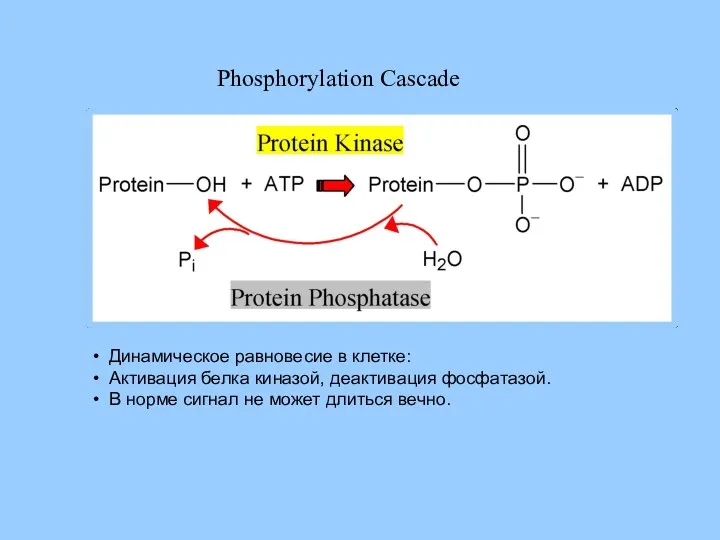
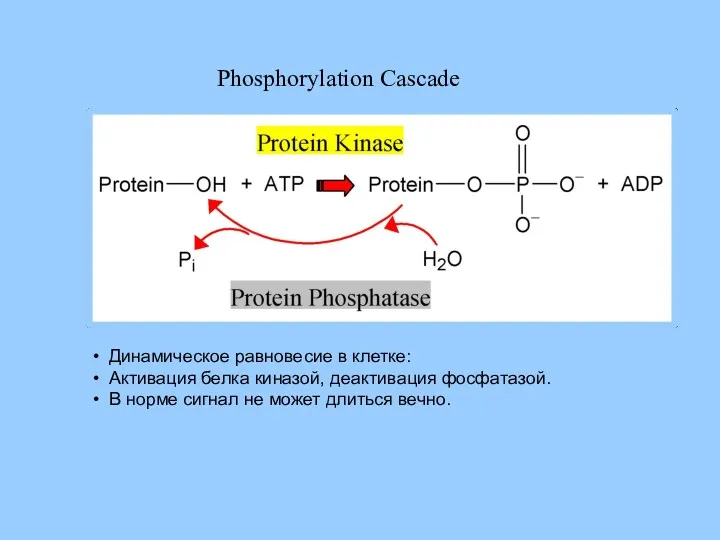
- 32. Динамическое равновесие в клетке: Активация белка киназой, деактивация фосфатазой. В норме сигнал не может длиться вечно.
- 33. A simple model of enzyme action: V0 = kcat[ES] Начальная скорость реакции – концентрация продукта мала,
- 34. Скорость образования: [ES] = k1[E][S]. Скорость убывания: [ES] = k-1[ES] + kcat [ES]. Стационарное состояние: k-1[ES]
- 35. Цель, определить [ES] через измеряемые величины. Сгруппируем константы (кинетические) и переменные (концентрации): (k-1 + kcat) [ES]
- 36. Выразим [E] через [ES] и [E]total: [E] = [E]total - [ES];
- 37. Km = ([E]total - [ES]) [S]/[ES] [ES] Km = [E]total[S] - [ES][S] [ES] Km + [ES][S]
- 38. В условиях насыщения субстратом, когда [ES] = [E]total Vmax = kcat [E]total подставляем в V0 =
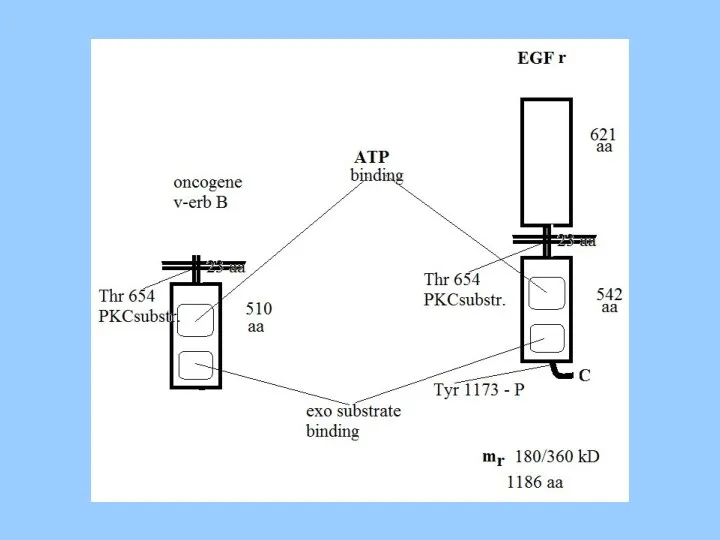
- 41. Мутанты рецептора EGF
- 42. About 70 to 80 percent breast precancers have over expression of Her-2/neu oncogene. Although Her-2/neu oncogene
- 43. One of the fascinating things that have happened in recent years is that an antibody to
- 45. Настоящий инженер немедленно начнет писать функцию с 7-ю переменными и минимизировать ее с помощью системы дифференциальных
- 46. Ингибитор снижает Кass [I] - inhibitor concentration, KI - association constant of the inhibitor. The fractional
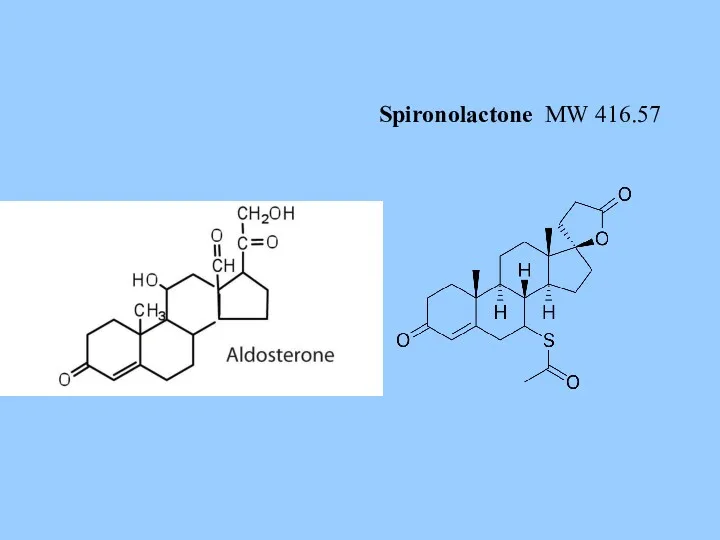
- 47. Spironolactone MW 416.57
- 48. Spironolactone (верошпирон) IC50 ~ 2 nM Aldosterone Kd ~ 0.14 nM Aldosterone blood plasma concentration «норма»
- 51. Динамическое равновесие в клетке: Активация белка киназой, деактивация фосфатазой. В норме сигнал не может длиться вечно.
- 52. A simple model of enzyme action: V0 = kcat[ES] Начальная скорость реакции – концентрация продукта мала,
- 53. Скорость образования: [ES] = k1[E][S]. Скорость убывания: [ES] = k-1[ES] + kcat [ES]. Стационарное состояние: k-1[ES]
- 54. Цель, определить [ES] через измеряемые величины. Сгруппируем константы (кинетические) и переменные (концентрации): (k-1 + kcat) [ES]
- 55. Выразим [E] через [ES] и [E]total: [E] = [E]total - [ES];
- 56. Km = ([E]total - [ES]) [S]/[ES] [ES] Km = [E]total[S] - [ES][S] [ES] Km + [ES][S]
- 57. В условиях насыщения субстратом, когда [ES] = [E]total Vmax = kcat [E]total подставляем в V0 =
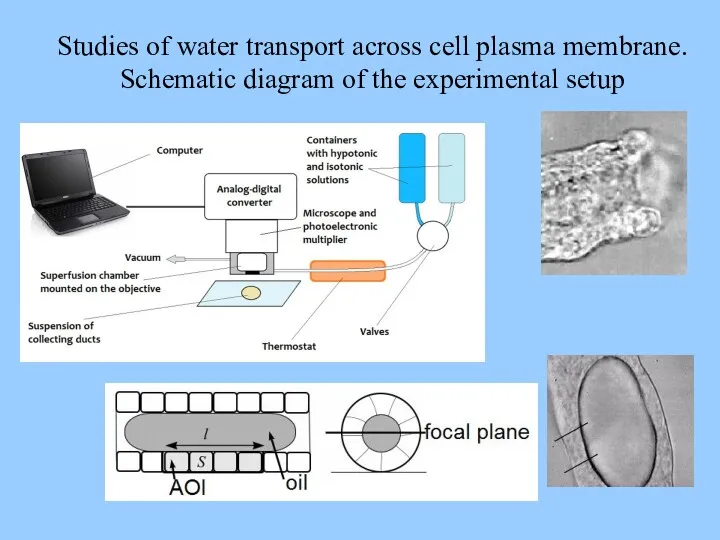
- 64. Studies of water transport across cell plasma membrane. Schematic diagram of the experimental setup
- 65. To understand the adaptive reaction better one needs to use mathematical modeling of osmolytes fluxes. Hypotonic
- 66. The equations of mathematical model Transmembrane potential difference Cell volume Cell ion content and ion fluxes
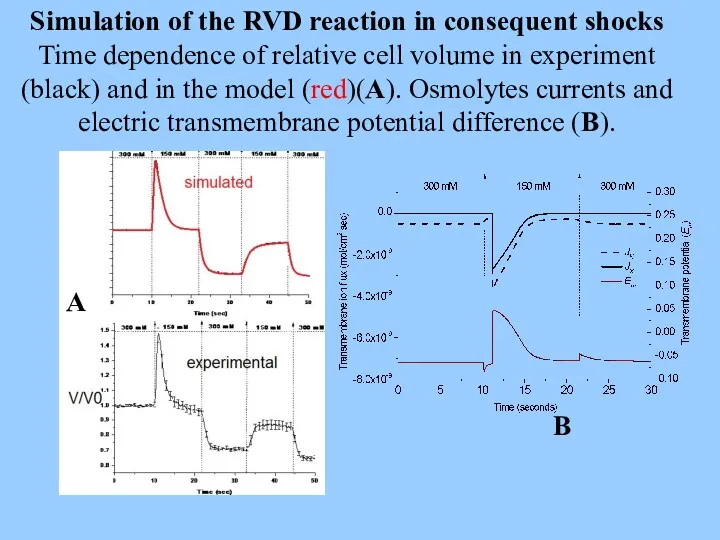
- 67. Simulation of the RVD reaction in consequent shocks Time dependence of relative cell volume in experiment
- 69. Скачать презентацию

















![Ka (B0 - [bl]) = [bl]/ [l] ; Если: [bl]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-21.jpg)


![Ингибитор снижает Кass [I] - inhibitor concentration, KI - association](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-25.jpg)


![A simple model of enzyme action: V0 = kcat[ES] Начальная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-32.jpg)
![Скорость образования: [ES] = k1[E][S]. Скорость убывания: [ES] = k-1[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-33.jpg)
![Цель, определить [ES] через измеряемые величины. Сгруппируем константы (кинетические) и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-34.jpg)
![Выразим [E] через [ES] и [E]total: [E] = [E]total - [ES];](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-35.jpg)
![Km = ([E]total - [ES]) [S]/[ES] [ES] Km = [E]total[S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-36.jpg)
![В условиях насыщения субстратом, когда [ES] = [E]total Vmax =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-37.jpg)






![Ингибитор снижает Кass [I] - inhibitor concentration, KI - association](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-45.jpg)



![A simple model of enzyme action: V0 = kcat[ES] Начальная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-51.jpg)
![Скорость образования: [ES] = k1[E][S]. Скорость убывания: [ES] = k-1[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-52.jpg)
![Цель, определить [ES] через измеряемые величины. Сгруппируем константы (кинетические) и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-53.jpg)
![Выразим [E] через [ES] и [E]total: [E] = [E]total - [ES];](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-54.jpg)
![Km = ([E]total - [ES]) [S]/[ES] [ES] Km = [E]total[S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-55.jpg)
![В условиях насыщения субстратом, когда [ES] = [E]total Vmax =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/247710/slide-56.jpg)







 Этические проблемы использования животных
Этические проблемы использования животных Пищеварение 1.1
Пищеварение 1.1 Общие признаки животных. 5 класс
Общие признаки животных. 5 класс Ретикулярная формация. Лимбическая система. Оболочки мозга
Ретикулярная формация. Лимбическая система. Оболочки мозга Хемосинтез. Хемосинтезирующие организмы
Хемосинтез. Хемосинтезирующие организмы Визначення типу шкіри на різних ділянках обличчя та складання правил догляду за власною шкірою
Визначення типу шкіри на різних ділянках обличчя та складання правил догляду за власною шкірою Прокариоты на службе по защите почвенной среды жизни от тяжёлых металлов
Прокариоты на службе по защите почвенной среды жизни от тяжёлых металлов Прісноводна гідра
Прісноводна гідра Zebra is a striped member of the horse family
Zebra is a striped member of the horse family Голоса птиц
Голоса птиц Імунітет рослин до інфекційних хвороб
Імунітет рослин до інфекційних хвороб Морфологическое описание растения
Морфологическое описание растения Презентация по биологии для учащихся 9 класса по теме Клеточная мембрана
Презентация по биологии для учащихся 9 класса по теме Клеточная мембрана Про кошек
Про кошек Презентация к уроку биологии в 7 классе Отряд Жесткокрылые, или Жуки
Презентация к уроку биологии в 7 классе Отряд Жесткокрылые, или Жуки Транскрипция и трансляция. Генетическая трансформация
Транскрипция и трансляция. Генетическая трансформация Китообразные и ластоногие
Китообразные и ластоногие Породы кошек
Породы кошек Классификация и характеристика рыб
Классификация и характеристика рыб Строение клеток прокариот и эукариот
Строение клеток прокариот и эукариот Органы и системы органов
Органы и системы органов Мед - пчелиная заслуга
Мед - пчелиная заслуга Микробиология - наука о микроорганизмах
Микробиология - наука о микроорганизмах Карл Линней - основоположник биологической систематики
Карл Линней - основоположник биологической систематики Движение крови в организме. Органы кровообращения
Движение крови в организме. Органы кровообращения Приглашение на семинар по управлению инкубаторием компании Пас Реформ
Приглашение на семинар по управлению инкубаторием компании Пас Реформ Витамины красоты
Витамины красоты Внеклассное мероприятие Красная книга Оренбургской области
Внеклассное мероприятие Красная книга Оренбургской области