Содержание
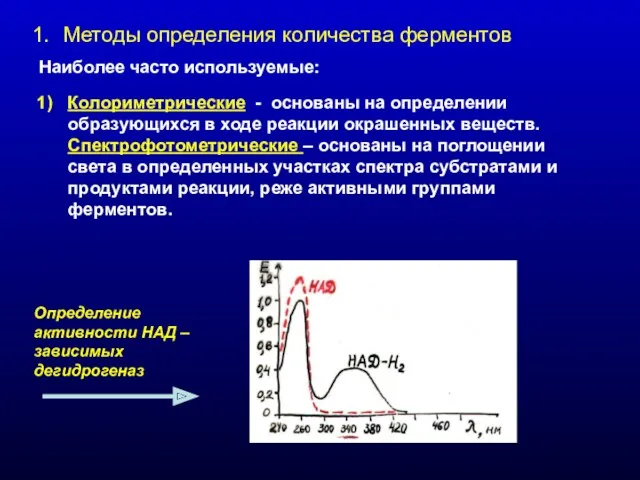
- 2. Методы определения количества ферментов Наиболее часто используемые: Колориметрические - основаны на определении образующихся в ходе реакции
- 3. 2. Способы выражения активности ферментов. Используются 2 основные единицы: КАТАЛ – такое количество фермента, которое может
- 4. 3. Кинетика ферментативных реакций Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов)
- 5. Зависимость скорости от вида субстрата. Ферменты обладают избирательностью действия - специфичность действия: 1 – Абсолютная специфичность.
- 6. 2 – Относительная специфичность ( объясняется тем, что, активный центр ферментов, обладаю-щих относительной специфичностью не жесткая
- 7. 2) Влияние [S] на скорость реакции. Теоретический график зависимости скорости ферментативной реакции от концентрации субстрата при
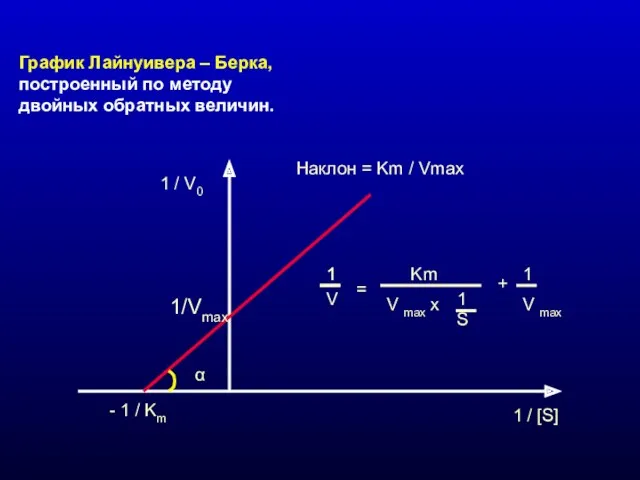
- 8. График Лайнуивера – Берка, построенный по методу двойных обратных величин. 1 / V0 1 / [S]
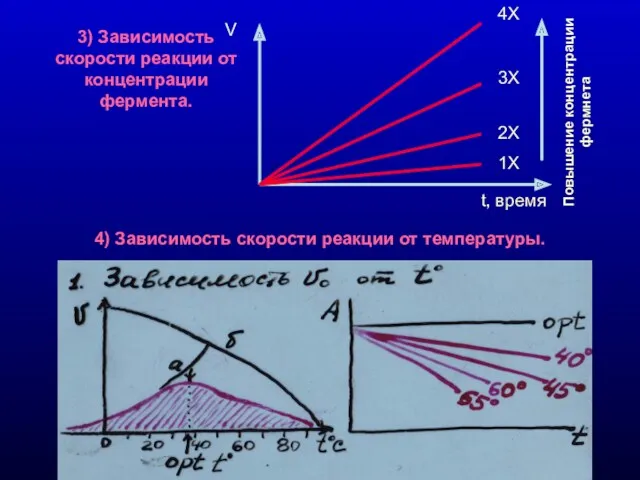
- 9. 3) Зависимость скорости реакции от концентрации фермента. 4) Зависимость скорости реакции от температуры. 4Х 3Х 2Х
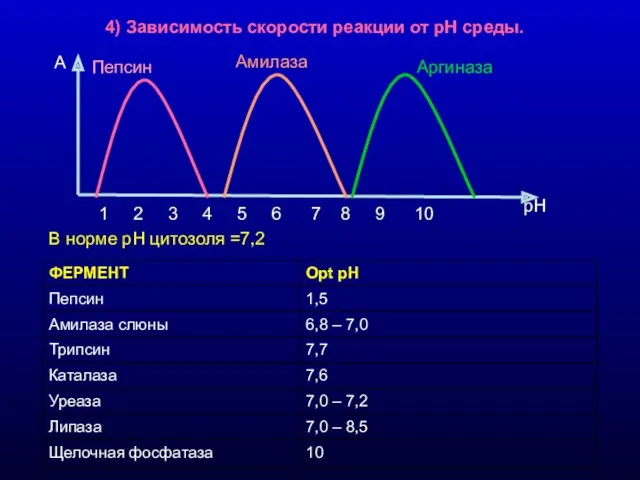
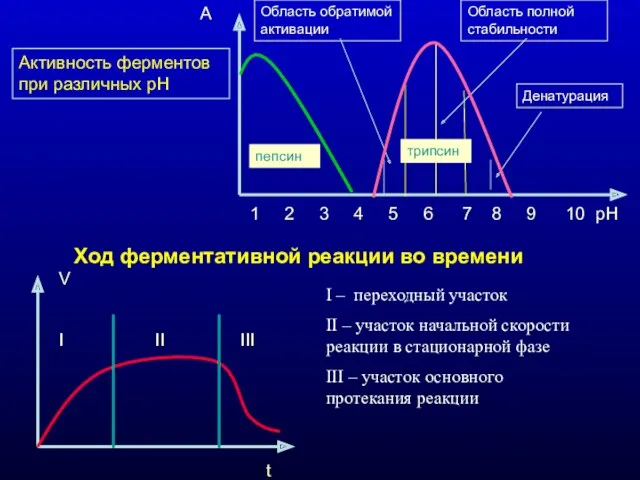
- 10. 4) Зависимость скорости реакции от рН среды. В норме рН цитозоля =7,2 1 2 3 4
- 11. Активность ферментов при различных рН 1 2 3 4 5 6 7 8 9 10 рН
- 12. Влияние различных веществ на активность ферментов АКТИВАТОРЫ ФЕРМЕНТОВ 1.1. Активация ферментов ионами металлов Ионы Mg+2, Mn+2,
- 13. Механизм активации ферментов металлами 1. В состав активного центра: Н2О + СО2 Н2СО3 Е + Ме
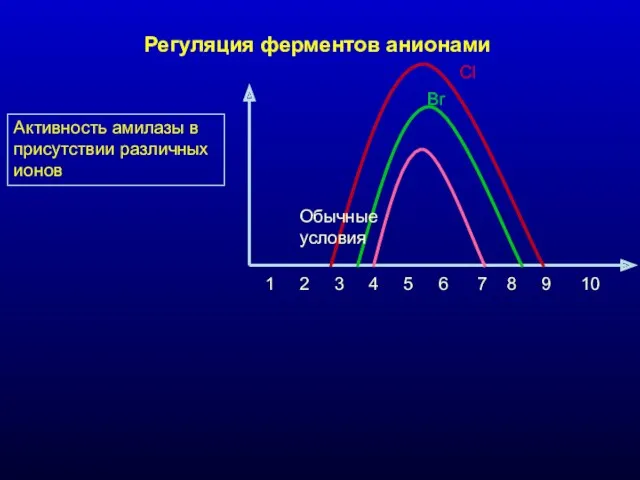
- 14. Активность амилазы в присутствии различных ионов Cl Br 1 2 3 4 5 6 7 8
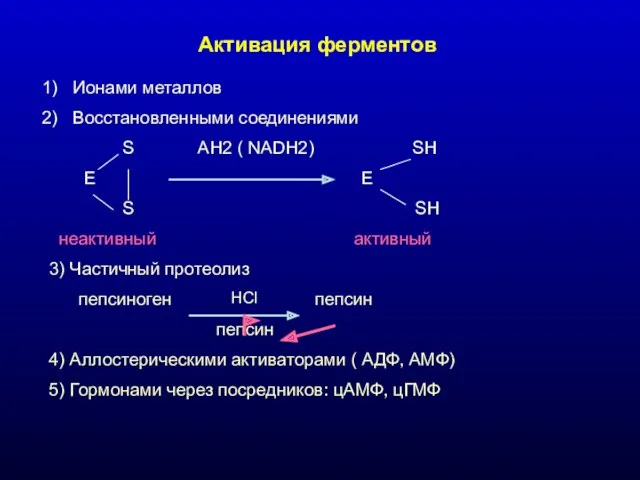
- 15. Активация ферментов Ионами металлов Восстановленными соединениями S AH2 ( NADH2) SH E E S SH неактивный
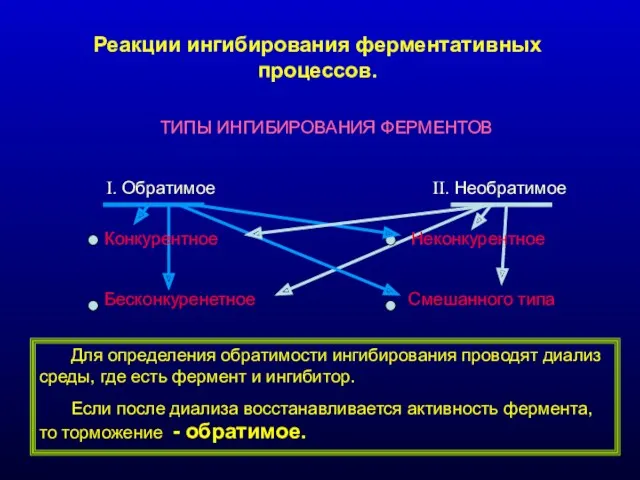
- 16. Реакции ингибирования ферментативных процессов. ТИПЫ ИНГИБИРОВАНИЯ ФЕРМЕНТОВ I. Обратимое II. Необратимое Конкурентное Неконкурентное Бесконкуренетное Смешанного типа
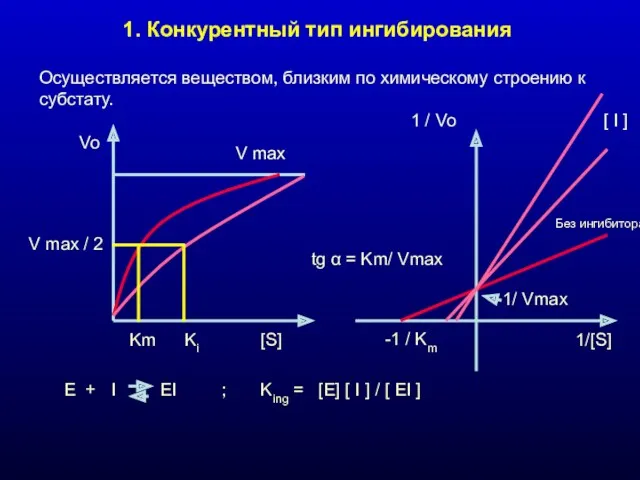
- 17. 1. Конкурентный тип ингибирования Осуществляется веществом, близким по химическому строению к субстату. V max Vo [S]
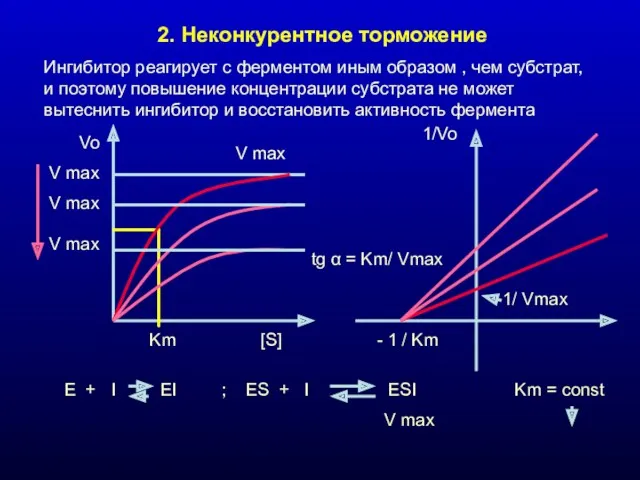
- 18. 2. Неконкурентное торможение Ингибитор реагирует с ферментом иным образом , чем субстрат, и поэтому повышение концентрации
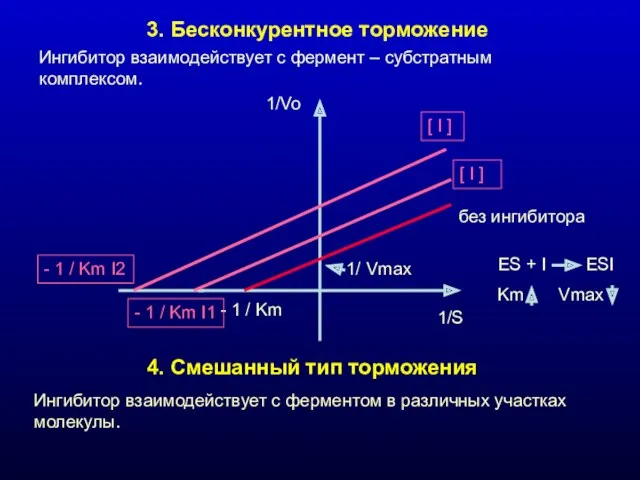
- 19. 3. Бесконкурентное торможение Ингибитор взаимодействует с фермент – субстратным комплексом. 4. Смешанный тип торможения Ингибитор взаимодействует
- 20. Ингибиторы взаимодействуют с ферментами различными путями, они могут: Блокировать активный центр фермента Менять четвертичную структуру фермента
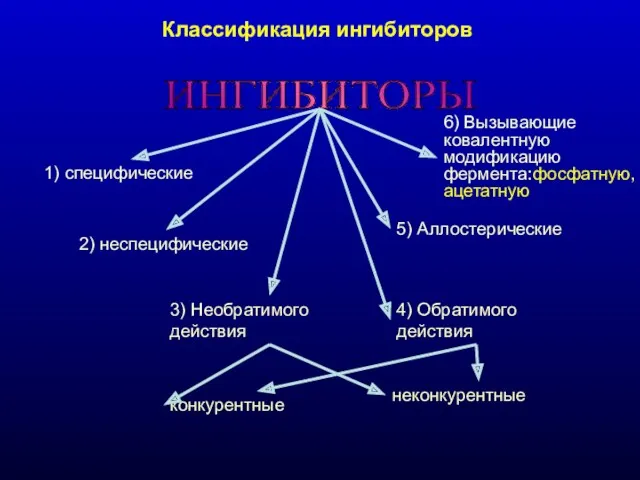
- 21. Классификация ингибиторов ИНГИБИТОРЫ 1) специфические 2) неспецифические 3) Необратимого действия конкурентные неконкурентные 4) Обратимого действия 5)
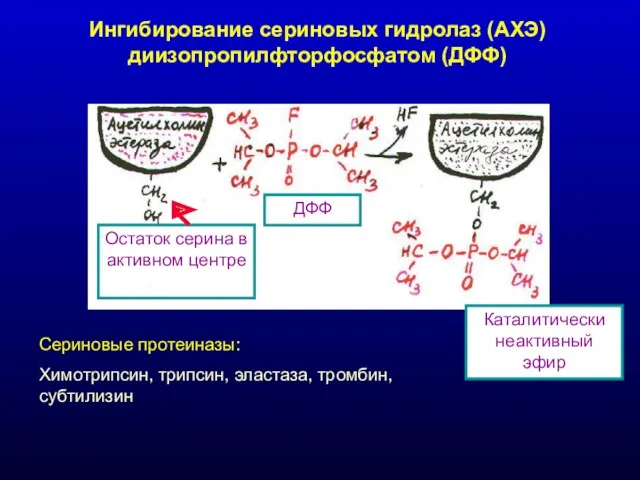
- 22. Ингибирование сериновых гидролаз (АХЭ) диизопропилфторфосфатом (ДФФ) Остаток серина в активном центре ДФФ Каталитически неактивный эфир Сериновые
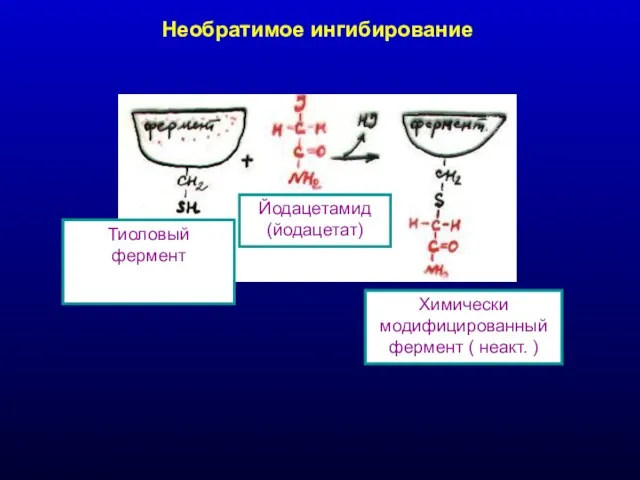
- 23. Необратимое ингибирование Химически модифицированный фермент ( неакт. ) Йодацетамид (йодацетат) Тиоловый фермент
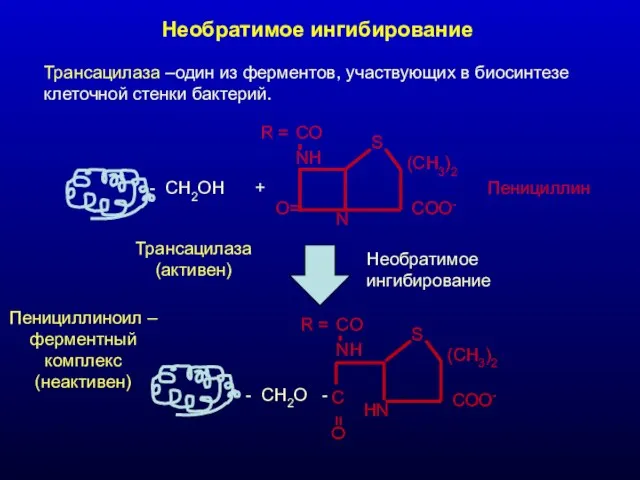
- 24. Необратимое ингибирование Трансацилаза –один из ферментов, участвующих в биосинтезе клеточной стенки бактерий. - CH2OH + Трансацилаза
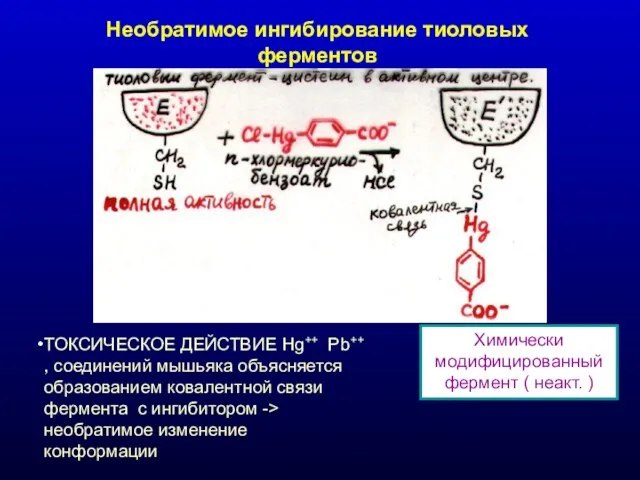
- 25. Необратимое ингибирование тиоловых ферментов Химически модифицированный фермент ( неакт. ) ТОКСИЧЕСКОЕ ДЕЙСТВИЕ Hg++ Pb++ , соединений
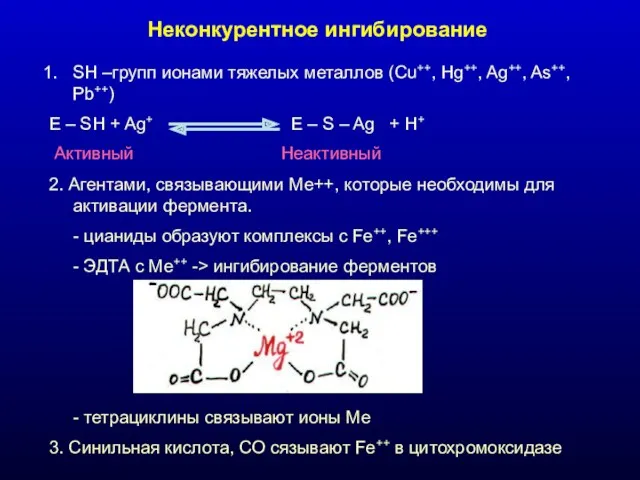
- 26. Неконкурентное ингибирование SH –групп ионами тяжелых металлов (Cu++, Hg++, Ag++, As++, Pb++) E – SH +
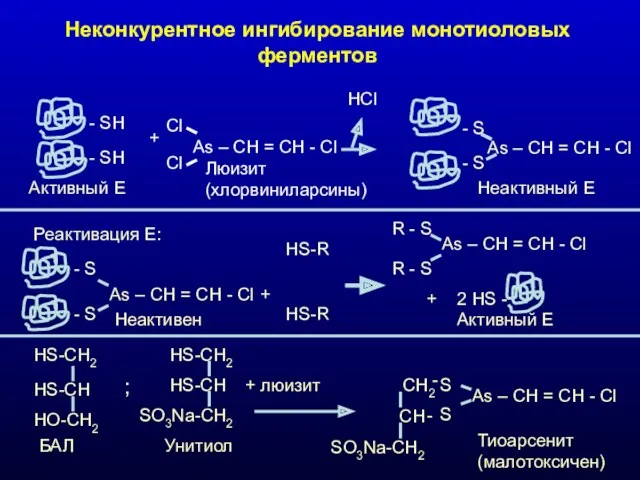
- 27. Неконкурентное ингибирование монотиоловых ферментов - SH - SH Активный Е + Cl As – CH =
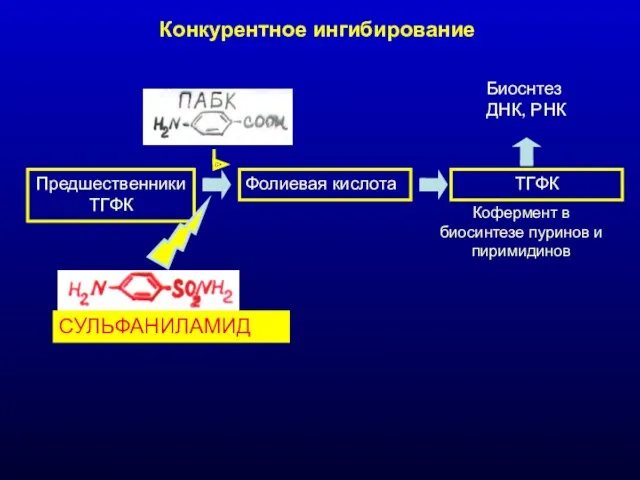
- 28. Конкурентное ингибирование ПредшественникиТГФК Фолиевая кислота ТГФК Биоснтез ДНК, РНК Кофермент в биосинтезе пуринов и пиримидинов СУЛЬФАНИЛАМИД
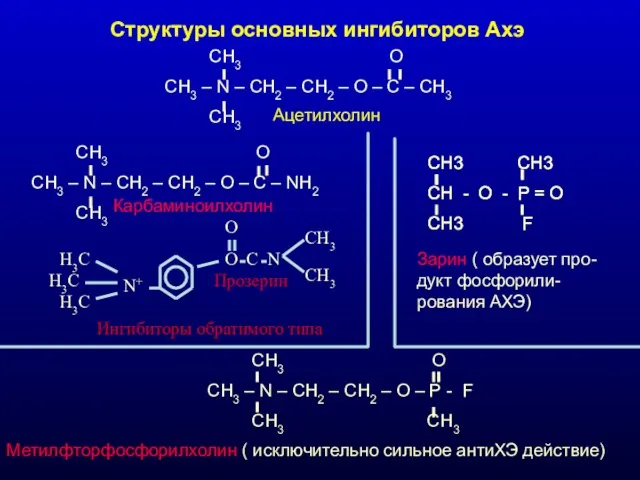
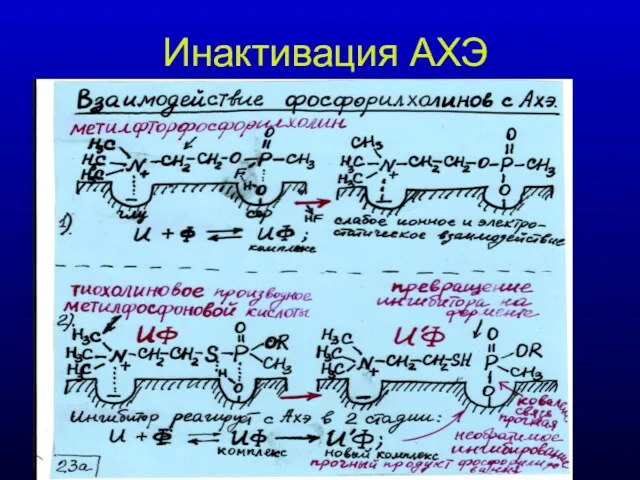
- 29. Структуры основных ингибиторов Ахэ CH3 O CH3 – N – CH2 – CH2 – O –
- 30. Инактивация АХЭ
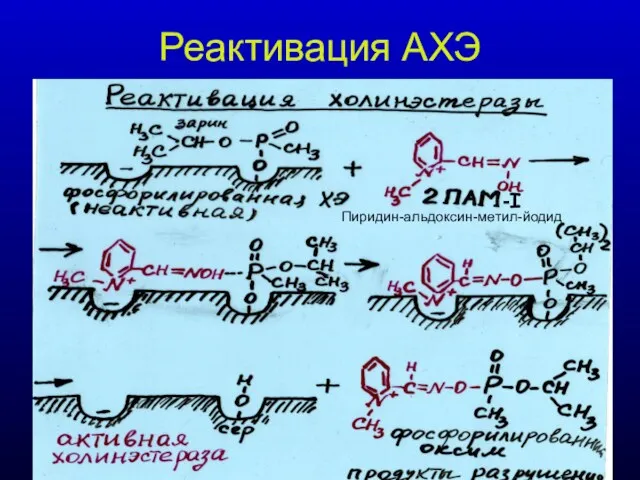
- 31. Реактивация АХЭ -I Пиридин-альдоксин-метил-йодид
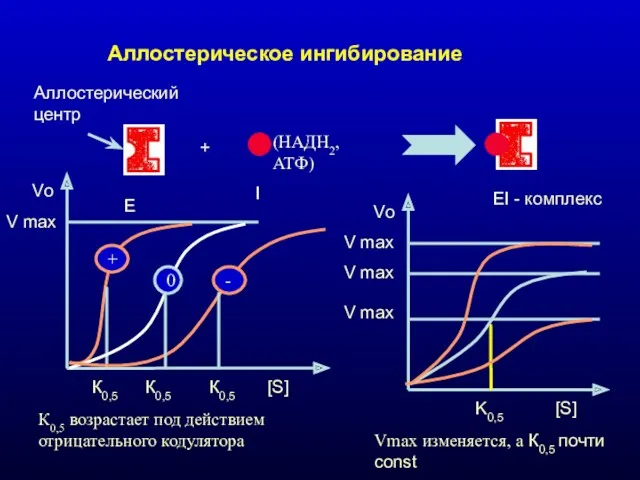
- 32. Аллостерическое ингибирование Е I EI - комплекс + Аллостерический центр (НАДН2, АТФ) V max Vo [S]
- 33. Фосфатная модификация ферментов Е - ОН Е – О – РО3Н2 АТФ АДФ гликогенсинтаза Неактивный фермент
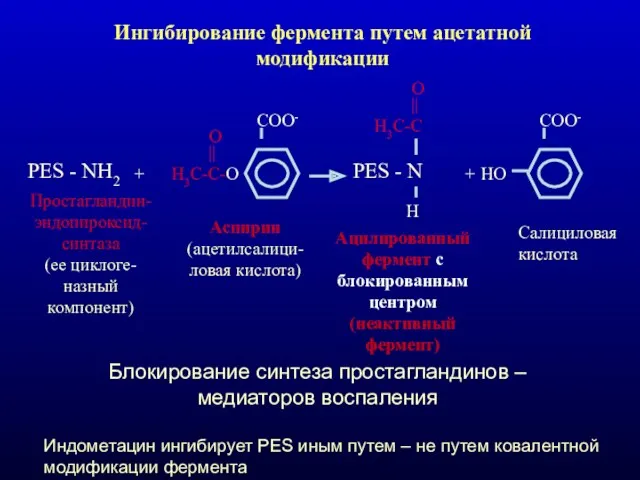
- 34. Ингибирование фермента путем ацетатной модификации PES - NH2 + Н3С-С-О || O COO- Простагландин-эндопироксид-синтаза (ее циклоге-назный
- 36. Скачать презентацию




![2) Влияние [S] на скорость реакции. Теоретический график зависимости скорости](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/432881/slide-6.jpg)




 Лекарственные растения слабительного действия
Лекарственные растения слабительного действия Онтогенез: индивидуальное развитие организма. Эмбриональный период
Онтогенез: индивидуальное развитие организма. Эмбриональный период Залози змішаної секреції, порушення діяльності та їх профілактика
Залози змішаної секреції, порушення діяльності та їх профілактика Пресмыкающиеся
Пресмыкающиеся Animal locomotion
Animal locomotion Тонкий кишечник
Тонкий кишечник игра Что Где Когда по биологии
игра Что Где Когда по биологии Микробиология как наука. История возникновения и развития микробиологии
Микробиология как наука. История возникновения и развития микробиологии Понятия геномики, транскриптомики, протеомики, метаболомики
Понятия геномики, транскриптомики, протеомики, метаболомики Биохимия мышечной ткани. (Лекция 21)
Биохимия мышечной ткани. (Лекция 21) Нетипичные мембраны. Мембраны архебактерий
Нетипичные мембраны. Мембраны архебактерий Лось, как представитель класса диких животных
Лось, как представитель класса диких животных Животные Красной Книги
Животные Красной Книги 5.02- 7кл внутреннее строение листа_
5.02- 7кл внутреннее строение листа_ Қалталылар отряды – Marsupiala
Қалталылар отряды – Marsupiala Класс двудольные. Семейство крестоцветные. Род капуста
Класс двудольные. Семейство крестоцветные. Род капуста Эндомембранная система растительной клетки
Эндомембранная система растительной клетки Половые клетки, особенности строения
Половые клетки, особенности строения Проектно-исследовательские технологии в эколого-биологической деятельности
Проектно-исследовательские технологии в эколого-биологической деятельности Основные схемы ухода за различными типами кожи
Основные схемы ухода за различными типами кожи Корисні бактерії
Корисні бактерії Подготовка к ЕГЭ по биологии (из опыта работы)
Подготовка к ЕГЭ по биологии (из опыта работы) Общая характеристика млекопитающих
Общая характеристика млекопитающих Братья наши меньшие
Братья наши меньшие Тварина - живий організм
Тварина - живий організм Факты о генетике
Факты о генетике Фізіологічні механізми та гігієна сну
Фізіологічні механізми та гігієна сну Психические процессы. Ощущение. Виды ощущений по локализации
Психические процессы. Ощущение. Виды ощущений по локализации