Содержание
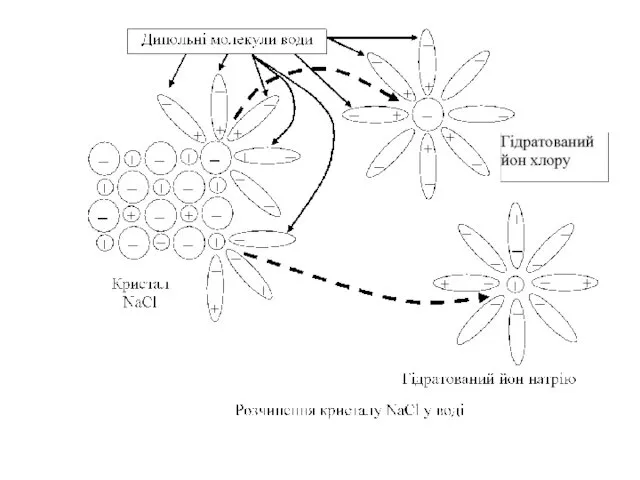
- 3. Ступінь дисоціації концентрація молекул, що розпались на іони; загальна концентрація розчинених молекул. Ступінь дисоціації зростає при
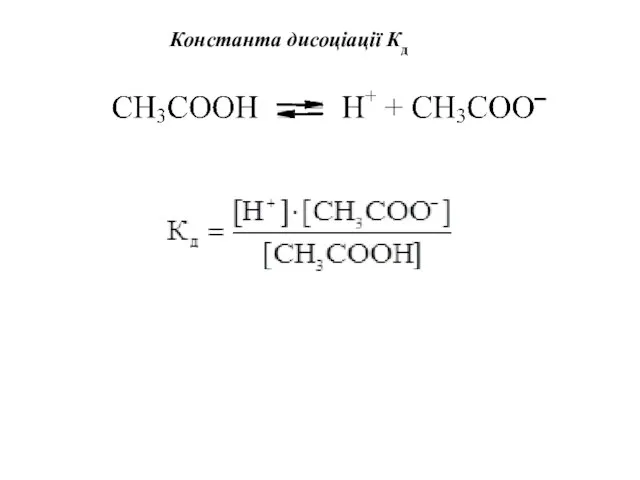
- 4. Константа дисоціації Кд
- 5. Закон розведення Оствальда: ступінь дисоціації слабкого бінарного електроліту зростає при розведенні розчину.
- 6. a(X)– активність йонів X; f – коефіцієнт активності; c(X) – молярна концентрація йонів X. Для дуже
- 7. Йонна сила розчину μ - кількісна характеристика електростатичної взаємодії йонів. Дорівнює напівсумі добутків моляльності кожного з
- 8. Дисоціація води H+ + H2O ⇄ H3O+, катіон гідроксонію 2H2O ⇄ H3O+ + OH‾. Н2O ⇄
- 9. Молярна концентрація [H+]∙[OH‾] = 1,8∙10-16моль/л∙55,56моль/л = 1∙10-14 моль2/л2. K H2O = [H+]∙[OH‾] = 10-14 моль2/л2 (298
- 10. Водневий показник pH = -lg[H+]. Гідроксидний показник рОН = -lg[OH‾]. pH + pOH = 14. [H+]∙[OH‾]
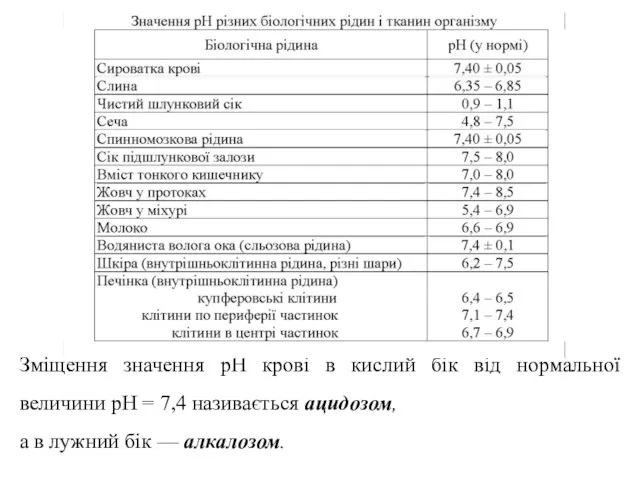
- 11. Зміщення значення рН крові в кислий бік від нормальної величини рН = 7,4 називається ацидозом, а
- 12. Буферними називають розчини, які мають властивість досить стійко зберігати сталість рН при розведенні, а також протидіяти
- 13. Кислотний Оцтовий буферний розчин CH3COOH ⇄ CH3COO‾ + H+. CH3COONa → CH3COO‾ + Na+. HCl→ H+
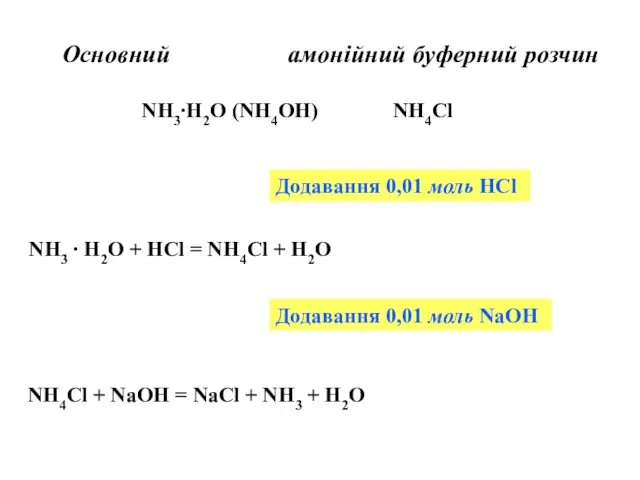
- 14. Основний амонійний буферний розчин NH3∙H2O (NH4OH) NH4Cl Додавання 0,01 моль НСl NH3 ∙ H2O + HCl
- 15. рівняння Гендерсона-Гассельбаха для кислотного буферного розчину : рівняння Гендерсона-Гассельбаха для основного буферного розчину :
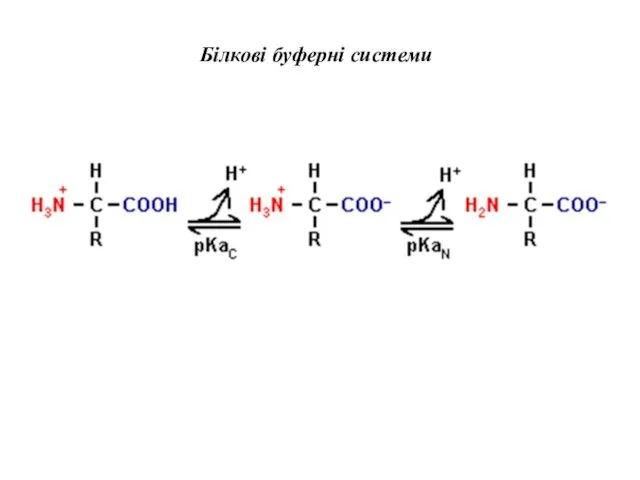
- 16. Білкові буферні системи
- 17. Гідрогенкарбонатна (бікарбонатна) буферна система H2CO3 ⇄ HCO3‾ + H+. Na HCO3→ HCO3‾ + Na+. HCl→ H+
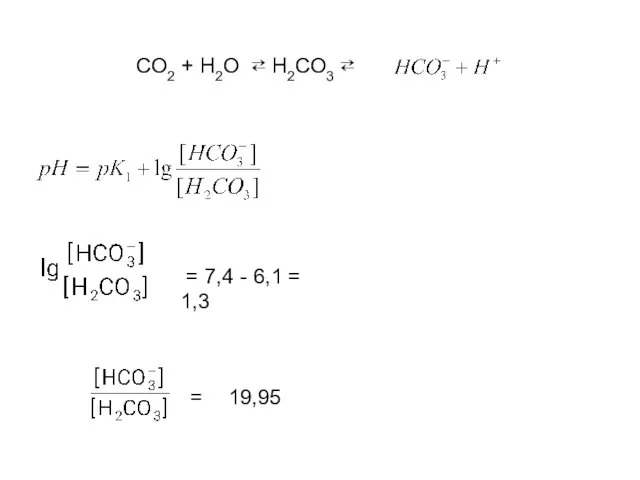
- 18. СО2 + Н2О ⇄ Н2СО3 ⇄ = = 7,4 - 6,1 = 1,3 19,95
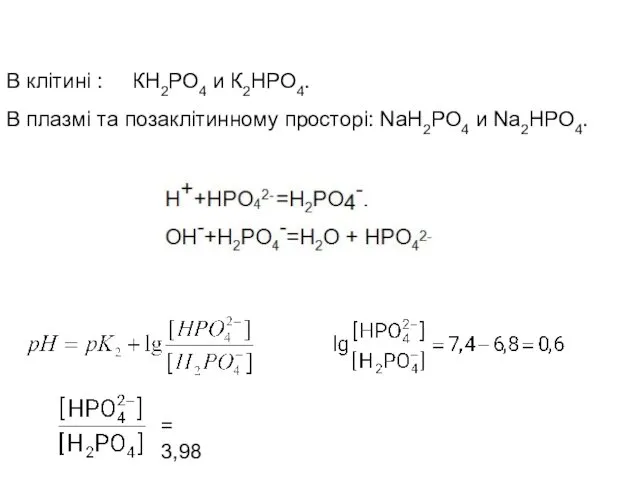
- 19. NaH2PO4 → Na+ + H2PO4‾ Na2HPO4 → 2Na+ + HPO42- HCl→ H+ +Cl- Na2HPO4 + HCl
- 20. В клітині : КН2РО4 и К2НРО4. В плазмі та позаклітинному просторі: NaH2PO4 и Na2HPO4. = 3,98
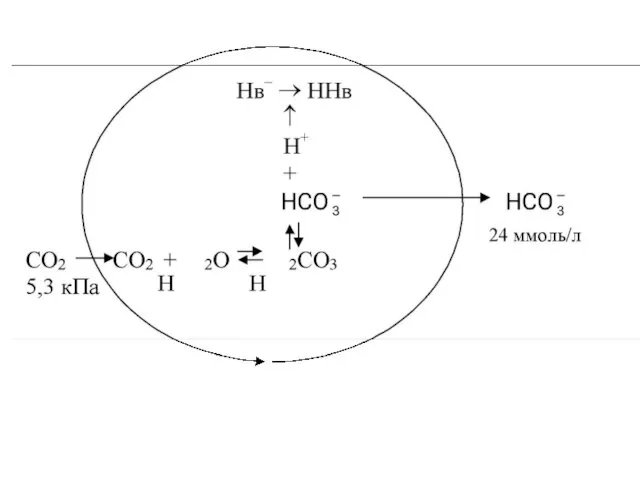
- 21. Гемоглобінова буферна система в еритроцитах HHb + O2 ⇄ HHbО2. HHb ⇄ H+ + Hb‾ KtHb
- 23. Буферна ємність (В) - кількість молей еквіваленту сильної кислоти або сильної основи, які потрібно додати до
- 25. Скачать презентацию





![Молярна концентрація [H+]∙[OH‾] = 1,8∙10-16моль/л∙55,56моль/л = 1∙10-14 моль2/л2. K H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/4807/slide-8.jpg)
![Водневий показник pH = -lg[H+]. Гідроксидний показник рОН = -lg[OH‾].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/4807/slide-9.jpg)







 Витамины. Определение, классификация
Витамины. Определение, классификация Информационная биология. Семантическая и прагматическая информация. (Тема 5)
Информационная биология. Семантическая и прагматическая информация. (Тема 5) Круги кровообращения
Круги кровообращения Строение нервной системы. Спинной мозг
Строение нервной системы. Спинной мозг ЕГЭ по биологии
ЕГЭ по биологии Физиология центральной нервной системы
Физиология центральной нервной системы Осенние приметы. (Урок 15. 1 класс)
Осенние приметы. (Урок 15. 1 класс) Открытый урок биологии по теме Движение 6 класс (УМК Н.И.Сонин) , автор учитель биологии Сизова С.В.
Открытый урок биологии по теме Движение 6 класс (УМК Н.И.Сонин) , автор учитель биологии Сизова С.В. Класс Пресмыкающиеся или Рептилии (Reptilia)
Класс Пресмыкающиеся или Рептилии (Reptilia) Фотосинтез
Фотосинтез Организм человека. Анатомия человека
Организм человека. Анатомия человека Биология кошек
Биология кошек Технология выращивания томатов
Технология выращивания томатов Теории происхождения человека
Теории происхождения человека Породи свиней
Породи свиней Бактериологическая разведка и индикация бактериологического (биологического) оружия
Бактериологическая разведка и индикация бактериологического (биологического) оружия Методы оценки биоразнообразия
Методы оценки биоразнообразия Размножение и развитие земноводных. Сезонные явления в жизни земноводных
Размножение и развитие земноводных. Сезонные явления в жизни земноводных Мал азықтық жемдік дақылдар
Мал азықтық жемдік дақылдар Газообмен в легких и тканях. Дыхательные движения. Регуляция дыхания
Газообмен в легких и тканях. Дыхательные движения. Регуляция дыхания Бабочки
Бабочки Нуклеиновые кислоты
Нуклеиновые кислоты Молекулярные механизмы образования хромосомных перестроек с учетом структурной организации хромосомных районов
Молекулярные механизмы образования хромосомных перестроек с учетом структурной организации хромосомных районов Царство грибы. Общая характеристика
Царство грибы. Общая характеристика презентация к уроку биологии в 8 классе
презентация к уроку биологии в 8 классе Изготовление компоста из листьев
Изготовление компоста из листьев Гепард — хищное млекопитающее семейства кошачьих
Гепард — хищное млекопитающее семейства кошачьих Внутреннее строение корня
Внутреннее строение корня