Содержание
- 2. Классификация мутаций При хромосомных мутациях происходят как изменение числа отдельных хромосом в геноме (анеуплоидия), так и
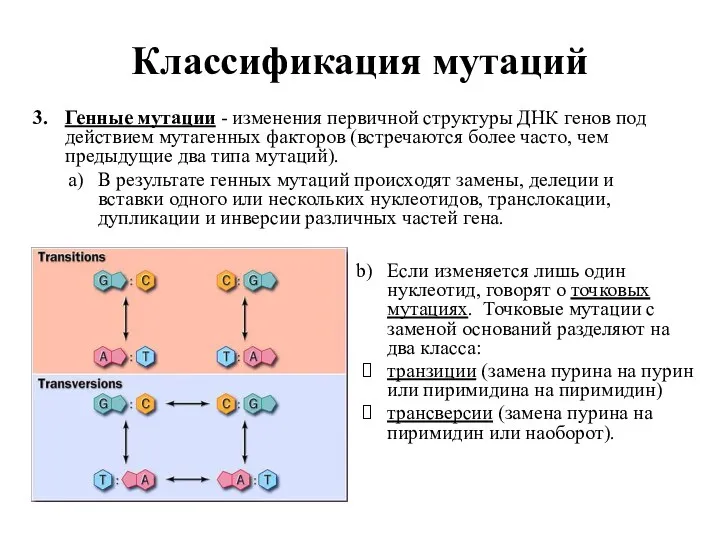
- 3. Классификация мутаций Генные мутации - изменения первичной структуры ДНК генов под действием мутагенных факторов (встречаются более
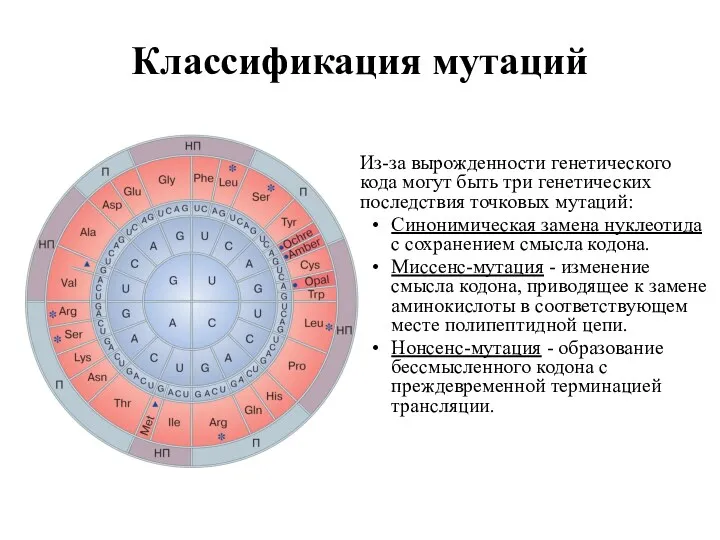
- 4. Классификация мутаций Из-за вырожденности генетического кода могут быть три генетических последствия точковых мутаций: Синонимическая замена нуклеотида
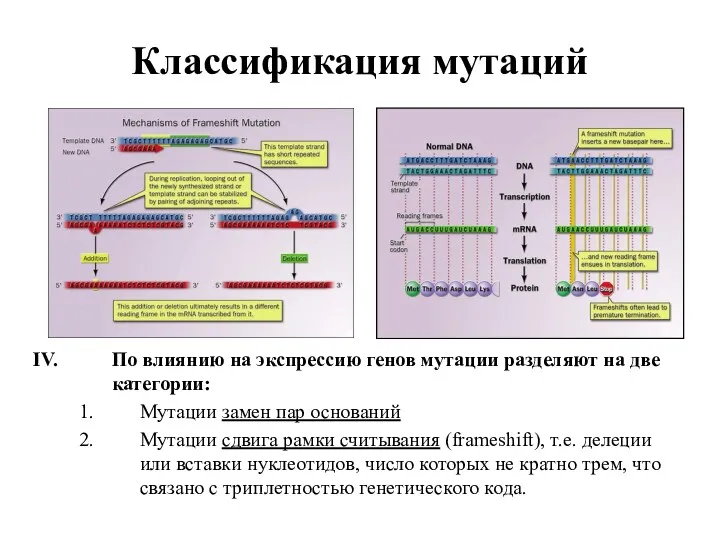
- 5. Классификация мутаций По влиянию на экспрессию генов мутации разделяют на две категории: Мутации замен пар оснований
- 6. Повреждение ДНК
- 7. Повреждения ДНК Появление различно модифицированных оснований: Пиримидиновые димеры. Алкилированые производные. Дезаминированые основания. Различные таутомерные формы. Появление
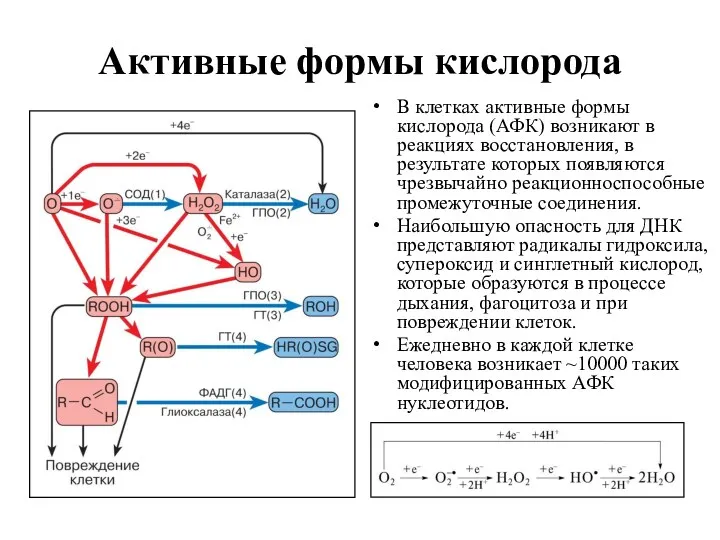
- 8. Активные формы кислорода В клетках активные формы кислорода (АФК) возникают в реакциях восстановления, в результате которых
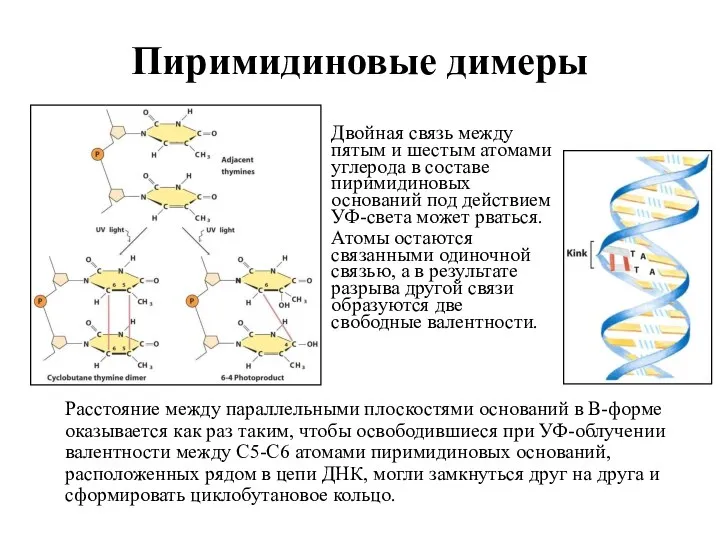
- 9. Пиримидиновые димеры Расстояние между параллельными плоскостями оснований в В-форме оказывается как раз таким, чтобы освободившиеся при
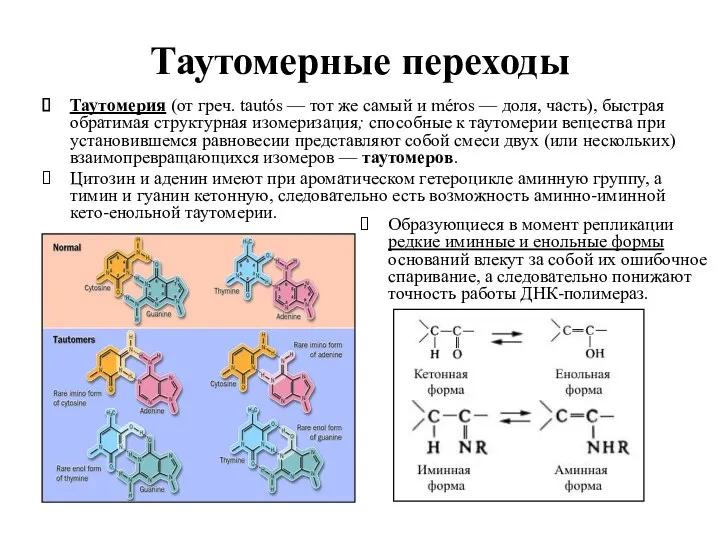
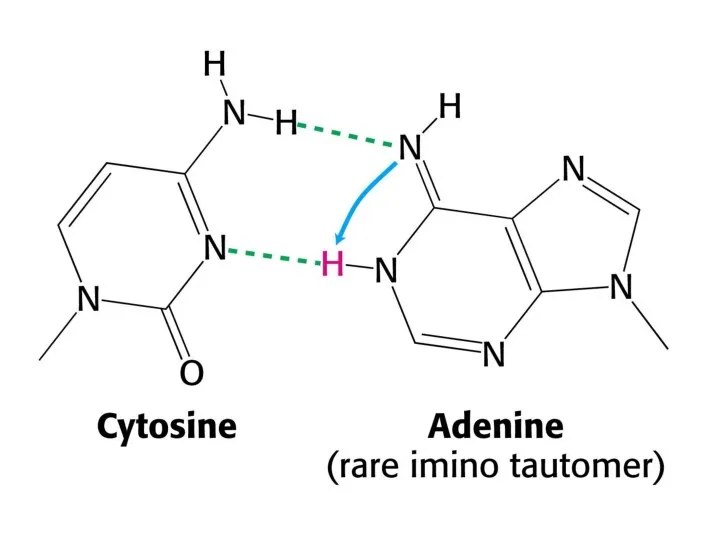
- 10. Таутомерные переходы Таутомерия (от греч. tautós — тот же самый и méros — доля, часть), быстрая
- 12. Разнообразие систем репарации Существует огромное количество самых различных систем репарации. Все эти системы появлялись в эволюции
- 13. Разнообразие систем репарации Прямая репарация: Фотореактивация. Дезалкилирование модифицированных нуклеотидов. Сшивание однонитевых разрывов. Прямая вставка оснований в
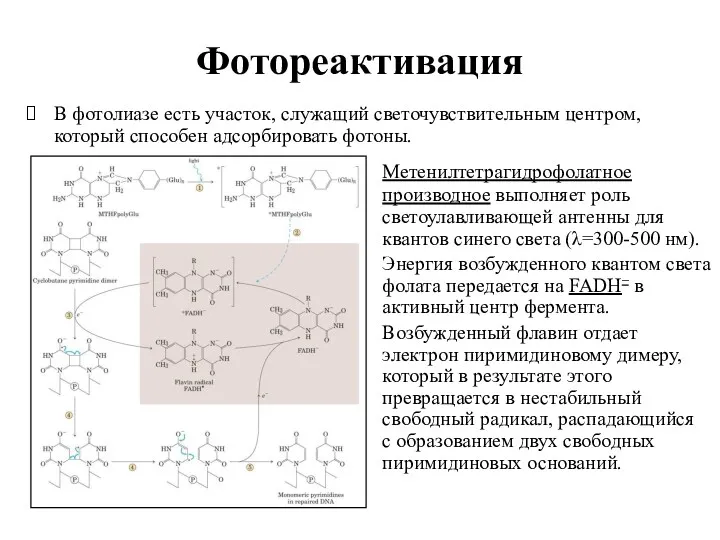
- 14. Фотореактивация В фотолиазе есть участок, служащий светочувствительным центром, который способен адсорбировать фотоны. Метенилтетрагидрофолатное производное выполняет роль
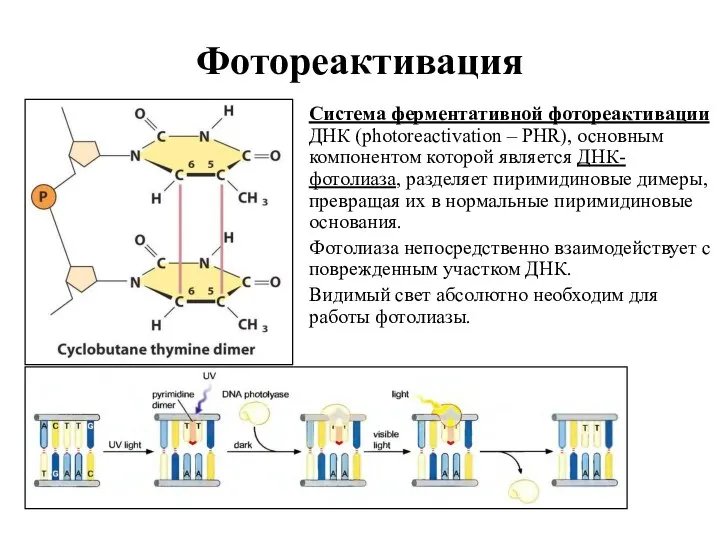
- 15. Фотореактивация Система ферментативной фотореактивации ДНК (photoreactivation – PHR), основным компонентом которой является ДНК-фотолиаза, разделяет пиримидиновые димеры,
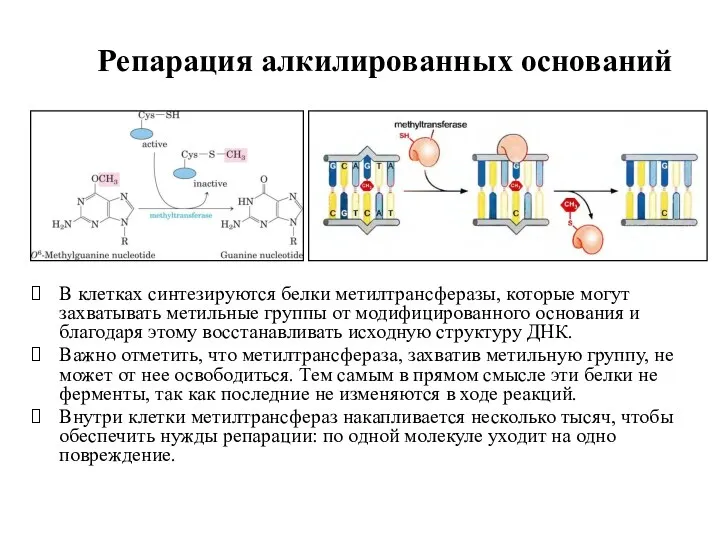
- 16. Репарация алкилированных оснований В клетках синтезируются белки метилтрансферазы, которые могут захватывать метильные группы от модифицированного основания
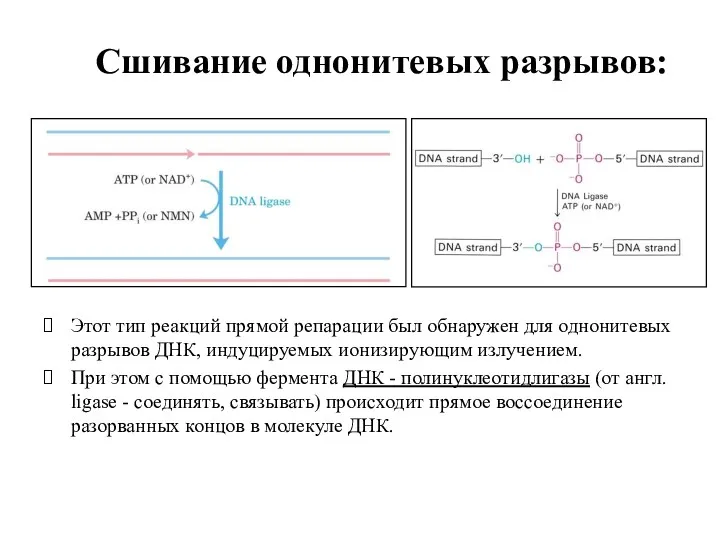
- 17. Сшивание однонитевых разрывов: Этот тип реакций прямой репарации был обнаружен для однонитевых разрывов ДНК, индуцируемых ионизирующим
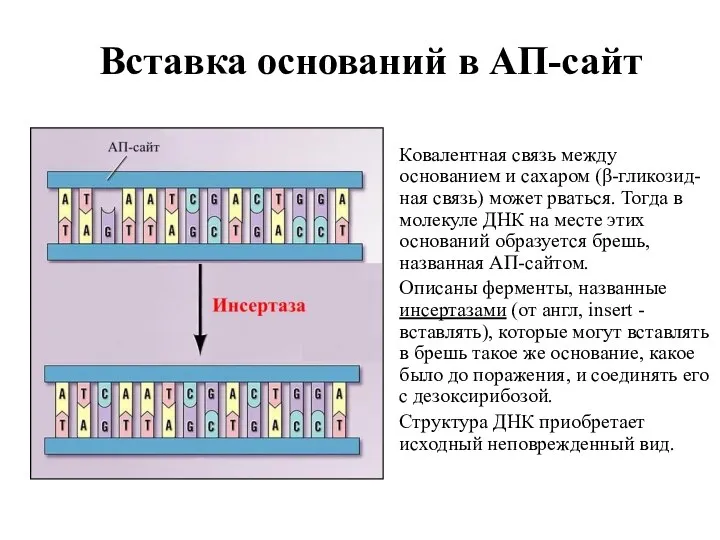
- 18. Вставка оснований в АП-сайт Ковалентная связь между основанием и сахаром (β-гликозид-ная связь) может рваться. Тогда в
- 19. Эксцизионная репарация ДНК путем удаления поврежденных азотистых оснований (BER)
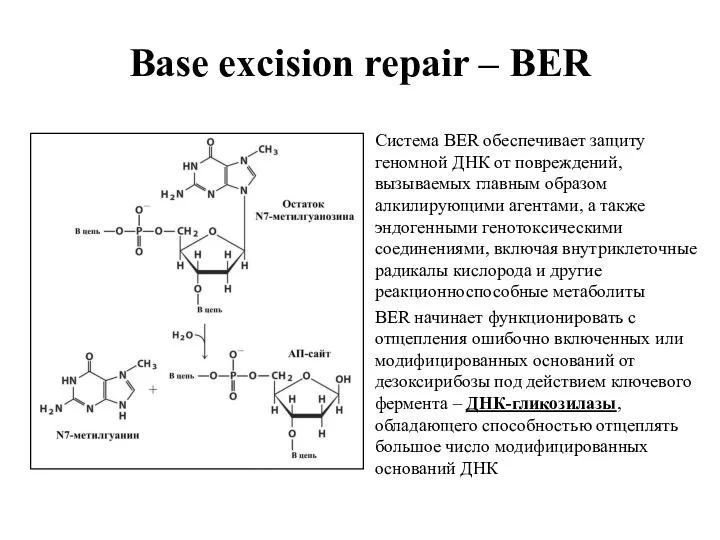
- 20. Base excision repair – BER Система BER обеспечивает защиту геномной ДНК от повреждений, вызываемых главным образом
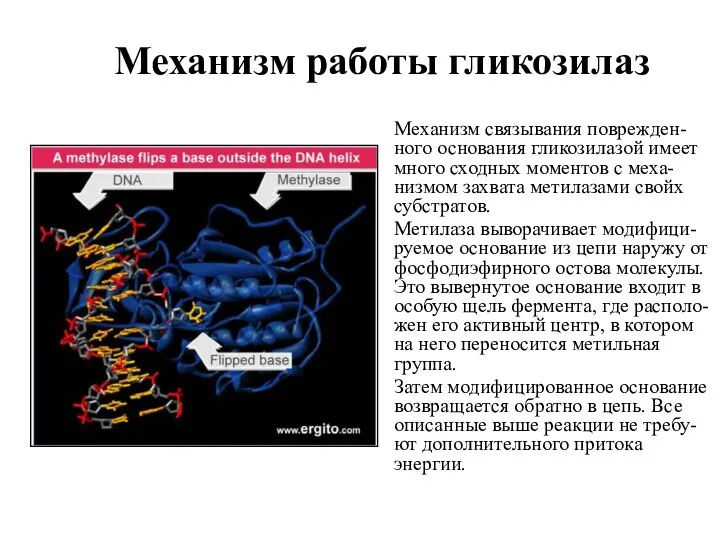
- 21. Механизм работы гликозилаз Механизм связывания поврежден-ного основания гликозилазой имеет много сходных моментов с меха-низмом захвата метилазами
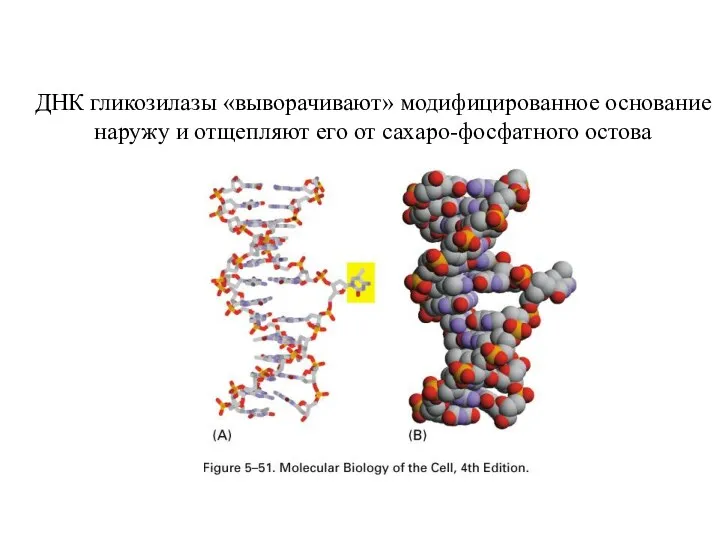
- 22. ДНК гликозилазы «выворачивают» модифицированное основание наружу и отщепляют его от сахаро-фосфатного остова
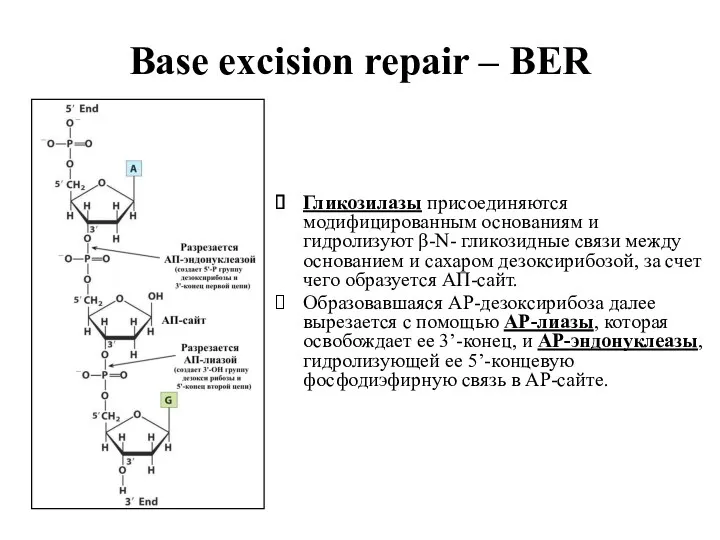
- 23. Base excision repair – BER Гликозилазы присоединяются модифицированным основаниям и гидролизуют β-N- гликозидные связи между основанием
- 24. Base excision repair – BER Появившаяся брешь в одной цепи ДНК размером в один нуклеотид застраивается
- 25. Эксцизионная репарация ДНК путем удаления нуклеотидов (NER)
- 26. Nucleotide excision repair – NER Процесс NER условно можно разделить на четыре этапа: Распознавание поврежденного участка
- 27. Nucleotide excision repair – NER В отличии от BER, субстратами системы NER являются не только поврежденные
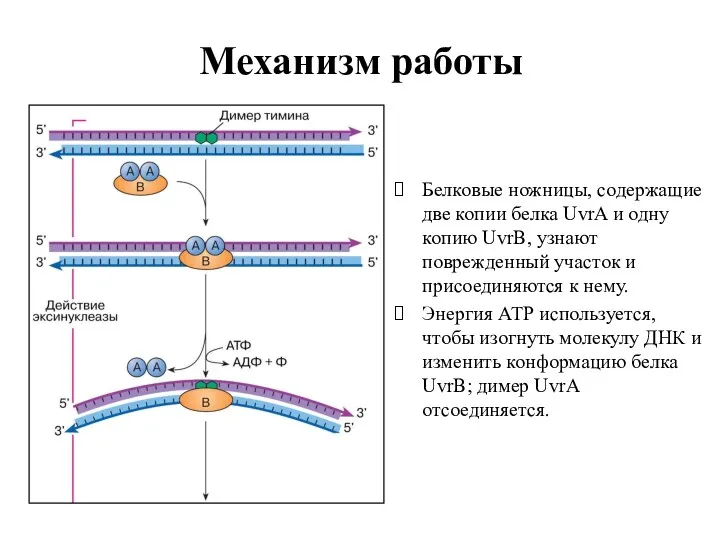
- 28. Механизм работы Белковые ножницы, содержащие две копии белка UvrA и одну копию UvrB, узнают поврежденный участок
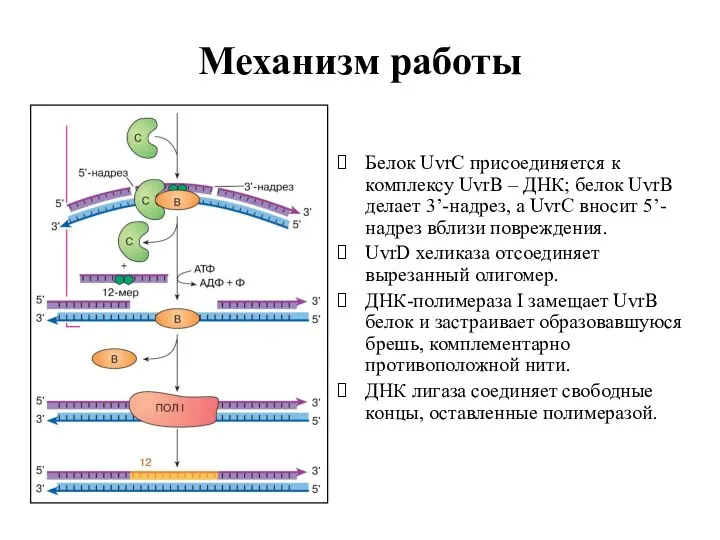
- 29. Механизм работы Белок UvrC присоединяется к комплексу UvrВ – ДНК; белок UvrВ делает 3’-надрез, а UvrC
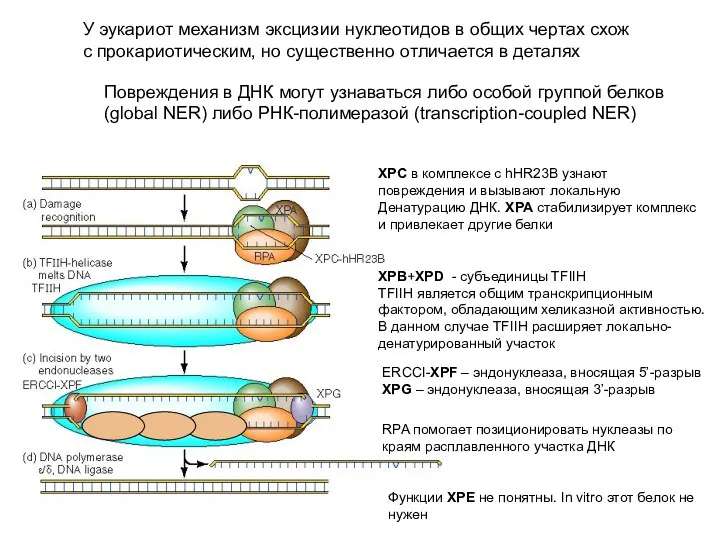
- 30. У эукариот механизм эксцизии нуклеотидов в общих чертах схож с прокариотическим, но существенно отличается в деталях
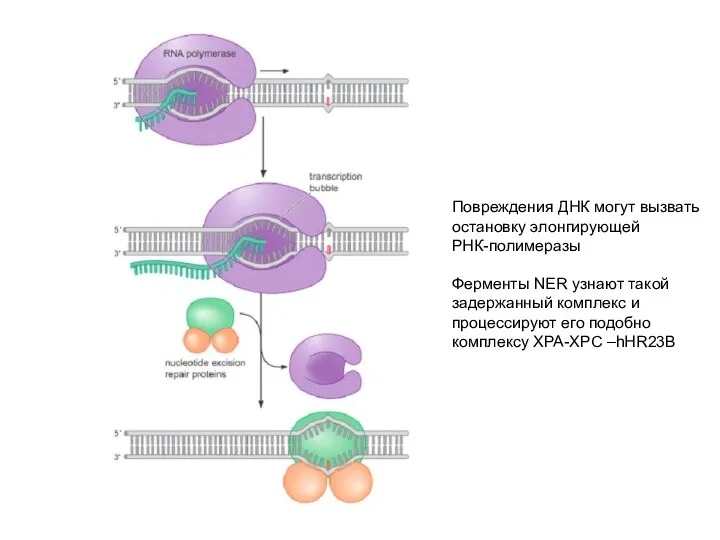
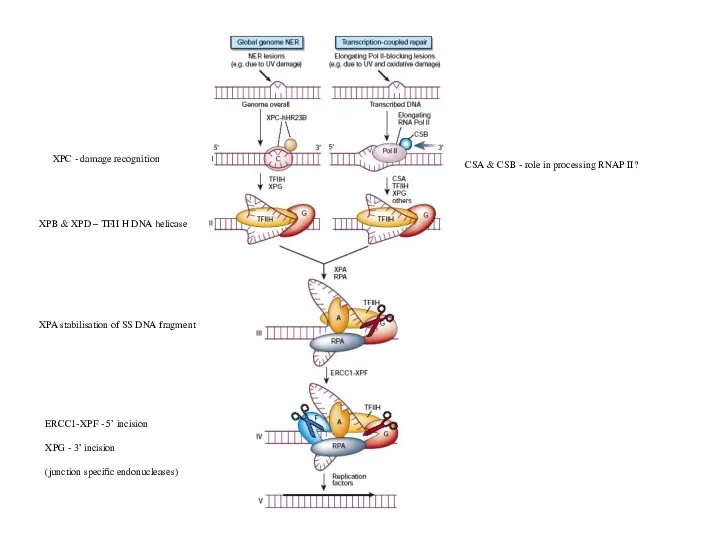
- 31. Повреждения ДНК могут вызвать остановку элонгирующей РНК-полимеразы Ферменты NER узнают такой задержанный комплекс и процессируют его
- 32. XPB & XPD – TFII H DNA helicase XPC - damage recognition XPA stabilisation of SS
- 33. Различия NER у про- и эукариот Гены NER у E. coli uvrA, uvrB и uvrC не
- 34. Репарация ошибочно спаренных нуклеотидов (MMR)
- 35. Mismatch repair - MMR В отличие от NER, так же удаляющей неправильно спаренные основания, MMR может
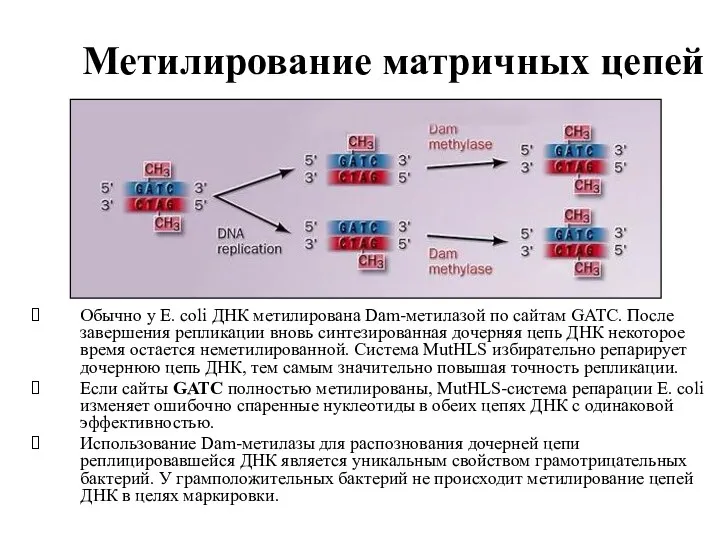
- 36. Метилирование матричных цепей Обычно у E. coli ДНК метилирована Dam-метилазой по сайтам GATC. После завершения репликации
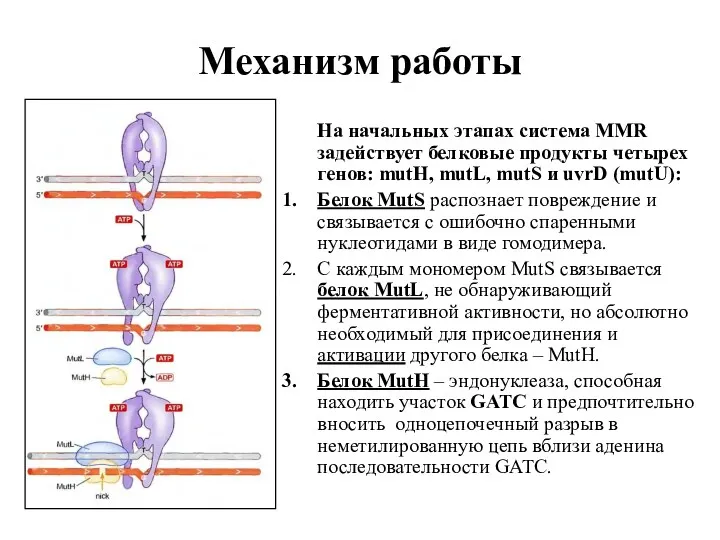
- 37. Механизм работы На начальных этапах система MMR задействует белковые продукты четырех генов: mutH, mutL, mutS и
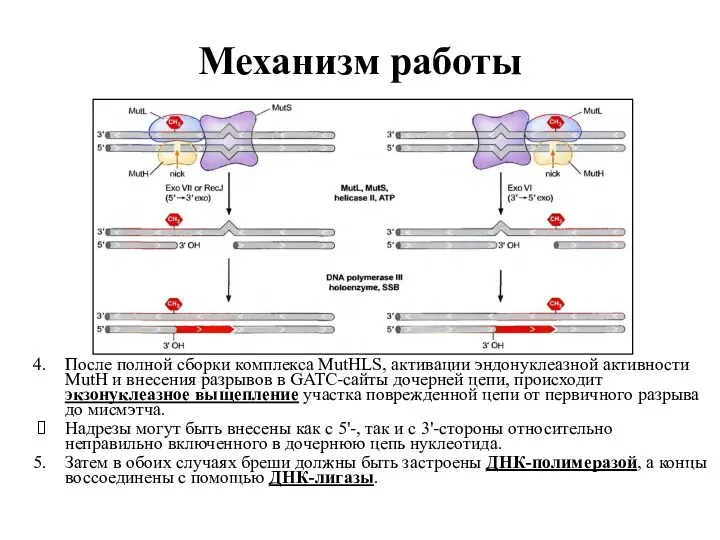
- 38. Механизм работы После полной сборки комплекса MutHLS, активации эндонуклеазной активности MutH и внесения разрывов в GATC-сайты
- 39. Другие системы У E. coli существуют два других специфических пути репарации ошибочно спаренных нуклеотидов: Система VSP
- 40. Механизмы рекомбинации днк у эукариот.
- 41. ГЕНЕТИЧЕСКАЯ РЕКОМБИНАЦИЯ – перераспределение материала между молекулами или внутри молекулы ДНК, приводящее к появлению новых комбинаций
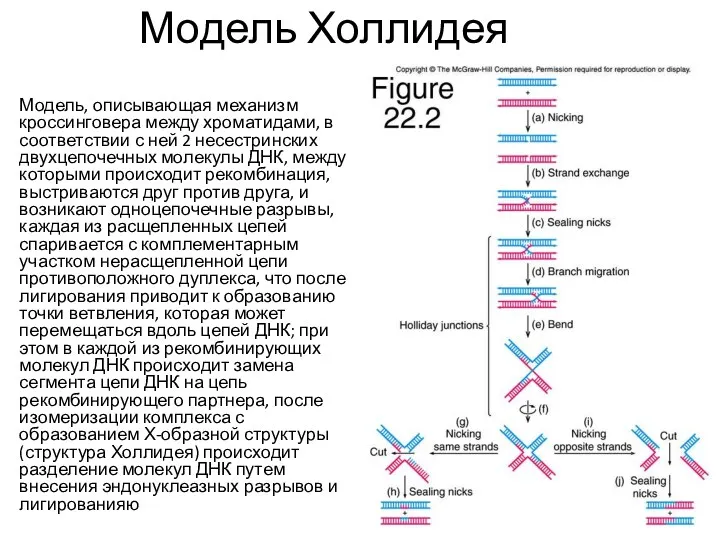
- 42. Модель Холлидея Модель, описывающая механизм кроссинговера между хроматидами, в соответствии с ней 2 несестринских двухцепочечных молекулы
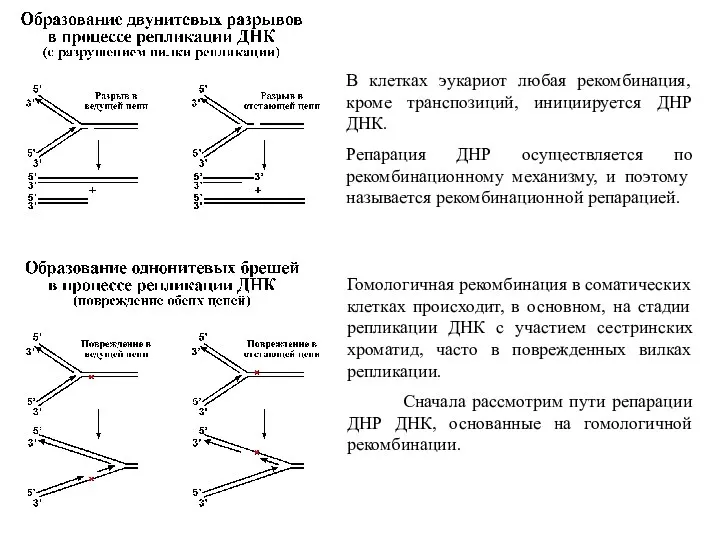
- 43. В клетках эукариот любая рекомбинация, кроме транспозиций, инициируется ДНР ДНК. Репарация ДНР осуществляется по рекомбинационному механизму,
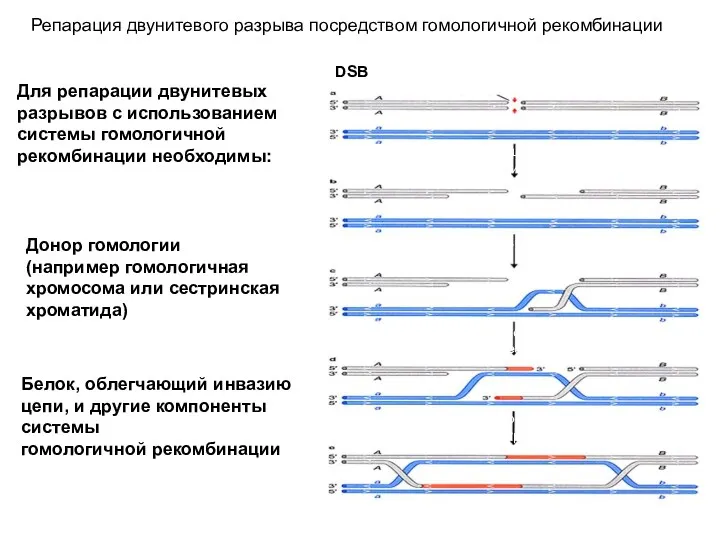
- 44. Репарация двунитевого разрыва посредством гомологичной рекомбинации DSB Процессирование концов экзонуклеазами; Создание выступающих 3’-концов Инвазия 3’-конца первой
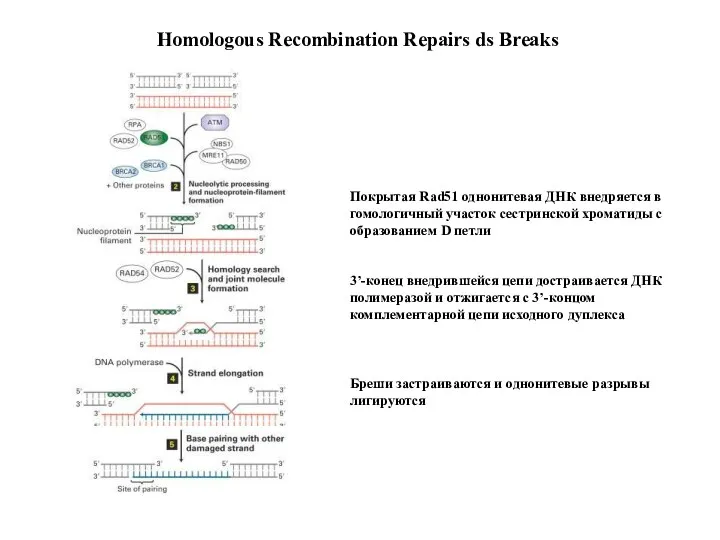
- 45. Покрытая Rad51 однонитевая ДНК внедряется в гомологичный участок сестринской хроматиды с образованием D петли 3’-конец внедрившейся
- 46. К НЕЗАКОННОЙ РЕКОМБИНАЦИИ относят рекомбинационные процессы, происходящие либо вообще без гомологии между рекомбинирующими участками ДНК, либо
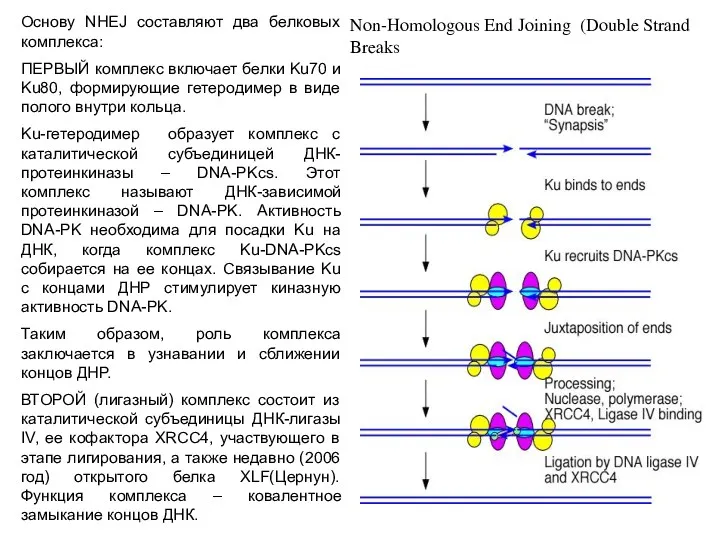
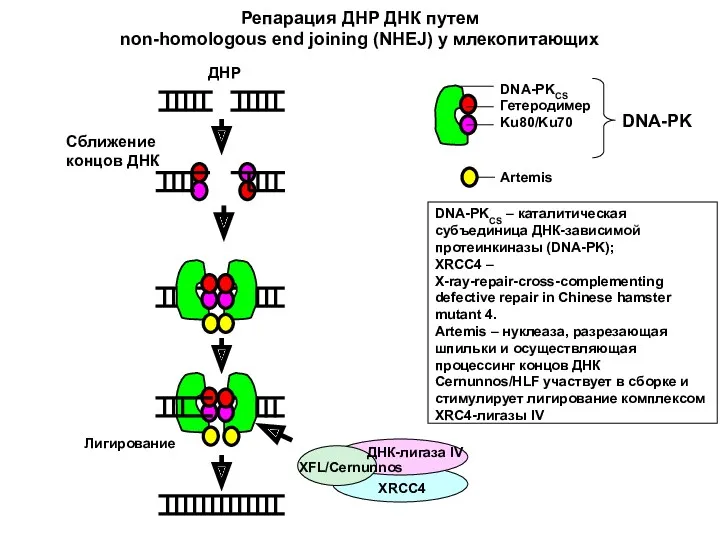
- 47. Основу NHEJ составляют два белковых комплекса: ПЕРВЫЙ комплекс включает белки Ku70 и Ku80, формирующие гетеродимер в
- 48. DNA-PKCS Гетеродимер Ku80/Ku70 Artemis Лигирование DNA-PKCS – каталитическая субъединица ДНК-зависимой протеинкиназы (DNA-PK); XRCC4 – X-ray-repair-cross-complementing defective
- 49. Транспозиции. В геномах эукариот широко распространены особые генетические элементы, способные перемещаться из одного участка генома в
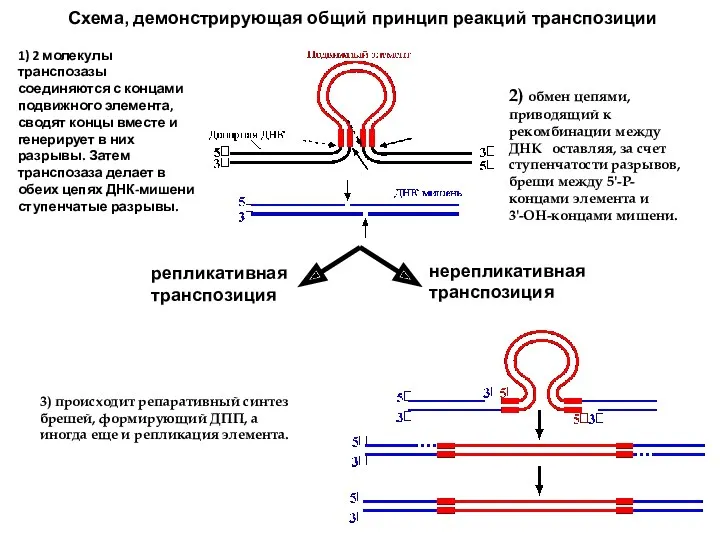
- 50. репликативная транспозиция нерепликативная транспозиция Схема, демонстрирующая общий принцип реакций транспозиции 1) 2 молекулы транспозазы соединяются с
- 51. Нерепликативная транспозиция заключается в вырезании элемента и его перемещении в новое место. При этом 2 молекулы
- 53. Скачать презентацию



















 Введение в общую биологию
Введение в общую биологию презентация к уроку биологии 7 класс
презентация к уроку биологии 7 класс Введение в курс Общей биологии
Введение в курс Общей биологии Дыхательная система
Дыхательная система Физиология дыхания
Физиология дыхания Использование материалов аэро - и космических съемок для целей сельского хозяйства. Исследования почвенного покрова земли
Использование материалов аэро - и космических съемок для целей сельского хозяйства. Исследования почвенного покрова земли Класс Земноводные, или Амфибии
Класс Земноводные, или Амфибии Развитие вирусных, бактериальных и грибковых заболеваний сельскохозяйственных видов
Развитие вирусных, бактериальных и грибковых заболеваний сельскохозяйственных видов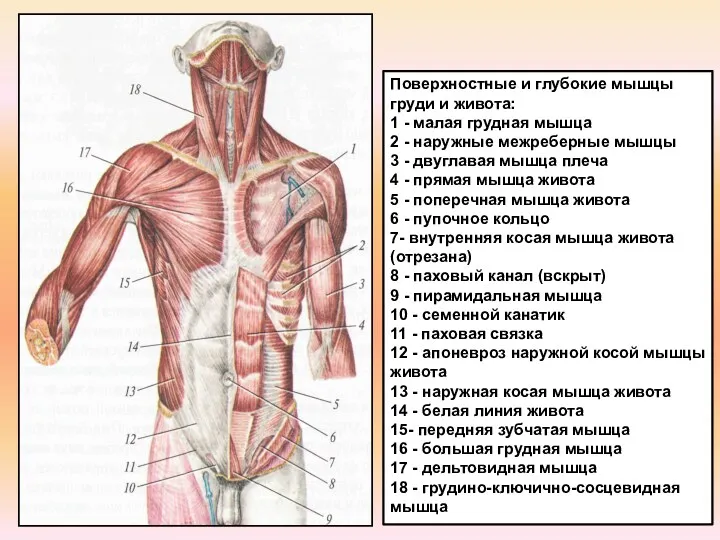 Поверхностные и глубокие мышцы груди и живота
Поверхностные и глубокие мышцы груди и живота Птицы. Фотографии
Птицы. Фотографии Свойства белков. Преврщение белков в организме
Свойства белков. Преврщение белков в организме Гипотезы возникновения жизни на Земле
Гипотезы возникновения жизни на Земле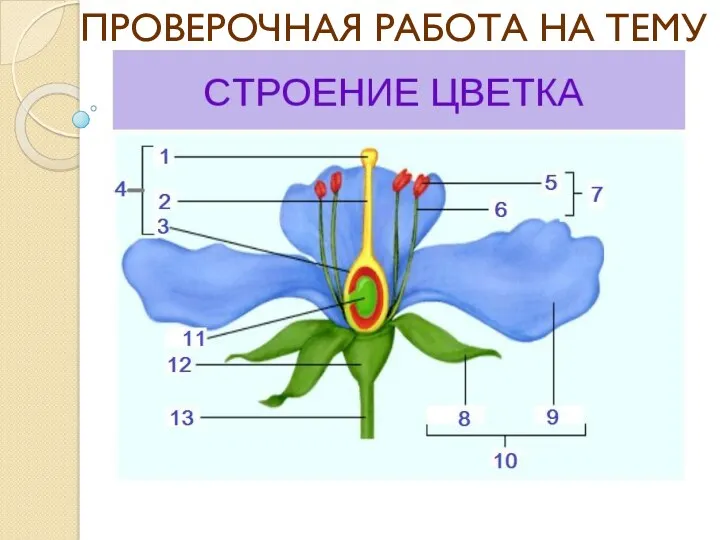 Презентация для проверки темы Строение цветка 6 класс
Презентация для проверки темы Строение цветка 6 класс Жизнь леса
Жизнь леса Домашние животные зимой
Домашние животные зимой Организм. Системы органов
Организм. Системы органов Выдающиеся ученые инфекционисты и эпидемиологи
Выдающиеся ученые инфекционисты и эпидемиологи Грибы. Тест на пять вопросов
Грибы. Тест на пять вопросов Развитие жизни на Земле
Развитие жизни на Земле Introduction to artificial intelligence
Introduction to artificial intelligence Среды жизни и места обитания животных. Взаимосвязи животных в природе
Среды жизни и места обитания животных. Взаимосвязи животных в природе Строение и виды цветка и его частей
Строение и виды цветка и его частей Решение задач по генетике
Решение задач по генетике Презентация к внеклассному мероприятию Цветы в легендах, поэзии, музыке
Презентация к внеклассному мероприятию Цветы в легендах, поэзии, музыке Гаметогенез. Клетки
Гаметогенез. Клетки Декоративные качества листьев
Декоративные качества листьев Молюски
Молюски Отдел Моховидные. Общая характеристика и значение
Отдел Моховидные. Общая характеристика и значение