Содержание
- 2. В лабораторной практике для определения основных параметров клинической биохимии используют спектрофотометрические способы определения. Среди применяемых с
- 3. Менее современными являются спектрофотометрические способы определения , в основе которых лежат методы конечной точки, основанные на
- 4. Спектрофотометры рассчитаны на регистрацию величины оптической плотности и производят элементарные математические операции с полученными величинами, подготовка
- 5. Кинетический метод является более чувствительным, чем метод конечной точки, и позволяет раньше выявить патологические изменения(параметры определяют
- 6. Кинетический метод лежит в основе работы полуавтоматических анализаторов Полуавтоматические анализаторы также требуют вмешательства оператора. Врач-лаборант готовит
- 7. Нефелометрия - лежит в основе работы автоматических анализаторов основана на феномене рассеивания света, когда падающий луч
- 8. Турбидиметрическая методика -лежит в основе работы автоматических анализаторов схожа с нефелометрией и основана на взаимосвязи проходящего
- 9. Автоматизированные биохимические анализаторы осуществляют дозирование реагентов, их смешивание и внос реакционной смеси в зону анализатора автоматически.
- 10. Классификация автоанализаторов (три основных типа). 1. Одноцелевые биохимические автоанализаторы: -в анализируемой пробе определяется лишь один компонент
- 11. Современные и перспективные сепарационные методы –это капиллярный электрофорез, обеспечивает: - высокая эффективность разделения, применяют для выявления
- 12. Уникальные системы полностью автоматического клинического капиллярного электрофореза дают возможность определять белковые фракции, специфические белки, иммуноглобулины, а
- 13. Нарушение белкового обмена в клинико-биохимических анализах
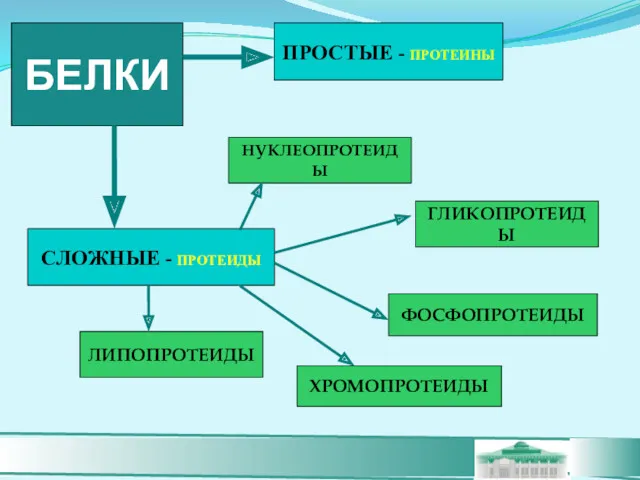
- 14. БЕЛКИ ПРОСТЫЕ - ПРОТЕИНЫ СЛОЖНЫЕ - ПРОТЕИДЫ НУКЛЕОПРОТЕИДЫ ХРОМОПРОТЕИДЫ ГЛИКОПРОТЕИДЫ ФОСФОПРОТЕИДЫ ЛИПОПРОТЕИДЫ
- 15. Общий белок в сыворотке крови Референтные величины концентрации общего белка в сыворотке крови —65−85 г/л. Концентрация
- 16. Физиологические роли белков крови поддерживают коллоидно-онкотическое давление; принимают участие в процессах свёртывания крови; поддерживают постоянство рН
- 17. Гипопротеинемия возникает вследствие: ■ недостаточного введения белка (при длительном голодании или при продолжительном соблюдении безбелковой диеты);
- 18. Гиперпротеинемия нередко развивается при: дегидратации в результате потери части внутрисосудистой жидкости (при тяжёлых травмах, обширных ожогах,
- 19. На величину общей концентрации белка могут оказывать влияние положение тела и физическая активность. Активная физическая работа
- 20. Альбумин в сыворотке крови Референтные величины концентрации альбумина в сыворотке крови —35−50 г/л Возможны как качественные,
- 21. Гиперальбуминемию наблюдают при дегидратации в случаях тяжёлых травм, при обширных ожогах, холере. Гипоальбуминемии бывают первичные (у
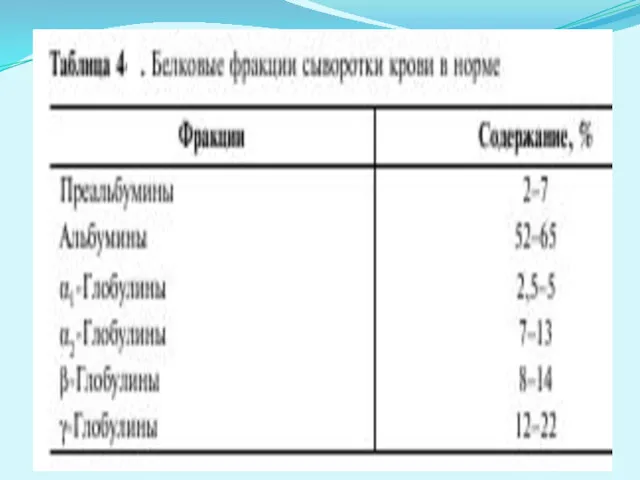
- 22. Белковые фракции сыворотки крови Для разделения белковых фракций обычно используют метод электрофореза, основанный на различной подвижности
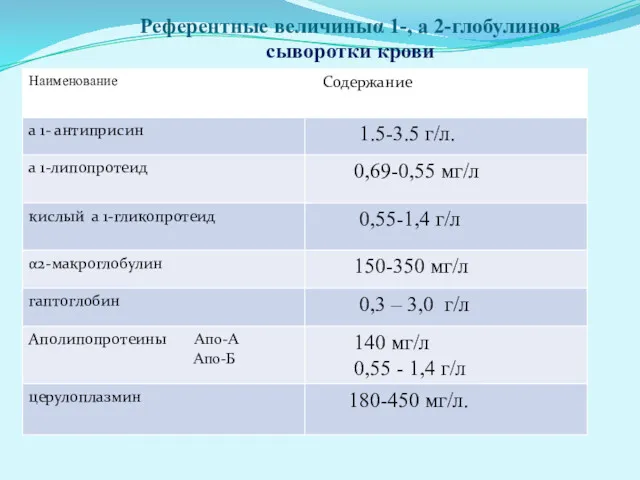
- 24. Изменения фракции α1-глобулинов. Основные компоненты данной фракции включают α1-антитрипсин, α1-липопротеид, кислый α1-гликопротеид. ■ Увеличение фракции α1-глобулинов
- 25. Изменения фракции α2-глобулинов. α2-Фракция содержит α2-макроглобулин, гаптоглобин, аполипопротеины А, В (апо-А, апо-B), С, церулоплазмин. ■ Увеличение
- 26. Референтные величиныα 1-, а 2-глобулинов сыворотки крови
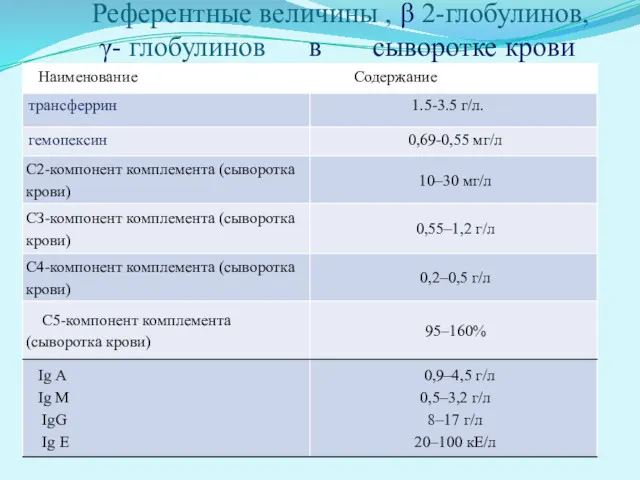
- 27. Изменения фракции β-глобулинов. β-Фракция содержит трансферрин, гемопексин, компоненты комплемента, Ig и липопротеины (ЛП). ■ Увеличение фракции
- 28. Изменения фракции γ-глобулинов. γ-Фракция содержит Ig (IgG, IgA, IgM, IgD, IgE), поэтому повышение содержания γ-глобулинов отмечают
- 29. Референтные величины , β 2-глобулинов, γ- глобулинов в сыворотке крови
- 30. При определённых заболеваниях возможен повышенный синтез белков, попадающих в фракцию γ-глобулинов, и в крови появляются патологические
- 31. Гомоцистеин - это продукт переработки в организме незаменимой аминокислоты метионина. Гомоцистеин под воздействием фолиевой кислоты и
- 32. Главное негативное действие гомоцистеина - заключается в поражении внутренней сосудистой стенки артерий- интиму, покрытую эндотелием. Образуются
- 33. Мочевина (азот мочевины) в сыворотке крови Мочевина 2.5 – 8.3 ммоль/л Мочевина — конечный продукт метаболизма
- 34. Различают три группы причин, приводящих к увеличению концентрации мочевины в крови: надпочечную, почечную и подпочечную азотемии.
- 35. Повышение концентрации мочевины в крови наиболее часто возникает в результате нарушения выделительной функции почек. ❑ Острые
- 36. Острая почечная недостаточность (ОПН); концентрация мочевина крови нередко достигает очень высоких значений — 133,2−149,8 ммоль/л. Важное
- 37. Накопление аммиака опасно для организма Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях
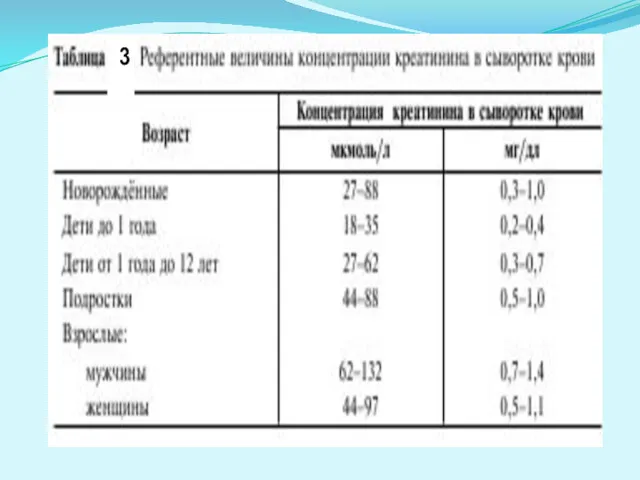
- 38. Креатинин в сыворотке крови Креатинин — конечный продукт распада креатина, который играет важную роль в энергетическом
- 39. 333 3
- 40. Клиренс эндогенного креатинина (проба реберга-тареева) позволяет судить о клубочковой фильтрации и канальцевой реабсорбции в почках. Порядок
- 41. Содержание креатинина в крови закономерно повышается при почечной недостаточности, что имеет большое значение для её диагностики.
- 42. Скорость клубочковой фильтрации по формуле Кокрофта-Голта Методика определения скорости клубочковой фильтрации (СКФ) (клиренса эндогенного креатинина) по
- 43. Определение скорости клубочковой фильтрации по второй порции мочи: F2 = (u2/p)v2 Показатели клубочковой фильтрации, определяемые по
- 44. Мочевая кислота в сыворотке крови В норме ее содержание в крови у женщин 0,16-0,44 ммоль/л, У
- 45. Гиперурикемия - повышение концентрации мочевой кислоты — выявляется при: - подагре; - лейкозах; - В12-дефицитной анемии;
- 46. Тропонины Т и I. Регуляторный комплекс тропонина состоит из трех белков. Он осуществляет взаимодействие актина и
- 47. Положительные результаты качественного теста на тропонин Т отмечаются у 100% больных инфарктом миокарда с зубцом Q
- 48. Более специфичным маркером поражения сердца является миокардиальный тропонин I - один из трех белков регуляторного комплекса
- 49. Пути метаболизма липидов и липопротеинов Экзогенный (пищевой) путь. Более 95% липидов, поступающих с пищей, являются триглицеридами,
- 50. Хиломикроны почти полностью (на 80-95%) состоят из триглицеридов и являются основной транспортной формой экзогенных (пищевых) триглицеридов,
- 51. Эндогенный путь В печени из эндогенных триглицеридов и холестерина синтезируются липопротеины очень низкой плотности (ЛПОНП). ЛПОНП
- 52. Неэстерифицированный холестерин высвобождается в плазму, где связывается с липопротеинами высокой плотности (ЛПВП). Сложные эфиры холестерина ЛПВП
- 53. Липопротеиды очень низкой плотности (ЛПОНП) содержат около 55% триглицеридов, 19% холестерина и 8% белка (апопротеинов В-100,
- 54. Аполипопротеин C-II на поверхности ЛПОНП активирует эндотелиальную липопротеинлипазу, которая расщепляет триглицериды до свободных жирных кислот и
- 55. Липопротеины низкой плотности (ЛПНП ) – мелкие частицы, которые являются основной транспортной формой холестерина. Они содержат
- 56. ЛПНП являются продуктом метаболизма ЛПОНП и ЛППП, которые содержат наибольшее количество холестерина. Примерно 40-60% всех ЛПНП
- 57. Липопротеины промежуточной плотности (ЛППП) – представляют собой ремнанты хиломикронов и ЛОНП, содержащие большое количество холестерина. ЛППП
- 58. Липопротеины высокой плотности (ЛПВП) – самые мелкие и плотные частицы липопротеинов. Они содержат 5% триглицеридов, 22%
- 59. Решающее значение для возникновения и прогрессирования атеросклероза имеет соотношение липопротеидов различных классов: ЛПНП, ЛОНП и липопротеин
- 60. Повышение содержания ЛПНП и липопротеина (а) и их атерогенности обусловлены -Нарушением синтеза специфических ЛПНП-рецепторов гепатоцитов, что
- 61. Факторы, способствующие снижению содержания ЛПВП Ожирение. Гипертриглицеридемия. Высокое потребление углеводов. Сахарный диабет. Курение.
- 62. Нарушения липидного обмена (дислипидемии) характеризующиеся в первую очередь повышенным содержанием в крови холестерина и триглицеридов, являются
- 64. Скачать презентацию
























































 Этические проблемы использования животных
Этические проблемы использования животных Пищеварение 1.1
Пищеварение 1.1 Общие признаки животных. 5 класс
Общие признаки животных. 5 класс Ретикулярная формация. Лимбическая система. Оболочки мозга
Ретикулярная формация. Лимбическая система. Оболочки мозга Хемосинтез. Хемосинтезирующие организмы
Хемосинтез. Хемосинтезирующие организмы Визначення типу шкіри на різних ділянках обличчя та складання правил догляду за власною шкірою
Визначення типу шкіри на різних ділянках обличчя та складання правил догляду за власною шкірою Прокариоты на службе по защите почвенной среды жизни от тяжёлых металлов
Прокариоты на службе по защите почвенной среды жизни от тяжёлых металлов Прісноводна гідра
Прісноводна гідра Zebra is a striped member of the horse family
Zebra is a striped member of the horse family Голоса птиц
Голоса птиц Імунітет рослин до інфекційних хвороб
Імунітет рослин до інфекційних хвороб Морфологическое описание растения
Морфологическое описание растения Презентация по биологии для учащихся 9 класса по теме Клеточная мембрана
Презентация по биологии для учащихся 9 класса по теме Клеточная мембрана Про кошек
Про кошек Презентация к уроку биологии в 7 классе Отряд Жесткокрылые, или Жуки
Презентация к уроку биологии в 7 классе Отряд Жесткокрылые, или Жуки Транскрипция и трансляция. Генетическая трансформация
Транскрипция и трансляция. Генетическая трансформация Китообразные и ластоногие
Китообразные и ластоногие Породы кошек
Породы кошек Классификация и характеристика рыб
Классификация и характеристика рыб Строение клеток прокариот и эукариот
Строение клеток прокариот и эукариот Органы и системы органов
Органы и системы органов Мед - пчелиная заслуга
Мед - пчелиная заслуга Микробиология - наука о микроорганизмах
Микробиология - наука о микроорганизмах Карл Линней - основоположник биологической систематики
Карл Линней - основоположник биологической систематики Движение крови в организме. Органы кровообращения
Движение крови в организме. Органы кровообращения Приглашение на семинар по управлению инкубаторием компании Пас Реформ
Приглашение на семинар по управлению инкубаторием компании Пас Реформ Витамины красоты
Витамины красоты Внеклассное мероприятие Красная книга Оренбургской области
Внеклассное мероприятие Красная книга Оренбургской области