Содержание
- 2. Лекции – 8 часов Практические занятия – 4 часа Зачет
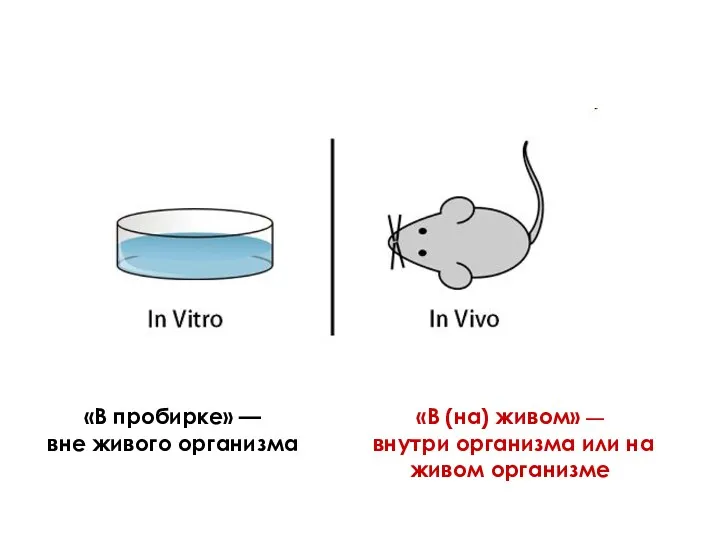
- 3. In vitro – культивирование объектов «в стекле» (пробирке, колбе, биореакторе) на искусственных питательных средах в стерильных
- 4. «В (на) живом» — внутри организма или на живом организме «В пробирке» — вне живого организма
- 5. Клеточные технологии включают: культивирование растительных клеток; культивирование животных клеток Цель курса «Культуры эукариотических клеток» – знакомство
- 6. Главное требование – соблюдение строгой асептики Все работы по получению культур растительных и животных клеток, их
- 7. Ламинар-боксы
- 8. Второе условие – использование специальных питательных сред Культуральная среда должна обеспечивать все внешние условия, которые клетки
- 9. Способы культивирования растительных клеток Поверхностное культивирование на плотной (агаризованной) питательной среде Глубинное культивирование в жидкой питательной
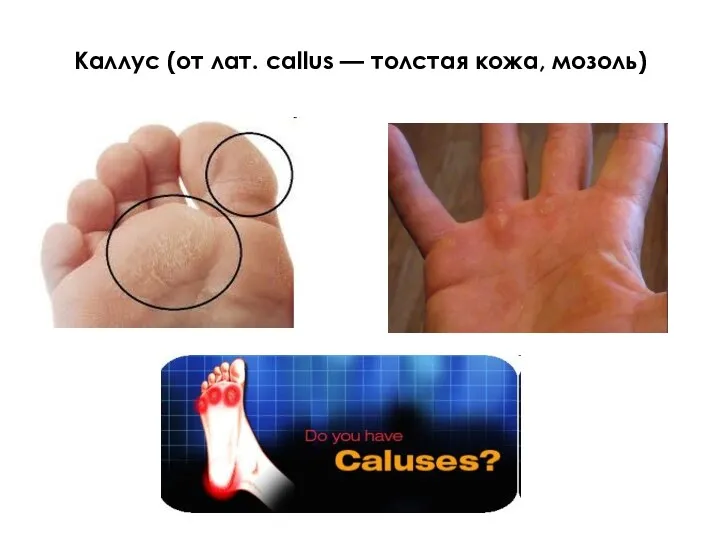
- 10. Каллус (от лат. callus — толстая кожа, мозоль)
- 11. Каллус - недифференцированные растительные клетки, выращиваемые поверхностным способом на полутвердой питательной среде
- 12. Каллус может образоваться не только в искусственных условиях, но и в природе, например, на раневой поверхности.
- 13. 1. Выбор экспланта Эксплант - фрагмент ткани или органа, используемый для получения первичного каллуса
- 14. Каллусы однодольных растений обычно получают из зародышей, корней, отрезков основания стебля Каллусы двудольных растений могут быть
- 15. Лучшими эксплантами для получения каллуса являются: молодая ткань; ткань ответственная за пролиферацию (меристема) Нежелательно использовать: одревесневшие
- 16. Проращивание простерилизованных семян в асептических условиях дает наиболее пригодный материал для получения каллусов
- 17. 2. Стерилизация растительного материала На поверхности органов растений всегда находится эпифитная микрофлора. Эксплант должен быть освобожден
- 18. АНТИСЕПТИКИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ СТЕРИЛИЗАЦИИ РАСТИТЕЛЬНЫХ ТКАНЕЙ: соединения, содержащие активный хлор, – 0,5-1% (гипохлорит кальция, гипохлорит натрия,
- 19. ТЕХНИКА ПРОВЕДЕНИЯ СТЕРИЛИЗАЦИИ РАСТИТЕЛЬНОГО МАТЕРИАЛА: Предварительная стерилизация (проводят очистку поверхности путем ее промывания проточной водой; обработки
- 20. 3. Перенос стерильных эксплантов на питательную среду
- 21. 4. Получение первичного каллуса Образование каллуса, в первую очередь, отмечается на раневой поверхности экспланта
- 22. При оптимально подобранной среде первичные каллусы в количестве достаточном для пересадки образуются в течение 3-8 недель
- 23. 5. Субкультивирование (пассирование) Первичный каллус разделяют на части, которые в дальнейшем культивируются отдельно. Следует обратить внимание
- 24. Каллусные культуры различаются по: интенсивности роста; окраске; консистенции и др. Типы каллусных культур:
- 25. Типы каллусных культур: рыхлые (легко распадаются на отдельные клетки); среднеплотные (клетки могут быть отделены друг от
- 26. Направления использования каллусных культур: изучение процессов цитодифференцировки и морфогенеза; биохимические и молекулярно-биологические исследования; изучение механизмов опухолеобразования;
- 27. Суспензионная культура – отдельные клетки или клеточные агрегаты, выращиваемые в жидкой питательной среде во взвешенном состоянии
- 28. Необходимое условие для поддержания суспензионных культур – постоянное перемешивание питательной среды
- 29. удобная модель для молекулярно-биологических и биохимических исследований; (клетки в одинаковой степени доступны для внешнего воздействия, более
- 30. 1. Отбор хорошо растущей каллусной культуры рыхлого типа 2. Инициализация первичной суспензии 2-3 г свежей массы
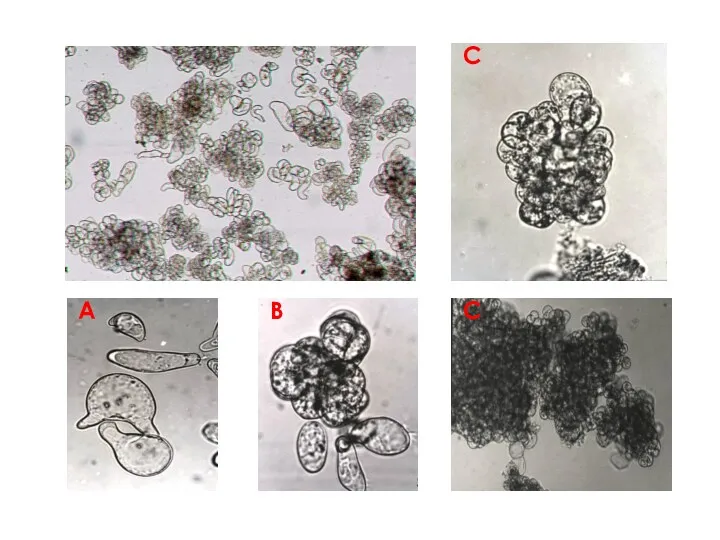
- 31. Суспензионные культуры состоят из: отдельных клеток; клеточных групп (2-10 клеток); многоклеточных агрегатов (сотни и тысячи клеток).
- 32. А В С С
- 33. слабоагрегированные; (состоят из одиночных клеток (40%) и мелких агрегатов (60%), агрегаты не должны содержать более 10-12
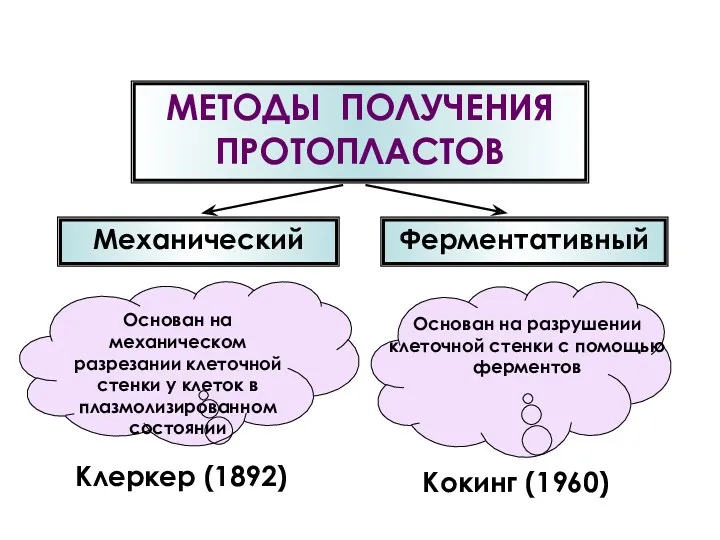
- 34. КУЛЬТУРЫ ПРОТОПЛАСТОВ
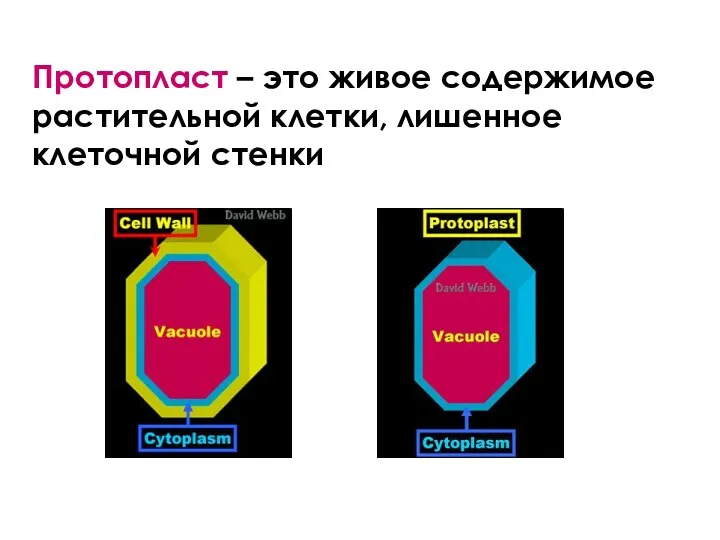
- 35. Протопласт – это живое содержимое растительной клетки, лишенное клеточной стенки
- 36. ИСТОЧНИКИ ПОЛУЧЕНИЯ ПРОТОПЛАСТОВ: изолированные органы растений и их части (листья, корни, лепестки); суспензионная культура; каллусная ткань.
- 37. Основан на механическом разрезании клеточной стенки у клеток в плазмолизированном состоянии Основан на разрушении клеточной стенки
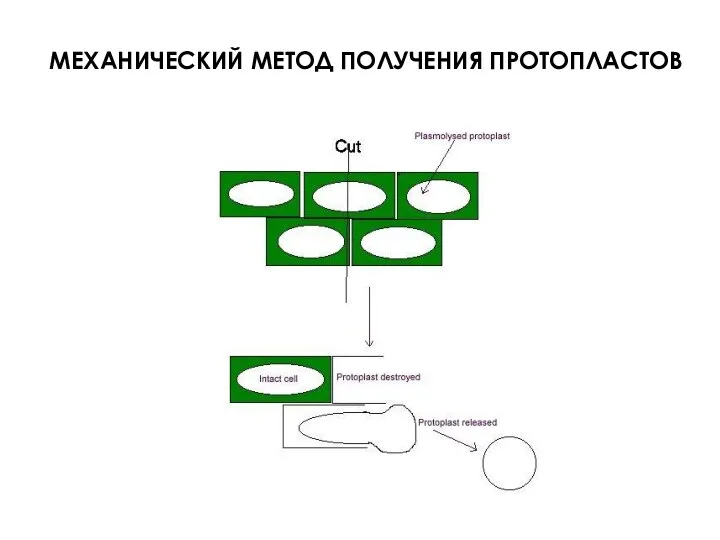
- 38. МЕХАНИЧЕСКИЙ МЕТОД ПОЛУЧЕНИЯ ПРОТОПЛАСТОВ
- 39. Плазмолиз – явление отделения протопласта растительной клетки от клеточной стенки в гипертонической среде
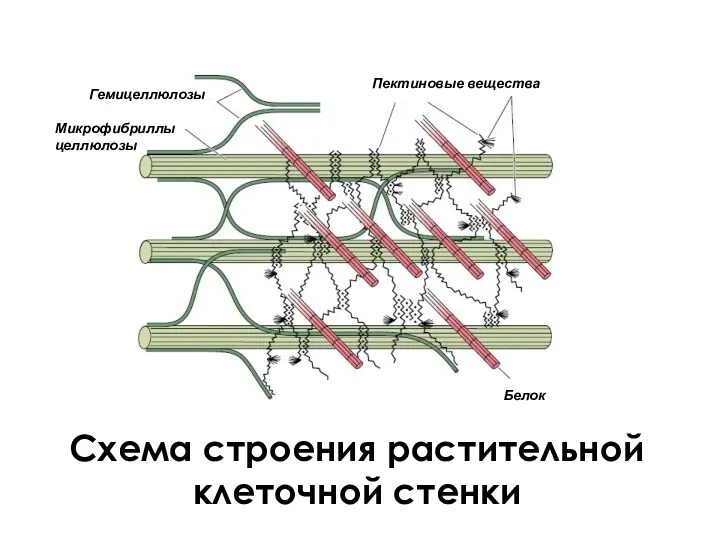
- 40. Схема строения растительной клеточной стенки
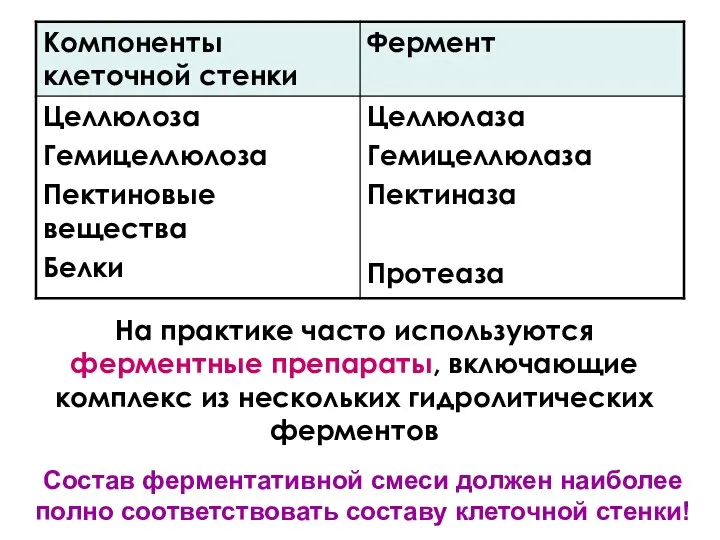
- 41. На практике часто используются ферментные препараты, включающие комплекс из нескольких гидролитических ферментов Состав ферментативной смеси должен
- 42. Основные компоненты питательных сред для культивирования растительных клеток: макроэлементы; микроэлементы; источник углерода; витамины; регуляторы роста
- 43. РЕГУЛЯТОРЫ РОСТА РАСТЕНИЙ Содержание регуляторов роста является определяющим фактором для успешного роста культур клеток растений АУКСИНЫ
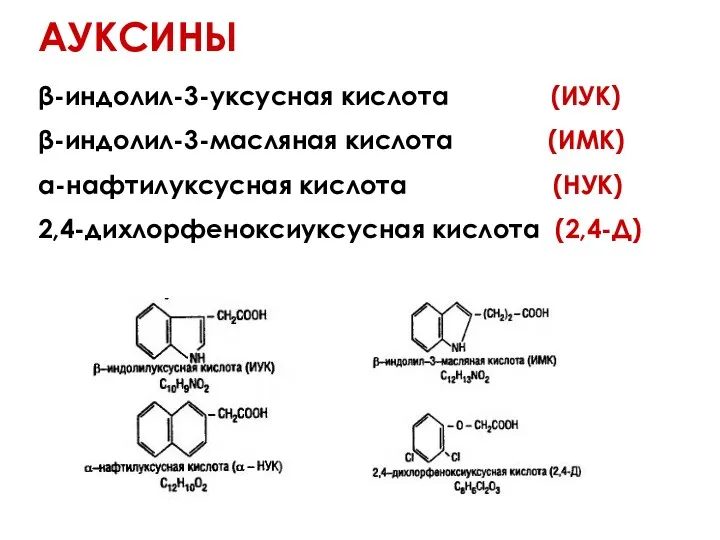
- 44. АУКСИНЫ β-индолил-3-уксусная кислота (ИУК) β-индолил-3-масляная кислота (ИМК) α-нафтилуксусная кислота (НУК) 2,4-дихлорфеноксиуксусная кислота (2,4-Д)
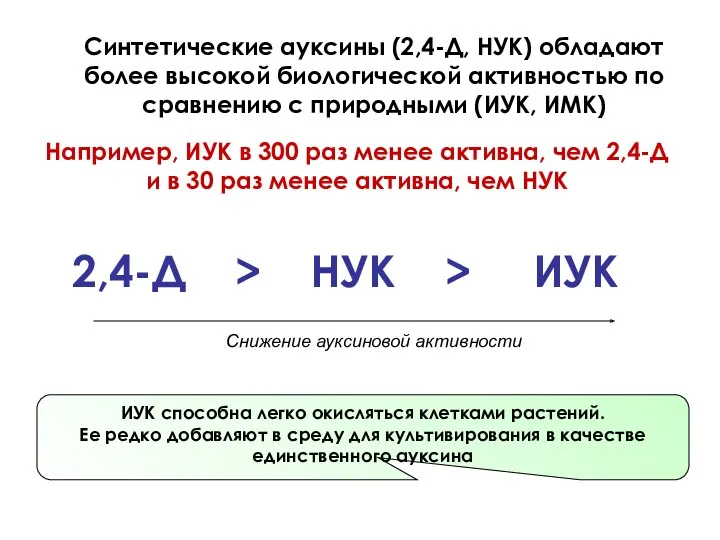
- 45. АУКСИНЫ НЕОБХОДИМЫ ДЛЯ: стимуляции деления и растяжения клеток каллусных и суспензионных культур; стимуляции образования корней (ризогенеза);
- 46. Стимуляция закладки корней (ризогенеза) у черенков под действием ауксинов
- 47. ИУК способна легко окисляться клетками растений. Ее редко добавляют в среду для культивирования в качестве единственного
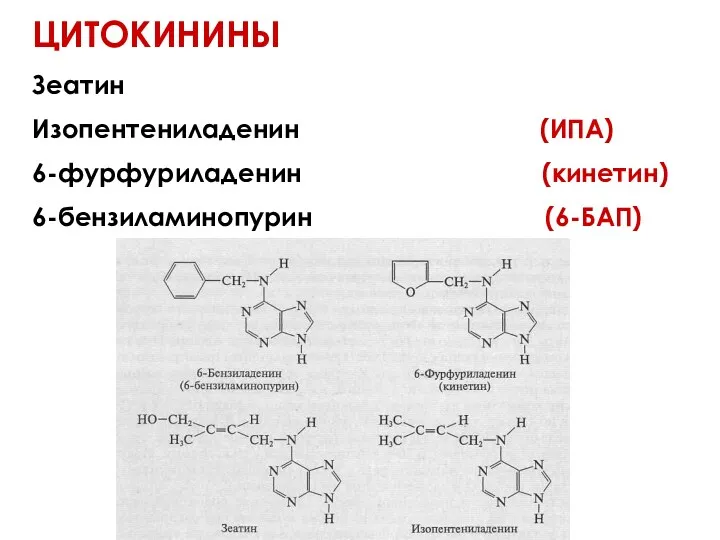
- 48. ЦИТОКИНИНЫ Зеатин Изопентениладенин (ИПА) 6-фурфуриладенин (кинетин) 6-бензиламинопурин (6-БАП)
- 49. Зеатин термолабилен, поэтому его нельзя автоклавировать
- 50. ЦИТОКИНИНЫ ВКЛЮЧАЮТ В СОСТАВ СРЕД ДЛЯ: стимуляции клеточных делений в каллусных и суспензионных культурах, в культурах
- 51. ФИЗИЧЕСКИЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ: условия освещения; Каллусные культуры и клеточные суспензии выращиваются либо темноте, либо под лампами
- 52. Ростовой цикл каллусных и суспензионных культур
- 54. Скачать презентацию








































 Почва как среда жизни. Роль растений и животных в почвообразовании. 5 класс
Почва как среда жизни. Роль растений и животных в почвообразовании. 5 класс Зимующие птицы
Зимующие птицы Развитие пищеварительной системы, оболочки пищеварительной трубки. Слизистая оболочка полости рта
Развитие пищеварительной системы, оболочки пищеварительной трубки. Слизистая оболочка полости рта Мутационная изменчивость. Тест для самопроверки
Мутационная изменчивость. Тест для самопроверки Воронежский государственный биосферный заповедник им. Пескова В. М
Воронежский государственный биосферный заповедник им. Пескова В. М Ферменты. (лекция 2)
Ферменты. (лекция 2) Презентация Первоцветы
Презентация Первоцветы Бактерии в организме человека
Бактерии в организме человека Спинной мозг
Спинной мозг Строение растений
Строение растений Презентация к уроку биологии 6 класс
Презентация к уроку биологии 6 класс образование видов
образование видов Строение и значение нервной системы
Строение и значение нервной системы Жизнедеятельность клетки
Жизнедеятельность клетки Размножение цветковых растений
Размножение цветковых растений Жизнедеятельность клетки
Жизнедеятельность клетки Биология – наука о жизни
Биология – наука о жизни Уроки биологии, как эффективное средство профилактики употребления ПАВ среди учащихся
Уроки биологии, как эффективное средство профилактики употребления ПАВ среди учащихся Яичко (testis). Строение
Яичко (testis). Строение Морфология растений
Морфология растений Урок -путешествие Лишайники
Урок -путешествие Лишайники Технология выращивания суккулентов
Технология выращивания суккулентов Женская половая система. (Часть 2)
Женская половая система. (Часть 2) Лекарственные и съедобные растения,произрастающие в Якутии
Лекарственные и съедобные растения,произрастающие в Якутии Микробиологическая лаборатория, устройство, оснащение, правила работы. Изучение морфологии бактерий
Микробиологическая лаборатория, устройство, оснащение, правила работы. Изучение морфологии бактерий Презентации к уроку по теме: Иммунитет
Презентации к уроку по теме: Иммунитет Белки (протеины)
Белки (протеины) 20231022_himicheskiy_sostav_kletki
20231022_himicheskiy_sostav_kletki