Механизмы окислительного повреждения аминокислот, пептидов, белков, нуклеотидов и нуклеиновых кислот. Лекция 5 презентация
Содержание
- 2. Механизмы окислительной модификации белков (ОМБ) В качестве основных индукторов ОМБ, в первую очередь, рассматриваются активные формы
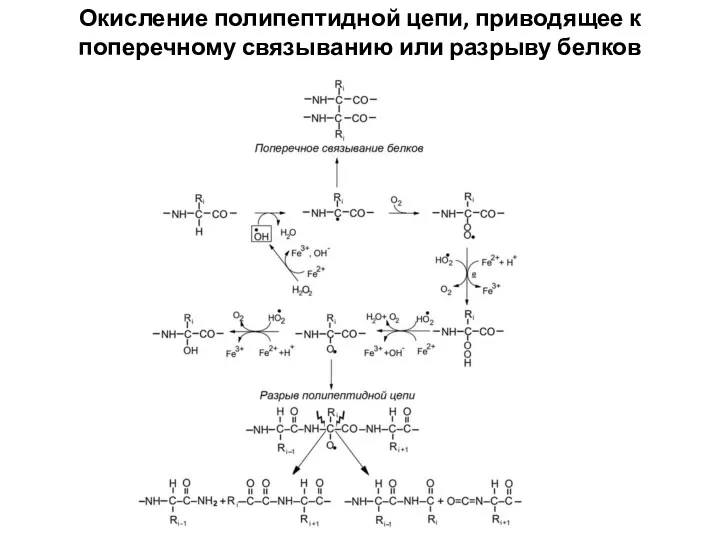
- 3. Окисление полипептидной цепи, приводящее к поперечному связыванию или разрыву белков
- 4. Основной агент, вызывающий окислительное повреждение белков, — гидроксил-радикал. Окислительная атака на белок начинается с удаления электрона
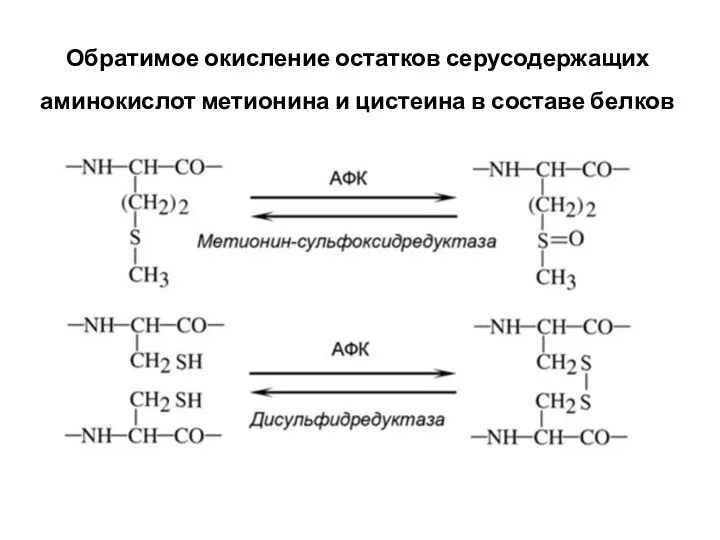
- 5. Все боковые остатки аминокислот подвержены окислению, но в разной степени. Наиболее уязвимы цистеин и метионин, однако
- 6. Присутствующие на поверхности многих белков остатки метионина можно рассматривать как встроенный в белок предохранитель от АФК,
- 7. Обратимое окисление остатков серусодержащих аминокислот метионина и цистеина в составе белков
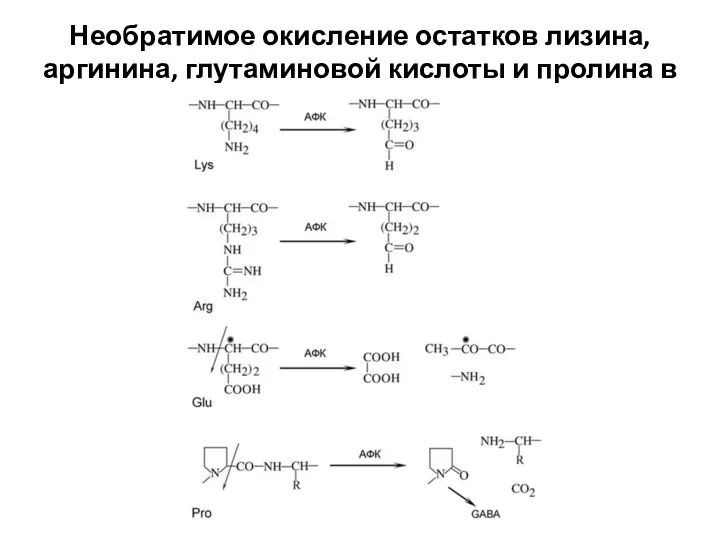
- 8. Нерепарируемому окислению чаще других подвергаются лизин и аргинин. В результате их окисления, а также в результате
- 9. Необратимое окисление остатков лизина, аргинина, глутаминовой кислоты и пролина в составе белков
- 10. Окисление глутаминовой кислоты и пролина часто приводит к разрыву полипептидной цепи. Разрыв цепи, обусловленный окислением пролина,
- 11. В настоящее время предложены следующие механизмы ОМБ. Первый механизм ОМБ – коньюгация липидных пероксидов с аминокислотными
- 12. Наиболее важным следствием ОМБ белков является инактивация ферментов. Например, альдегиды вызывают инактивацию мембранных транспортеров, таких, как
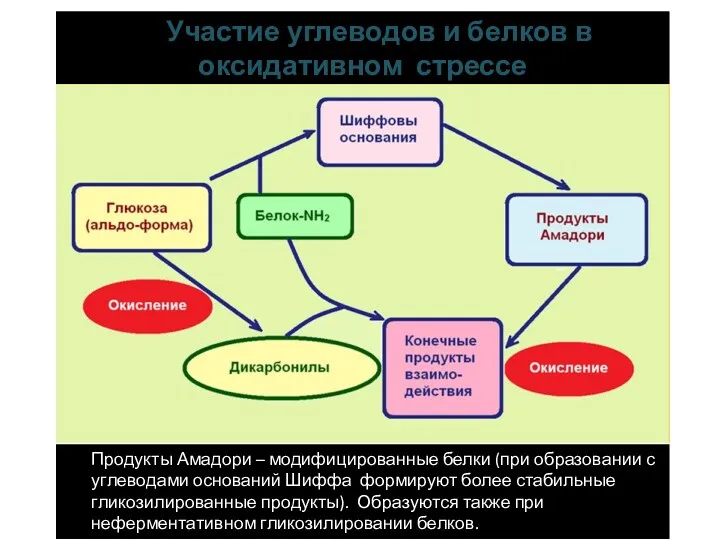
- 13. Гликирование белков Гликирование, или неферментативное гликозилирование, — реакция между восстанавливающими углеводами (глюкоза, фруктоза и др.) и
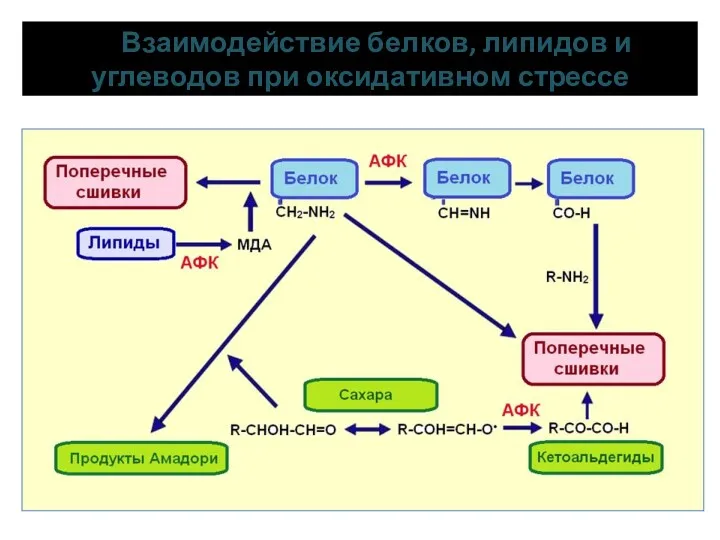
- 14. Участие углеводов и белков в оксидативном стрессе Продукты Амадори – модифицированные белки (при образовании с углеводами
- 15. Взаимодействие белков, липидов и углеводов при оксидативном стрессе
- 16. Окислительные повреждения нуклеиновых кислот Очень тяжелые последствия имеет окисление нуклеиновых кислот, особенно ДНК. В этом случае
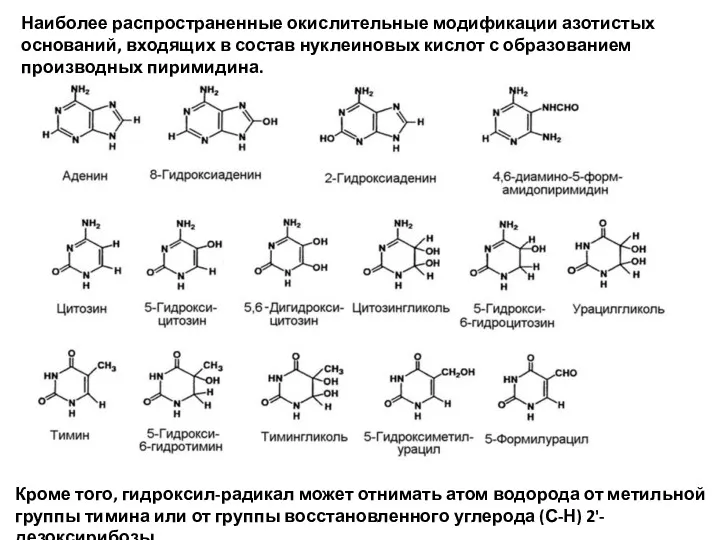
- 18. Наиболее распространенные окислительные модификации азотистых оснований, входящих в состав нуклеиновых кислот с образованием производных пиримидина. Кроме
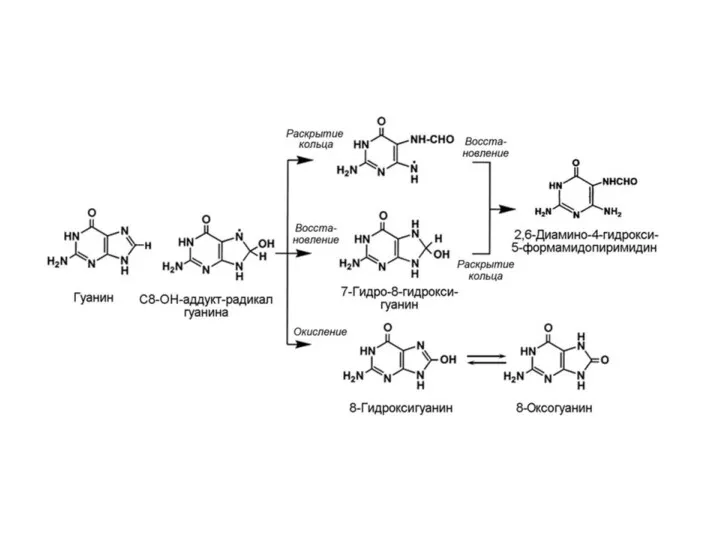
- 19. Идентифицировано приблизительно 20 окислительных повреждений азотистых оснований. У пуринов присоединение гидроксил-радикала происходит к С4, С5 и
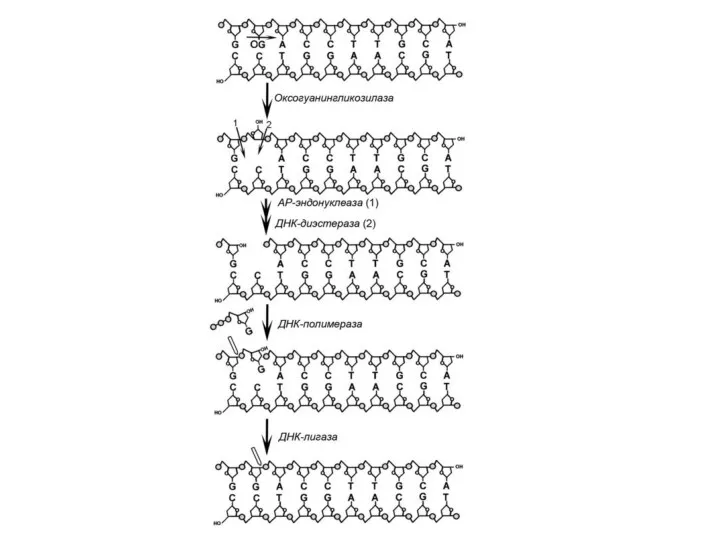
- 20. В клетках всех организмов существует многокомпонентная система репарации повреждений ДНК. Окисленные основания ДНК удаляются двумя способами.
- 22. Липофусцин (lipofuscinum; от греч. lipo – ≪жир≫ и лат. fuscus – ≪темный≫;), также известный как ≪пигмент
- 23. Липофусцин – гликопротеид, в состав которого входят: - Жиры - Аминокислоты - Ферменты - Флавиновые соединения
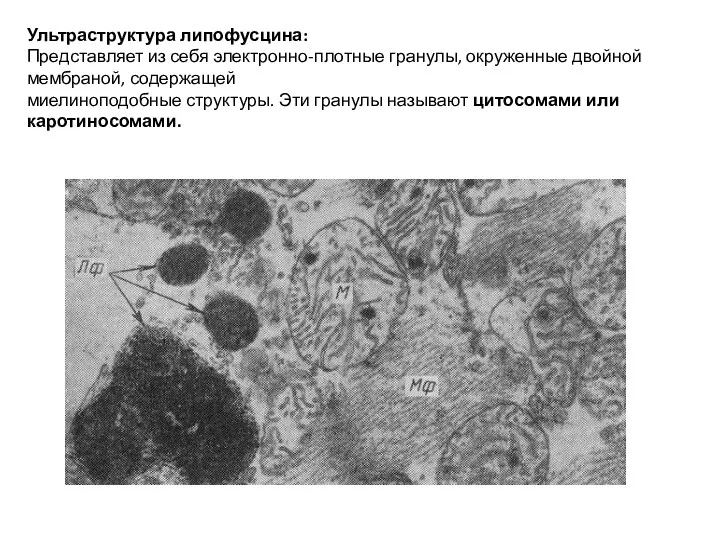
- 24. Ультраструктура липофусцина: Представляет из себя электронно-плотные гранулы, окруженные двойной мембраной, содержащей миелиноподобные структуры. Эти гранулы называют
- 26. Скачать презентацию














 Гнилостные бактерии
Гнилостные бактерии Необычные приветствия. Сквернословие
Необычные приветствия. Сквернословие Ракообразные. Классификация, строение, функции, размножение
Ракообразные. Классификация, строение, функции, размножение Покрытосеменные, или Цветковые
Покрытосеменные, или Цветковые Игра. Угадай животное
Игра. Угадай животное Cattle breeds
Cattle breeds Биологические науки
Биологические науки Большой (конечный) мозг
Большой (конечный) мозг Створення зелених насаджень
Створення зелених насаджень Репликация и транскрипция
Репликация и транскрипция Надцарство доядерные
Надцарство доядерные Эндокринная система
Эндокринная система Видоизменения побегов
Видоизменения побегов Биология – наука о живом мире. Общие свойства живых организмов.
Биология – наука о живом мире. Общие свойства живых организмов. Цитоплазматическая наследственность
Цитоплазматическая наследственность Ботанический сад во время блокады Ленинграда
Ботанический сад во время блокады Ленинграда Презентация по теме Постэмбриональное развитие
Презентация по теме Постэмбриональное развитие Класс насекомые. Стрекозы
Класс насекомые. Стрекозы Пришкольный участок. Уход за растениями
Пришкольный участок. Уход за растениями Квезаль - священная птица индейцев майя
Квезаль - священная птица индейцев майя Основы здорового питания собак и кошек
Основы здорового питания собак и кошек Биогенетический закон
Биогенетический закон Отряд приматы
Отряд приматы Развитие жизни в протерозойской и палеозойской эрах
Развитие жизни в протерозойской и палеозойской эрах Разведение кроликов
Разведение кроликов Органы и системы органов животных
Органы и системы органов животных Наследственность и изменчивость организмов
Наследственность и изменчивость организмов Кабинет биологии, фото
Кабинет биологии, фото