Содержание
- 2. План занятия 1) Общие представления 2) Механизм действия рецепторов на примере а) липофильных гормонов (внутриклеточные рецепторы)
- 3. Медиатор, нейромедиатор, мессенджер (от англ. – messenger – посредник) – молекула, адресно передающая информацию от клетки
- 4. Сайт, место связывания, площадка узнавания – участок рецептор-ной молекулы либо фермента, специфично связывающийся с лигандом (субстратом)
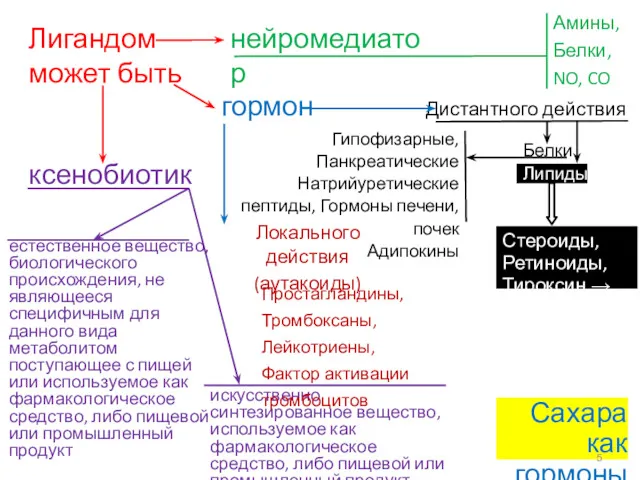
- 5. Лигандом может быть нейромедиатор гормон ксенобиотик естественное вещество, биологического происхождения, не являющееся специфичным для данного вида
- 6. Определение понятия «клеточный рецептор» Клеточный рецептор — молекула (белок или гетерополисахарид) или функциональная группа молекул находящаяся
- 7. обладать высоким сродством (специфичностью) к лиганду ткани что определяет наличие или отсутствие данных функций в клетках
- 8. В плазматических мембранах про- и эукариотических клеток локализованы различные специализированные рецепторные системы, процесс функционирования которых включают
- 9. Полная передача межклеточного сигнала предполагает примерно следующую схему: 1) внешний агент (медиатор, стимул) взаимодействует с клеточным
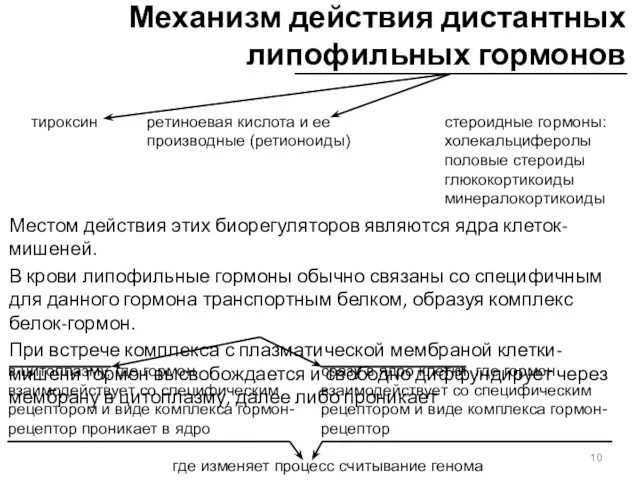
- 10. Механизм действия дистантных липофильных гормонов Местом действия этих биорегуляторов являются ядра клеток-мишеней. В крови липофильные гормоны
- 11. Рецепторы липофильных гормонов принадлежат к группе редких белков. присутствуют в клетках-мишенях в количестве 10−3 – 10−4
- 12. 6) комплекс связывается с регуляторными участками генов, которые именуются гормон-респонсивные элементы (ГРЭ (HRE)). 7) ГРЭ –
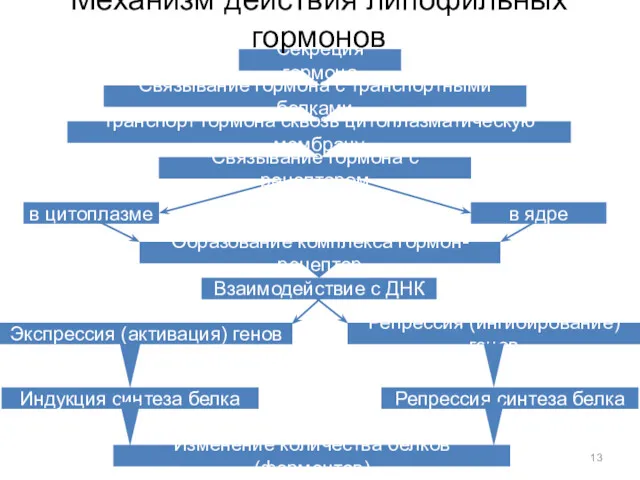
- 13. Секреция гормона Связывание гормона с транспортными белками Транспорт гормона сквозь цитоплазматическую мембрану Образование комплекса гормон-рецептор Экспрессия
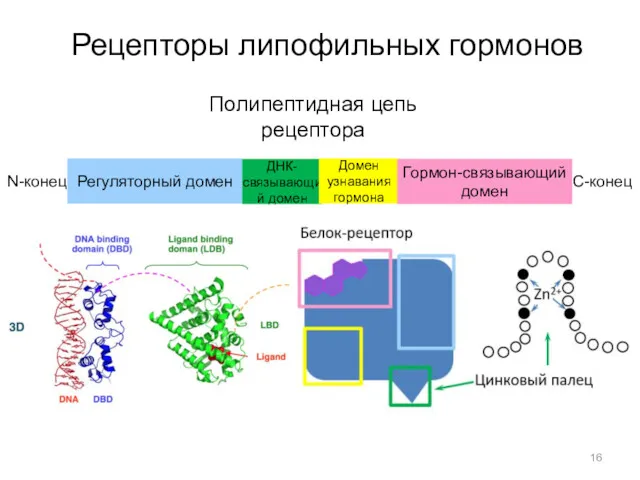
- 15. Рецепторы липофильных гормонов 1) во многом сходны, поскольку принадлежат к одному семей-ству белков; 2) образованы несколькими
- 16. Рецепторы липофильных гормонов
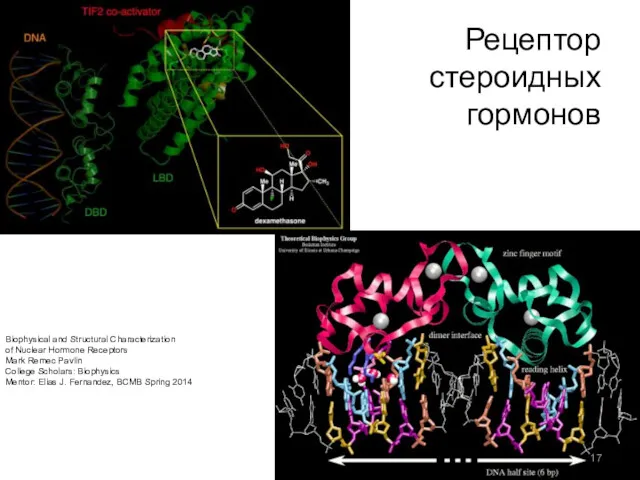
- 17. Рецептор стероидных гормонов Biophysical and Structural Characterization of Nuclear Hormone Receptors Mark Remec Pavlin College Scholars:
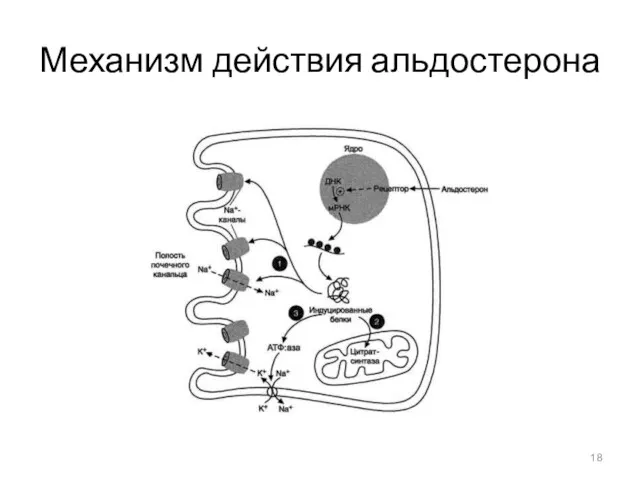
- 18. Механизм действия альдостерона
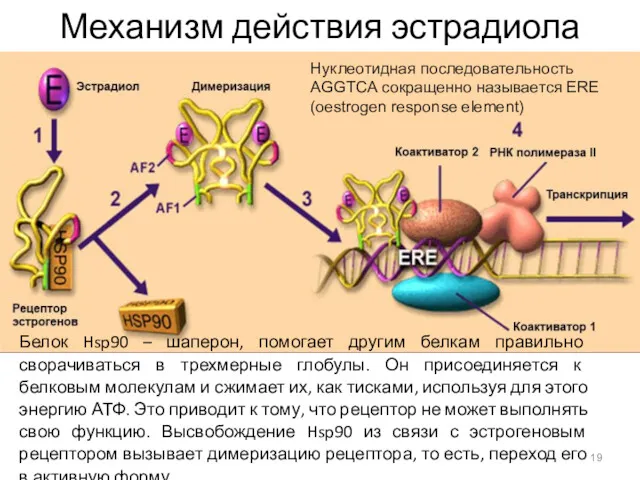
- 19. Механизм действия эстрадиола Белок Hsp90 – шаперон, помогает другим белкам правильно сворачиваться в трехмерные глобулы. Он
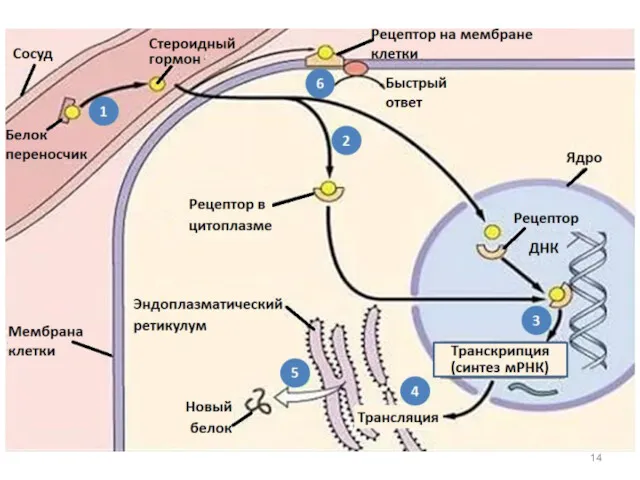
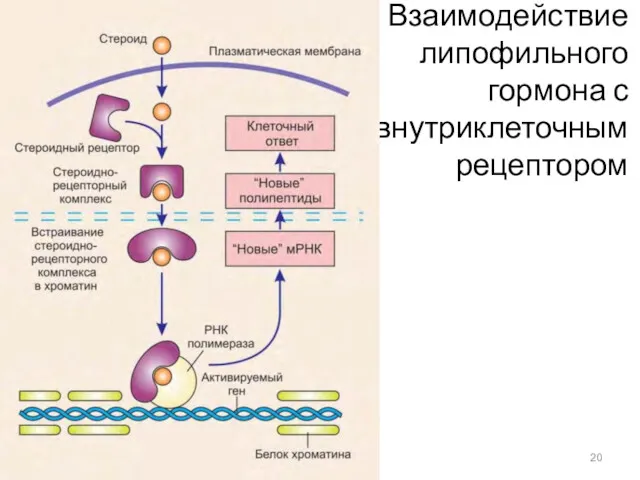
- 20. Взаимодействие липофильного гормона с внутриклеточным рецептором
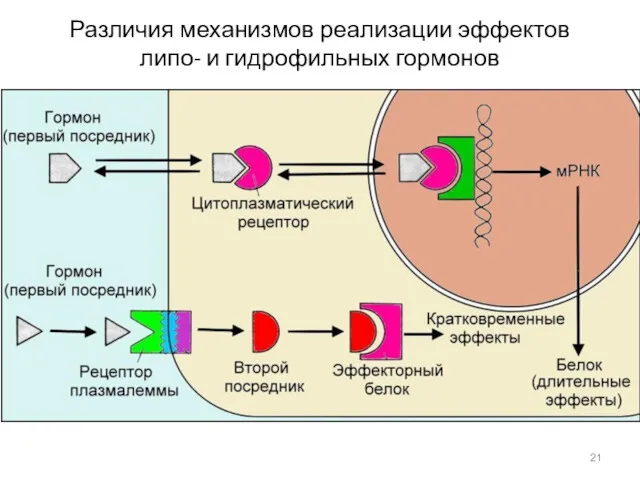
- 21. Различия механизмов реализации эффектов липо- и гидрофильных гормонов
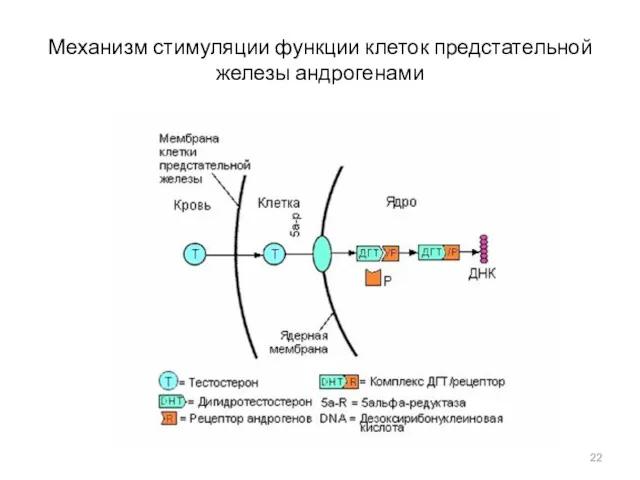
- 22. Механизм стимуляции функции клеток предстательной железы андрогенами
- 23. В семейство цинксодержащих белков входят рецепторы: стероидных гормонов, тироксина (и других тиреоидных гормонов), ретиноевой кислоты, вирусный
- 24. С помощью химического синтеза получают вещества, не идентичные гормонам, но обладающие свойством связываться с рецепторами. Например,
- 25. Механизм действия гидрофильных гормонов Большинство гидрофильных сигнальных веществ не спо-собны проходить через липофильную клеточную мембрану. Поэтому
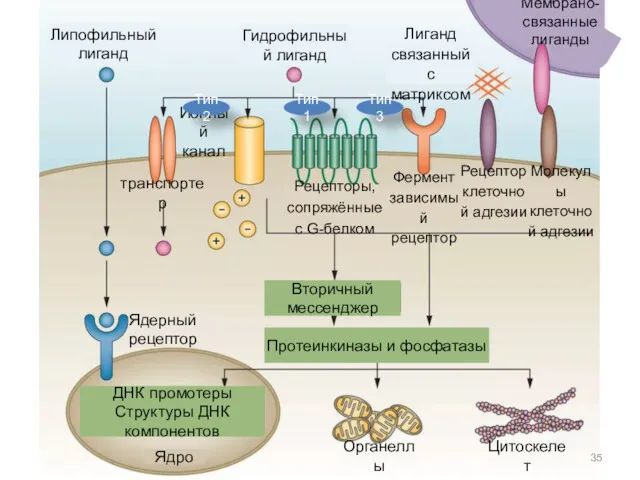
- 26. Различают три типа рецепторов Рецепторы первого типа Ионные каналы Рецепторы третьего типа, сопряженные с ГТФ-связывающими белками
- 27. Рецепторы первого типа являются белками, имеющими одну трансмембранную полипептидную цепь это аллостерические ферменты, активный центр которых
- 28. 1) связывание сигнального вещества ведет к димеризации рецептора первого типа 2) это активирует фермент и фосфорилирование
- 29. Ионные каналы (рецепторы второго типа ) рецепторы второго типа являются олигомерными мембранными белками, образующими лиганд-активируемый ионный
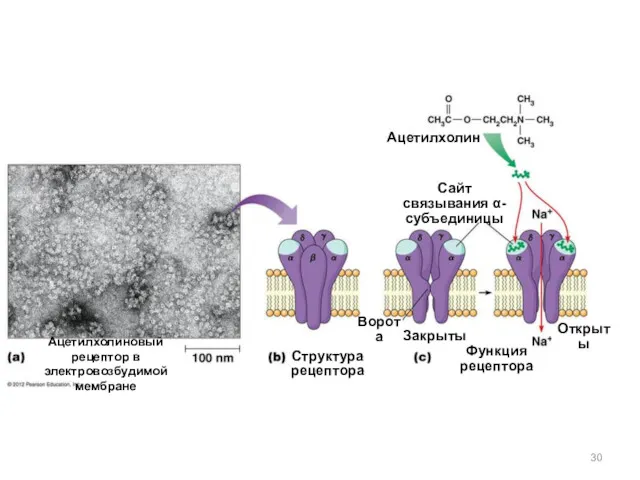
- 30. Ацетилхолиновый рецептор в электровозбудимой мембране Структура рецептора Ацетилхолин Сайт связывания α-субъединицы Ворота Закрыты Открыты Функция рецептора
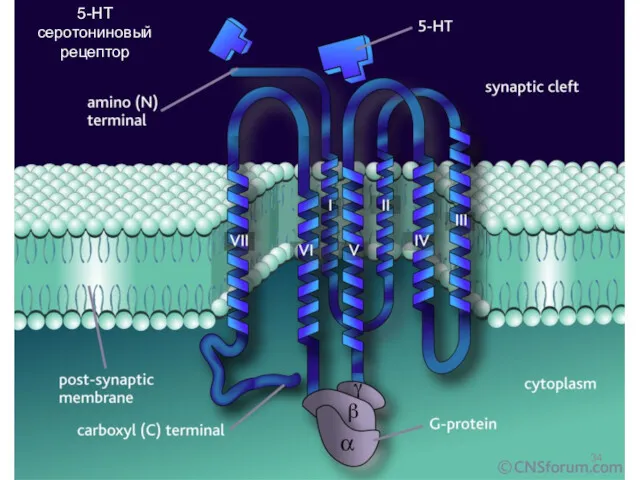
- 31. Рецепторы третьего типа, сопряженные с ГТФ-связывающими белками полипептидная цепь этих белков включает семь трансмембранных тяжей, проникающих
- 32. Связывание сигнального вещества с мембранным рецептором влечет за собой один из трех вариантов внутриклеточного ответа: рецепторные
- 33. Все три системы передачи сигнала взаимосвязаны Например, образование вторичного мессенджера цАМФ (сАМР) активирует протеинкиназу А [ПК-А
- 34. 5-HT серотониновый рецептор
- 35. Липофильный лиганд Гидрофильный лиганд Ионный канал Лиганд связанный с матриксом Рецепторы, сопряжённые с G-белком Рецептор клеточной
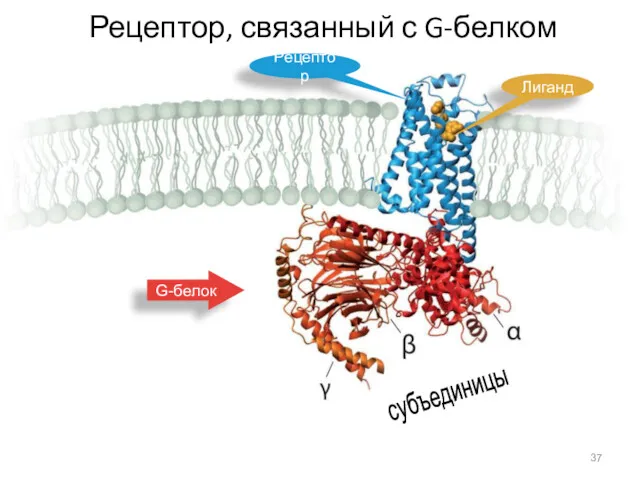
- 36. Преобразование сигнала G-белками G-белки переносят сигнал с рецептора третьего типа на белки-эффекторы. построены из трех субъединиц:
- 37. Рецептор, связанный с G-белком Рецептор Лиганд G-белок субъединицы
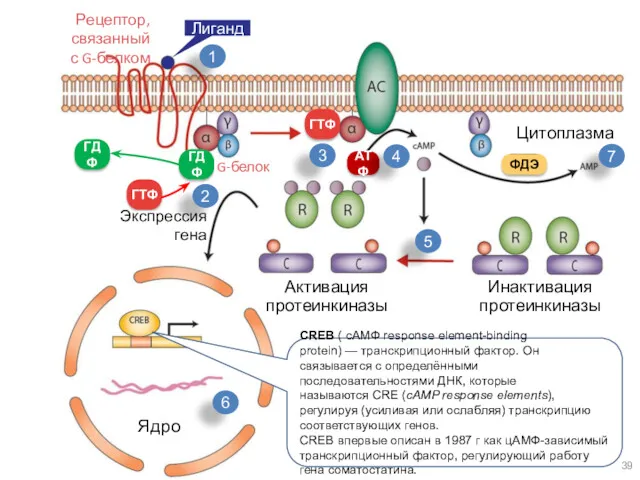
- 38. Передача сигнала с помощью рецептора третьего типа осуществляется поэтапно: 1) связывание сигнального вещества с рецептором третьего
- 39. Рецептор, связанный с G-белком Лиганд ГТФ ГТФ ГДФ ГДФ G-белок Экспрессия гена ФДЭ Активация протеинкиназы Инактивация
- 40. 5) медленный гидролиз связанного ГТФ до ГДФ переводит α-субъединицу в неактивное состояние и она вновь связывается
- 41. Вторичные мессенджеры Вторичные мессенджеры (посредники) – внутриклеточные вещества, передающие информацию от мембранного рецептора на исполняющие внутриклеточные
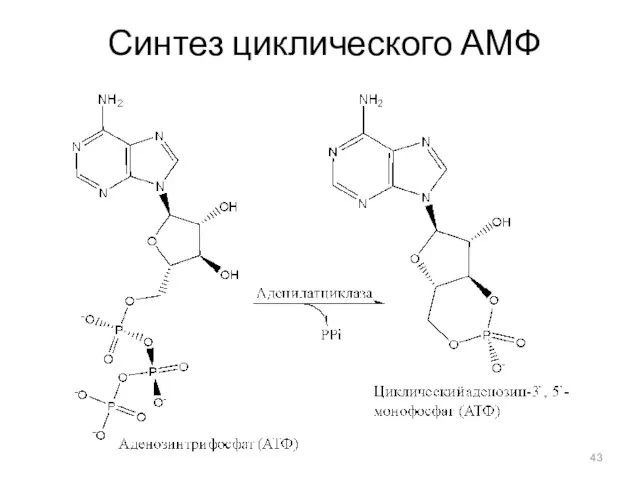
- 42. Циклический АМФ Биосинтез: нуклеотид цАМФ (3',5'-циклоаденозинмонофосфат, сАМP) синтезируется мембранными аденилатциклазами – семей-ством ферментов, катализирующих реакцию циклизации
- 43. Синтез циклического АМФ
- 44. Механизм действия цАМФ является аллостерическим эффектором протеинкиназ А (ПК-Α) и ионных каналов. В неактивном состоянии ПК-Α
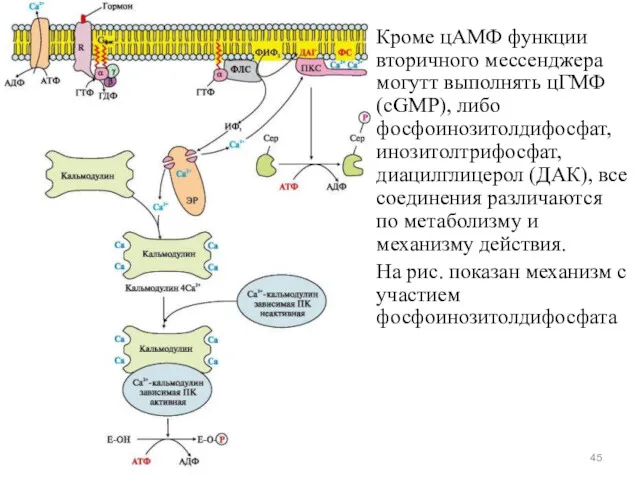
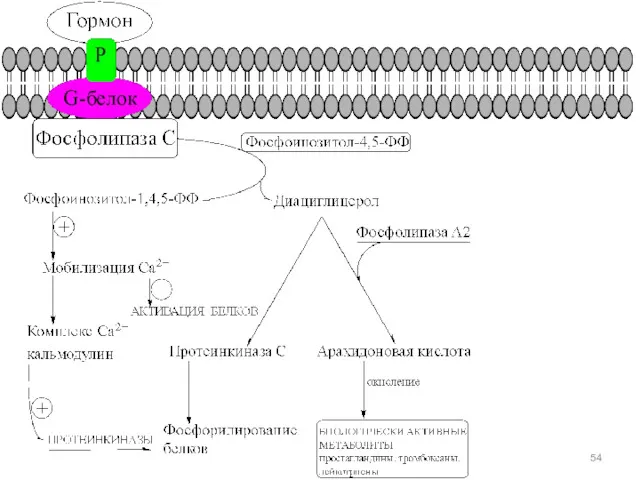
- 45. Кроме цАМФ функции вторичного мессенджера могутт выполнять цГМФ (cGMP), либо фосфоинозитолдифосфат, инозитолтрифосфат, диацилглицерол (ДАК), все соединения
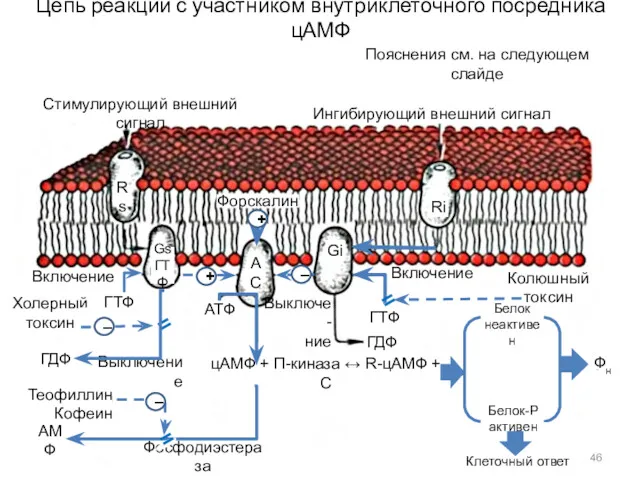
- 46. Цепь реакций с участником внутриклеточного посредника цАМФ Стимулирующий внешний сигнал Ингибирующий внешний сигнал Форскалин Включение Колюшный
- 47. Цепь реакций с участником внутриклеточного посредника цАМФ Rs — возбуждающий рецептор, Ri — тормозный рецептор, Gs
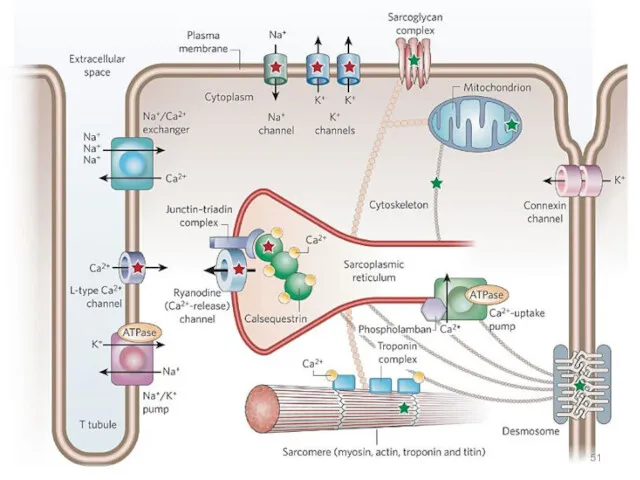
- 48. Роль ионов кальция Концентрация Са2+ в цитоплазме нестимулированной клетки очень низка (10-100 нМ). Низкий уровень поддерживается
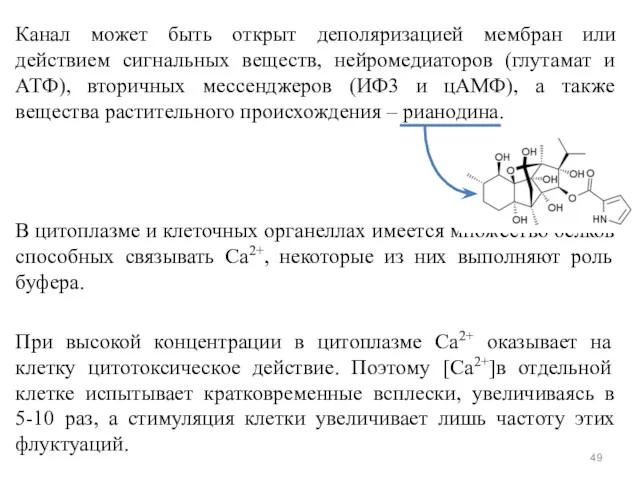
- 49. Канал может быть открыт деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ), вторичных мессенджеров
- 50. Действие кальция Опосредовано специальными Са2+-связывающими белками («кальциевыми сенсорами»): аннексин, кальмодулин и тропонин. Кальмодулин — сравнительно небольшой
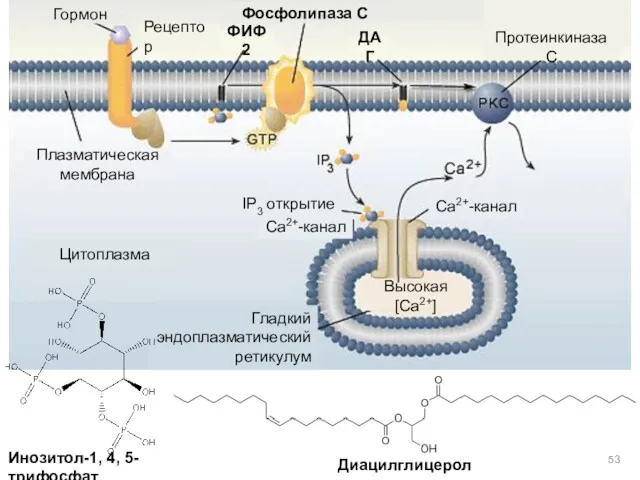
- 52. Инозит-1,4,5-трифосфат и диацилглицерин Фосфолипаза С гидролизует фосфатидилинозит-4,5-дифосфат [ФИФ2 (PlnsP2)], что приводит к образованию двух вторичных мессенджеров:
- 53. Гормон Рецептор Фосфолипаза С Протеинкиназа С Цитоплазма ДАГ PTI Ca2+-канал Ca2+-канал IP3 открытие Плазматическая мембрана Гладкий
- 55. Рецепторы с собственной ферментативной активностью имеют внеклеточный лиганд-связывающий домен, трансмембранный участок и внутриклеточную часть, внутриклеточная часть
- 56. Рецепторы с собственной ферментативной активностью бывают: с тирозинкиназной активностью; с серин-треонин киназной активностью; связанные с тирозинкиназами;
- 57. 1. Рецепторы с тирозинкиназной активностью при связывании с сигнальной молекулой димеризуются, что включает их активность и
- 58. 3. Рецепторы, связанные с тирозинкиназами не являются ферментами, но тесно связаны с тирозинкиназами, находящимися в цитозоле,
- 59. Рецепторы цитокинов Цитокины — гидрофильные сигнальные вещества, действие которых опосредовано тирозинкиназными рецепторами на внешней стороне плазматической
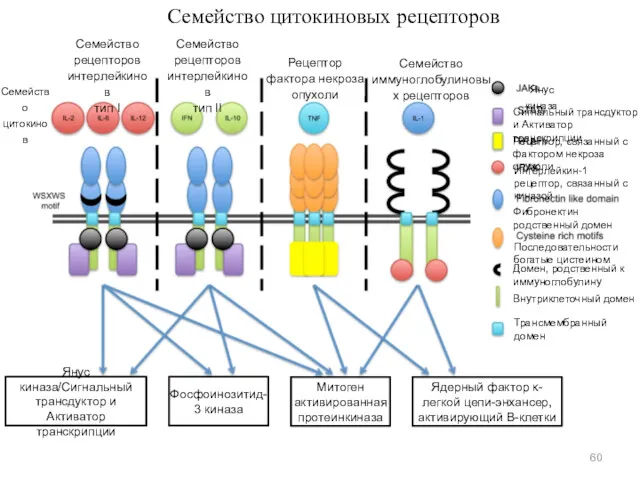
- 60. Семейство цитокиновых рецепторов Семейство рецепторов интерлейкинов тип I Семейство рецепторов интерлейкинов тип II Рецептор фактора некроза
- 61. Цитокиновые рецепторы могут образовывать гетеродимеры за счет связывания со вспомогательными белками-переносчиками сигнала [БПС (STP)] или стимулировать
- 62. ПСАТ белки относятся к семейству БПС, имеющих в структуре SH2-домен, узнающий остатки фосфотирозина. Поэтому они обладают
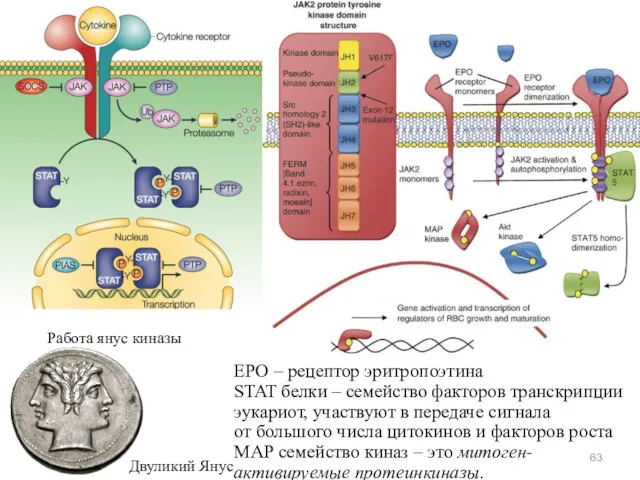
- 63. Работа янус киназы Двуликий Янус EPO – рецептор эритропоэтина STAT белки – семейство факторов транскрипции эукариот,
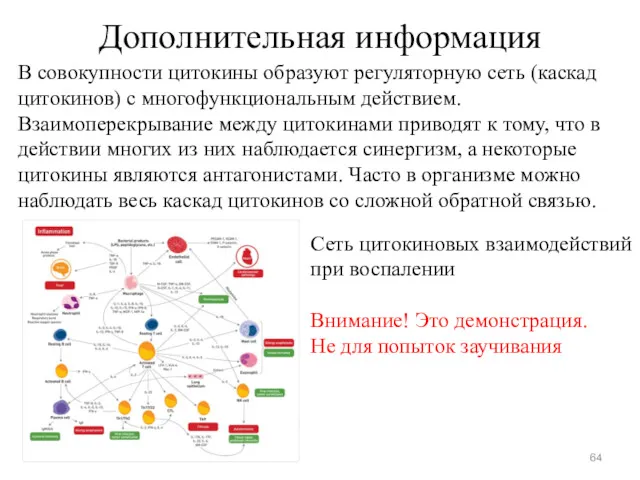
- 64. Дополнительная информация В совокупности цитокины образуют регуляторную сеть (каскад цитокинов) с многофункциональным действием. Взаимоперекрывание между цитокинами
- 65. Сигнальные пути Иногда активация рецептора внешним стимулом сразу приводит к ответу клетки. Например, когда нейротрансмиттер ГАМК
- 66. Сигнальный путь Notch относительно короток. Активация этого рецептора позволяет протеазе расщепить его, часть белка может затем
- 67. Например, эпидермальный фактор роста, связывая свой рецептор, активирует его аутокаталитическое фосфорилирование. Фосфорилированный рецептор может связывать адапторный
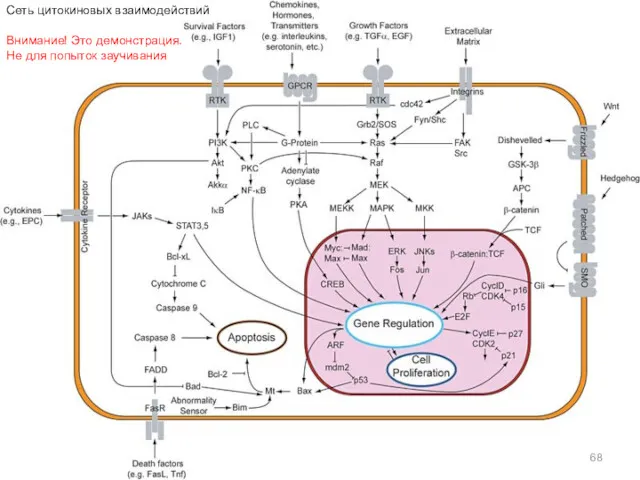
- 68. Сеть цитокиновых взаимодействий Внимание! Это демонстрация. Не для попыток заучивания
- 70. Скачать презентацию





























![Инозит-1,4,5-трифосфат и диацилглицерин Фосфолипаза С гидролизует фосфатидилинозит-4,5-дифосфат [ФИФ2 (PlnsP2)], что](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/157733/slide-51.jpg)










 Система опоры и движения. Скелет
Система опоры и движения. Скелет Строение цветка. Соцветие. Значение оплодотворения
Строение цветка. Соцветие. Значение оплодотворения Флуор. Його роль в організмі людини
Флуор. Його роль в організмі людини Животные лесов умеренной зоны
Животные лесов умеренной зоны Наследственность и изменчивость организмов
Наследственность и изменчивость организмов Бұғылар, бітеумүйізділер (лат. Cervidae)
Бұғылар, бітеумүйізділер (лат. Cervidae) Ферменты. Гормоны
Ферменты. Гормоны Корень. Урок биологии 6 класс
Корень. Урок биологии 6 класс Городские птицы
Городские птицы презентация к уроку Ветер
презентация к уроку Ветер методическая разработка урока на тему: клеточное строение листа для 6 класса
методическая разработка урока на тему: клеточное строение листа для 6 класса Презентация Первая помощь при кровотечениях.
Презентация Первая помощь при кровотечениях. Биологические ритмы и сон
Биологические ритмы и сон Основы здорового питания собак и кошек
Основы здорового питания собак и кошек Интерактивное пособие по теме Мышцы
Интерактивное пособие по теме Мышцы Сезонные изменения в жизни организмов
Сезонные изменения в жизни организмов Строение волос
Строение волос Клеточная теория
Клеточная теория Ядовитые растения и животные
Ядовитые растения и животные Ферменты. Функции белков
Ферменты. Функции белков Введення в анатомію та фізіологію
Введення в анатомію та фізіологію Система живой природы
Система живой природы Спинномозговые нервы
Спинномозговые нервы Красная книга. Коала
Красная книга. Коала Тип Кольчатые черви
Тип Кольчатые черви Органические вещества в составе почвы
Органические вещества в составе почвы Класс Пресмыкающиеся, или Рептилии
Класс Пресмыкающиеся, или Рептилии Лекарственные растения желчегонного действия
Лекарственные растения желчегонного действия