Последовательность нарушений в клетке при гипоксии
Последовательность изменений в клетке в результате
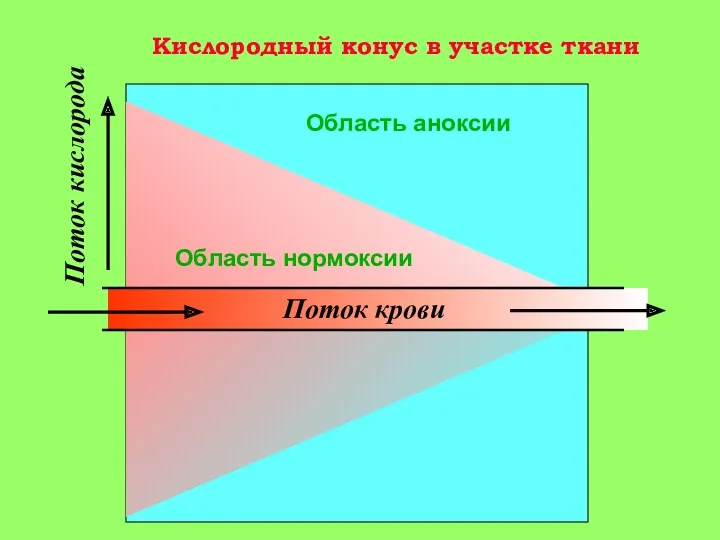
прекращения доступа кислорода (аноксии) одинакова для самых различных тканей. Это показали опыты со срезами тканей, изолированными клетками и изолированными клеточными органеллами, в частности митохондриями. В печени, находящейся в условиях аноксии при комнатной температуре, последовательность событий такова:
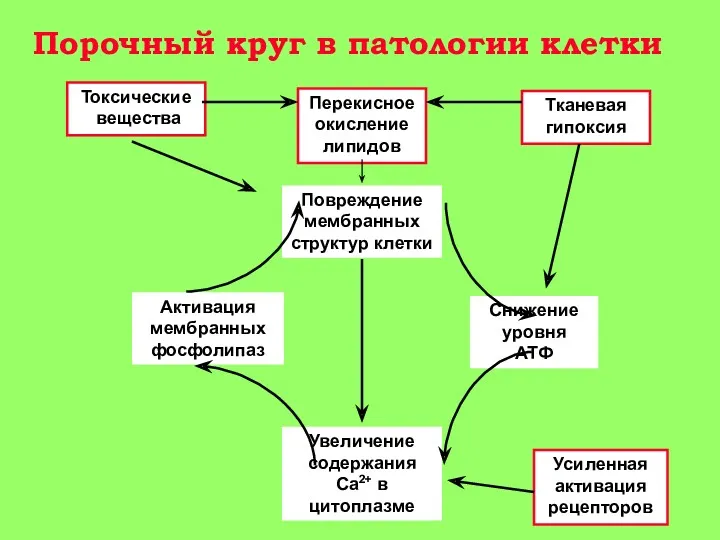
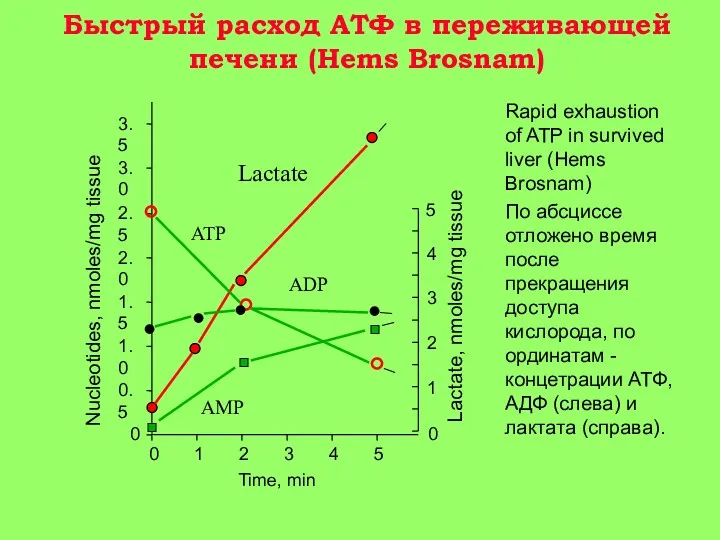
О-5 мин аноксии: снижение уровня АТФ в клетке в 2-4 раза, несмотря на активацию гликолиза;
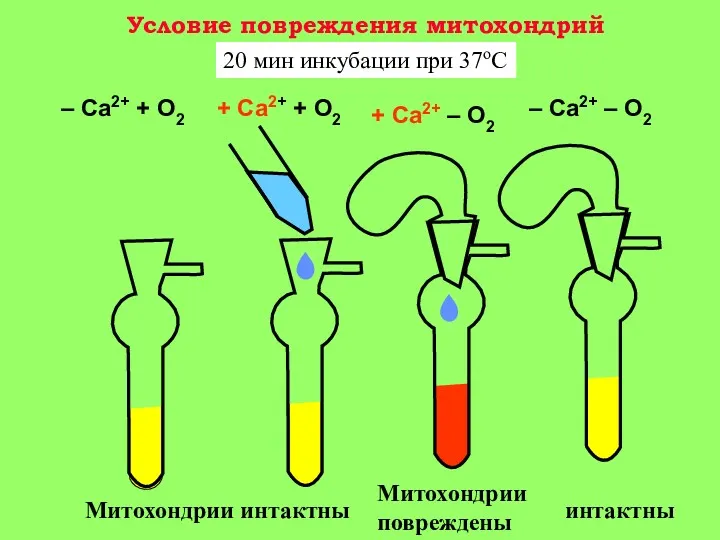
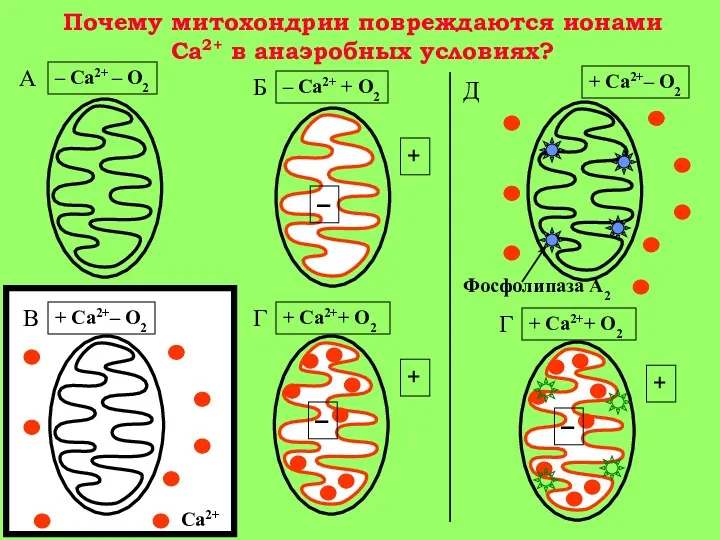
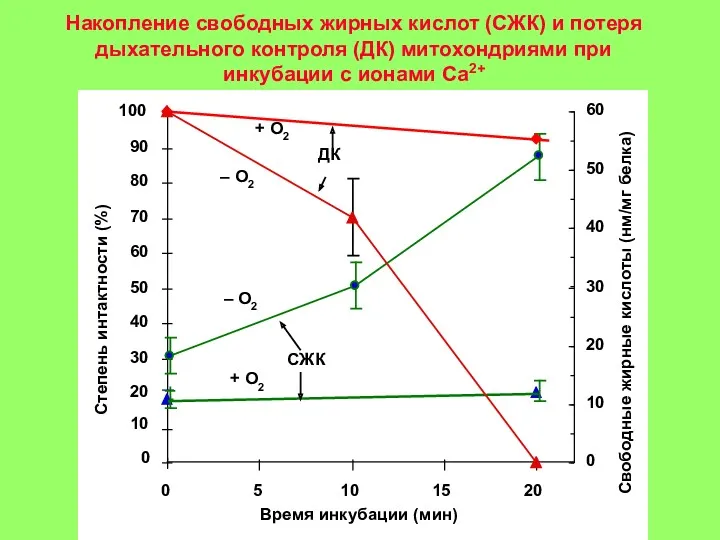
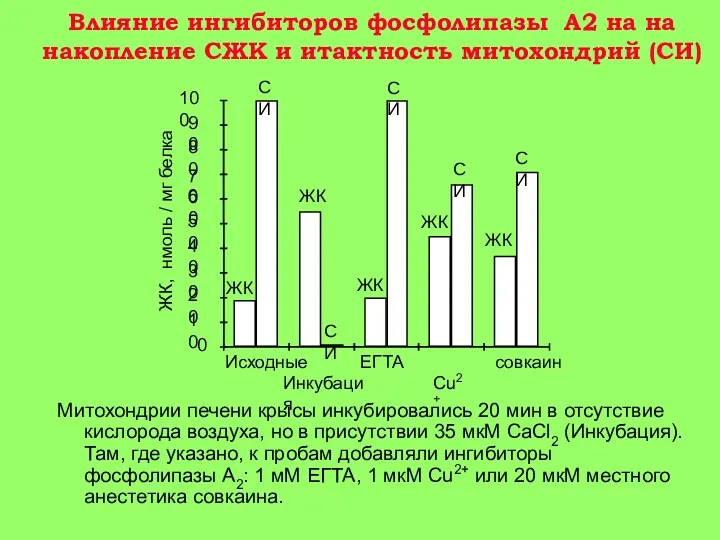
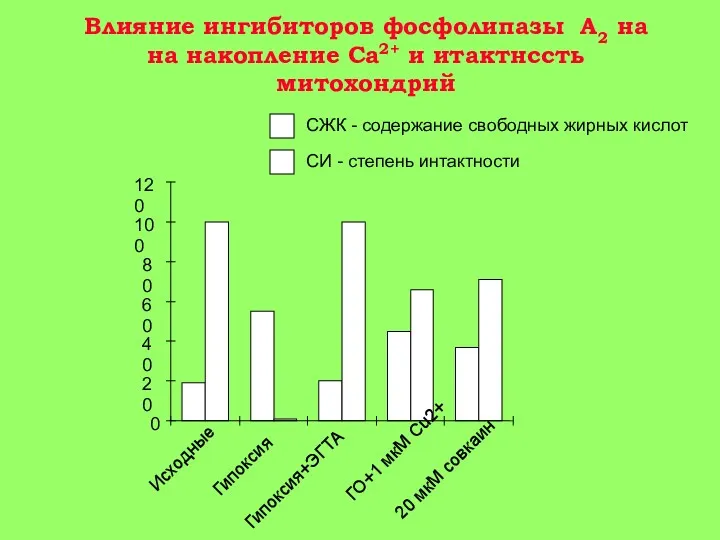
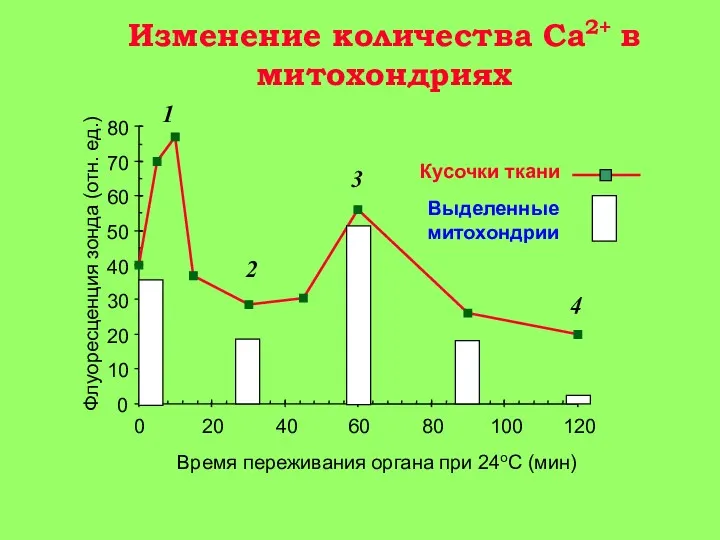
5-15 мин: появление Са+2 в цитоплазме клетки. Активация гидролитических ферментов, в том числе фермента фосфолипазы А2 митохондрий. Содержание Са+2 в митохондриях повышается, т. к. они еще не повреждены (стадия 1 на рис. 3).
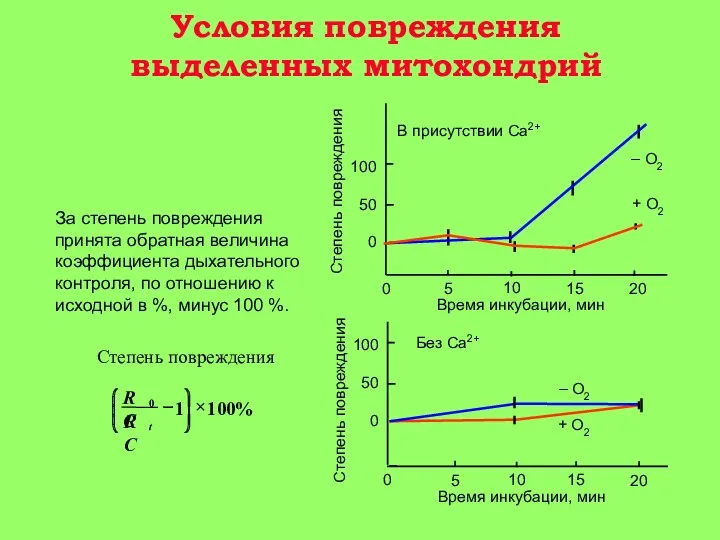
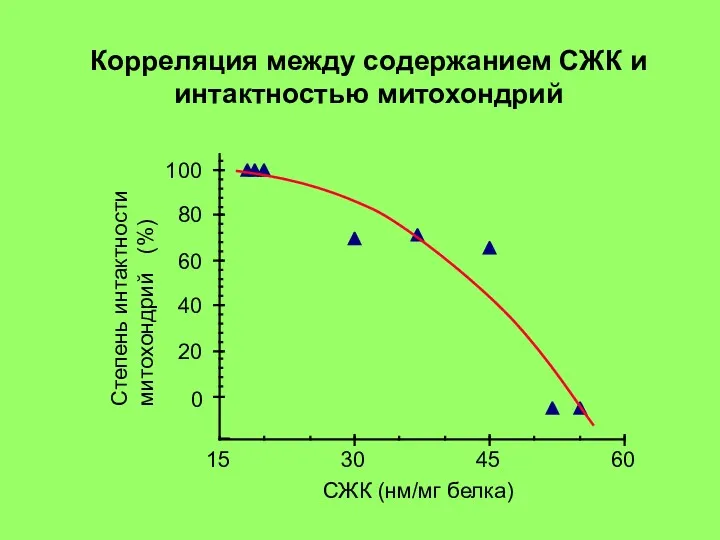
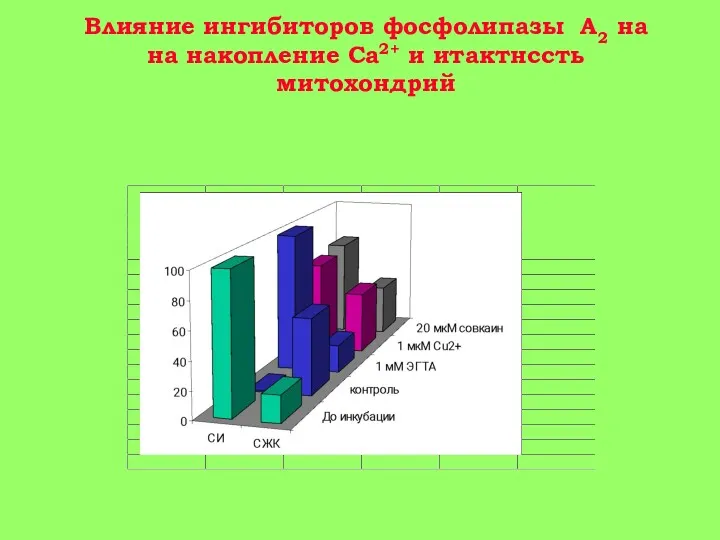
15-30 мин: гидролиз митохондриальных фосфолипидов фосфолипазой A2 и нарушение барьерных свойств митохондриальной мембраны. Реоксигенация ткани на этой стадии приводит к активному набуханию митохондрий. Дыхательный контроль в митохондриях нарушен, окислительное фосфорилирование разобщено, способность митохондрий накапливать ионы кальция снижена (стадия 2 на рис. 3).
30-60 мин: частичное восстановление функций митохондрий, временное повышение дыхательного контроля, способности накапливать кальций. (стадия 3 на рис. 3) Механизм компенсаторных процессов, приводящих к временному улучшению функций митохондрий, неизвестен, но связан с функцией клетки в целом, так как при анаэробной инкубации изолированных митохондриий это явление не наблюдается;
более 90 мин: необратимое повреждение митохондрий и полная гибель клеток (стадия 4 на рис. 3).
При температуре тела человека все эти процессы протекают примерно в два раза быстрее; кроме того, в разных тканях они протекают с разной скоростью: быстрее всего в мозге, медленнее – в печени, еще медленнее – в мышцах.



 Животные и растения в литературных, музыкальных, художественных произведениях
Животные и растения в литературных, музыкальных, художественных произведениях Плесень - вред или польза?
Плесень - вред или польза? Развитие птиц
Развитие птиц Аптека под ногами
Аптека под ногами Знаешь ли ты деревья
Знаешь ли ты деревья Животные Пермского периода
Животные Пермского периода Собака - друг человека. 4 класс
Собака - друг человека. 4 класс Внутриутробное развитие человека
Внутриутробное развитие человека Дикий кот манул
Дикий кот манул Пищеварительная система (наддиафрагмальный отдел пищеварительной трубки)
Пищеварительная система (наддиафрагмальный отдел пищеварительной трубки) Движение живых организмов
Движение живых организмов Узнай птицу с необычного ракурса
Узнай птицу с необычного ракурса Общая гистология. Эпителиальные ткани
Общая гистология. Эпителиальные ткани Нуклеиновые кислоты ДНК
Нуклеиновые кислоты ДНК Деление клеток
Деление клеток Скелетные ткани: хрящевые костные
Скелетные ткани: хрящевые костные Природное сообщество тайга. (Окружающий мир. 3 класс)
Природное сообщество тайга. (Окружающий мир. 3 класс) Растениеводство. Научные основы севооборотов и принципы их построения
Растениеводство. Научные основы севооборотов и принципы их построения Загадочный мир динозавров
Загадочный мир динозавров Презентация Семейство Паслёновые
Презентация Семейство Паслёновые Лекарственные растения Ставропольского края. 3 класс
Лекарственные растения Ставропольского края. 3 класс Защита посевов риса от основных сорняков, вредителей и болезней в Краснодарском крае
Защита посевов риса от основных сорняков, вредителей и болезней в Краснодарском крае Мышцы туловища животных. Мультимедийный проект
Мышцы туловища животных. Мультимедийный проект Передвижение веществ у растений
Передвижение веществ у растений Презентация Анализ проведения урока с позиции технологии здоровьесбережения
Презентация Анализ проведения урока с позиции технологии здоровьесбережения Ботаника. Отделы растений
Ботаника. Отделы растений Кролик – мой домашний питомец
Кролик – мой домашний питомец Насекомые леса
Насекомые леса