Содержание
- 2. Гидролитическое расщепление белков и полипептидов, поступающих вместе с пищей, происходит под действием протеолитических специфических и неспецифических
- 3. Внутриклеточный протеолиз осуществляется различными лизосомальными протеазами, амино- и карбоксипептидазами, дипептидазами. Большинство внутриклеточных протеолитических ферментов заключено в
- 4. ⅔ аминокислот, поступающих в клетки и образующихся в процессе внутриклеточного протеолиза, вовлекаются в биосинтез белка. Остальные
- 5. Продуктами декарбоксилирования аминокислот являются биогенные амины: гистамин (продукт декарбоксилирования гистидина), тирамин (из тирозина), кадаверин (из лизина),
- 6. Декарбоксилирование аминокислот необратимый ферментативный процесс, катализируемый декарбоксилазами аминокислот. Кофактор декарбоксилаз аминокислот – пиридоксальфосфат.
- 7. Дезаминирование аминокислот – отщепление α-аминогруппы – может происходить различными путями: восстановительное, гидролитическое, внутримолекулярное (элиминирующее), окислительное. Основным
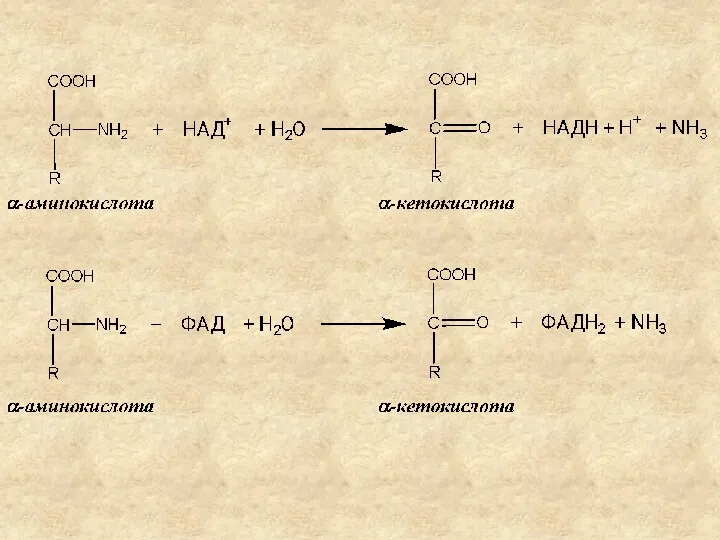
- 8. Окислительное дезаминирование катализируется: - НАД-зависимыми дегидрогеназами аминокислот; - ФАД (ФМН)-зависимыми оксидазами аминокислот. Продукты окислительного дезаминирования –
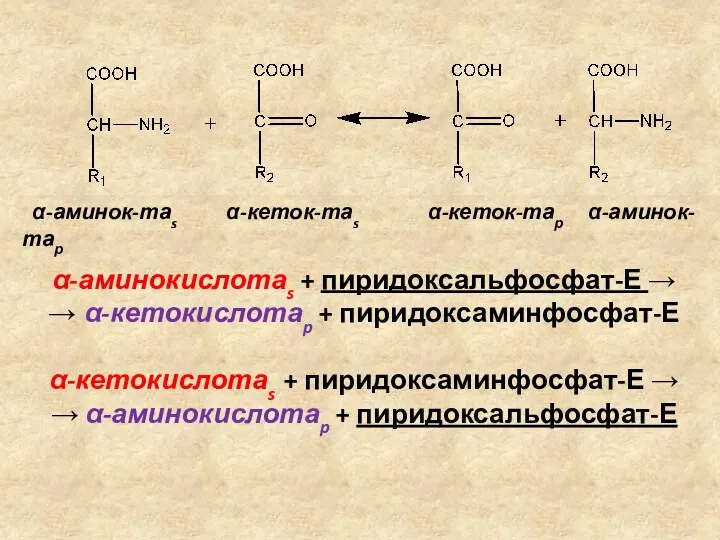
- 10. ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ Трансаминирование (переаминирование) аминокислот – реакция межмолекулярного переноса аминогруппы от α-аминокислоты на α-кетокислоту без промежуточного
- 11. α-аминокислотаs + пиридоксальфосфат-Е → → α-кетокислотаp + пиридоксаминфосфат-Е α-кетокислотаs + пиридоксаминфосфат-Е → → α-аминокислотаp + пиридоксальфосфат-Е
- 12. Аммиак, образующийся при дезаминировании, используется: для синтеза заменимых аминокислот – восстановительное аминирование; для синтеза азотсодержащих соединений.
- 13. ТИПЫ АЗОТИСТОГО ОБМЕНА в зависимости от формы выведения аммиака Аммониотелический тип у водных животных. Конечный продукт
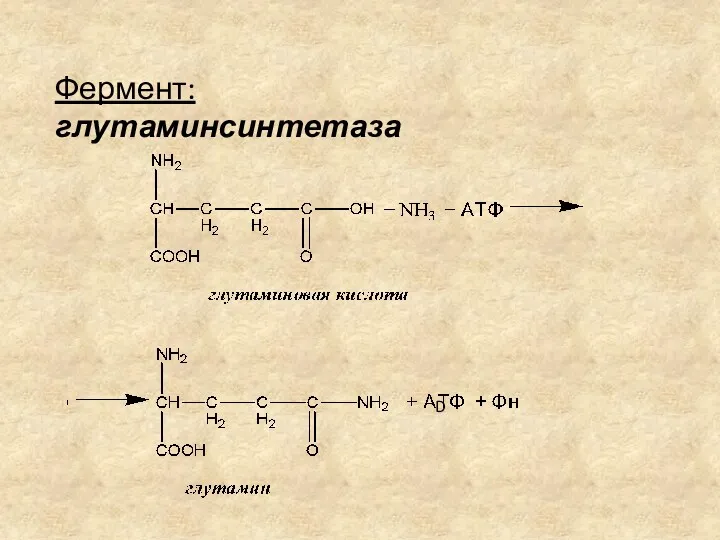
- 14. БИОСИНТЕЗ ГЛУТАМИНА Образование амидов (глутамина и аспарагина) – процесс первичного связывания аммиака в клетках. Биосинтез глутамина
- 15. Фермент: глутаминсинтетаза D
- 16. ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВНИЯ 1. Синтез карбамоилфосфата Фермент: карбамоилфосфат-синтетаза Синтез карбамоилфосфата происходит в митохондриях клеток печени. Донор
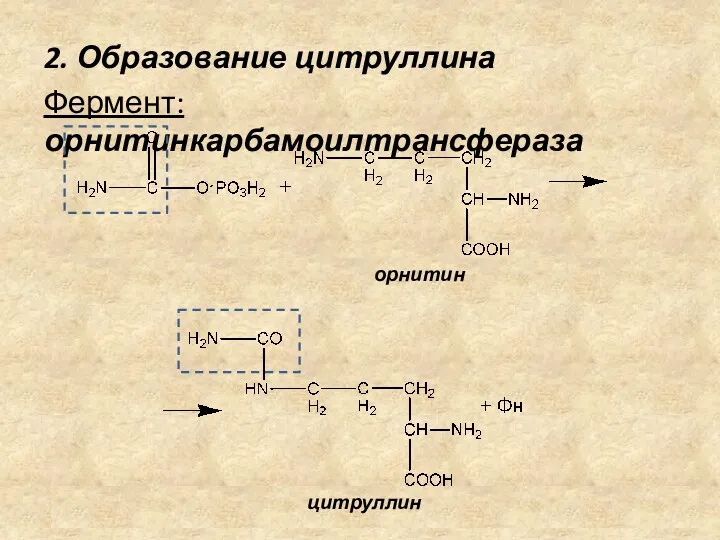
- 17. 2. Образование цитруллина Фермент: орнитинкарбамоилтрансфераза орнитин цитруллин
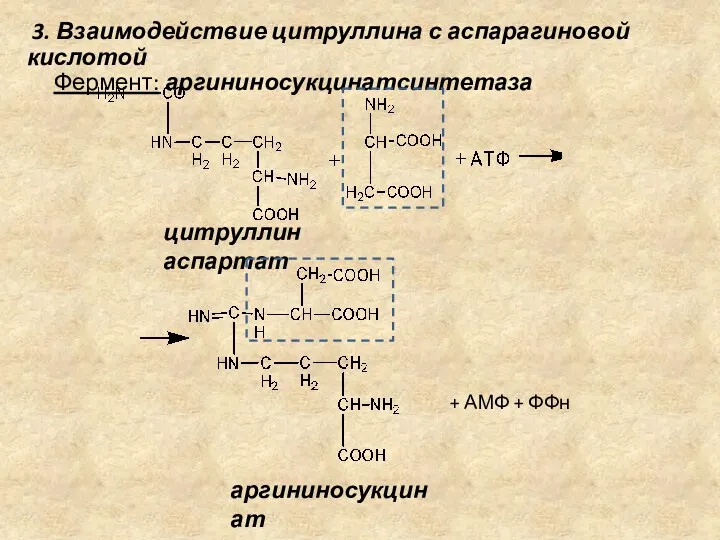
- 18. 3. Взаимодействие цитруллина с аспарагиновой кислотой Фермент: аргининосукцинатсинтетаза цитруллин аспартат + АМФ + ФФн аргининосукцинат
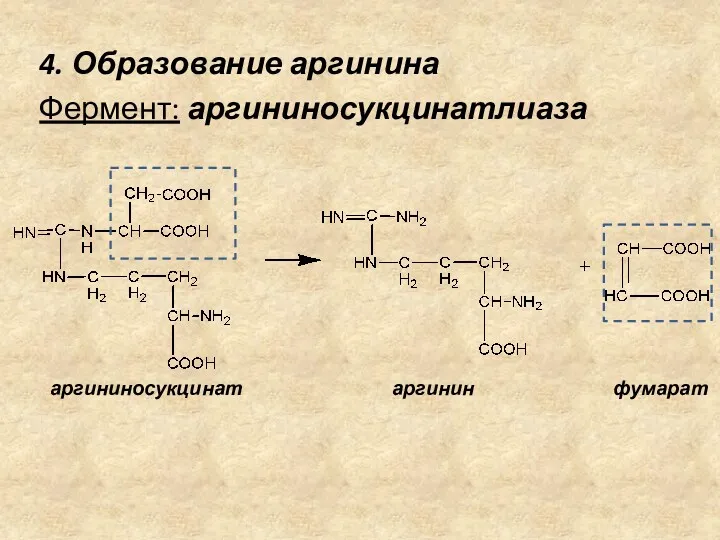
- 19. 4. Образование аргинина Фермент: аргининосукцинатлиаза
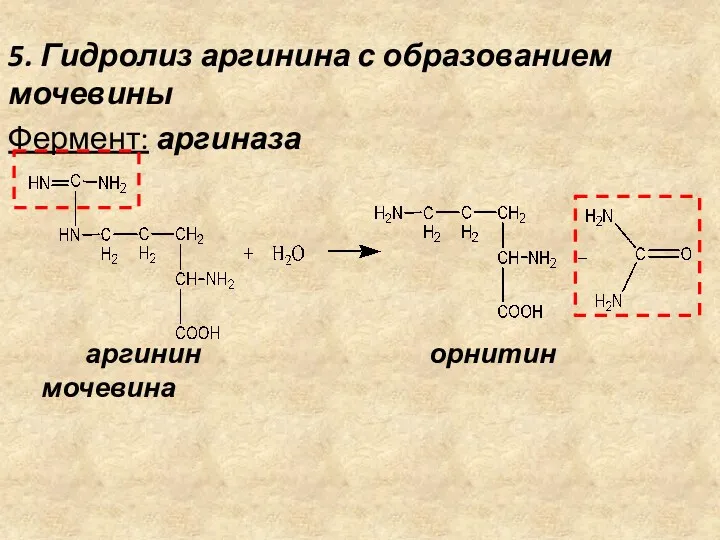
- 20. 5. Гидролиз аргинина с образованием мочевины Фермент: аргиназа аргинин орнитин мочевина
- 21. Суммарное уравнение мочевинообразования СО2 + NH3 + аспартат + 3АТФ + 2Н2О → → мочевина +
- 22. БИОСИНТЕЗ АМИНОКИСЛОТ Аминокислоты, образующиеся при гидролизе белков: 2/3 расходуются на синтез белка; 1/3 катаболизируются. Т.е. 1/3
- 23. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ Заменимые аминокислоты: ала, асн, асп, гли, глн, глу, про, сер, тир, цис Незаменимые
- 25. Скачать презентацию















 Основные методы селекции животных
Основные методы селекции животных Назвать изображенных животных и определить к какому отряду млекопитающих они принадлежат
Назвать изображенных животных и определить к какому отряду млекопитающих они принадлежат Животные Омского Прииртышья (насекомые). Занятие № 39
Животные Омского Прииртышья (насекомые). Занятие № 39 Фізичні параметри радіобіологічних процесів
Фізичні параметри радіобіологічних процесів Лук – зелёный друг
Лук – зелёный друг Современная нейробиология
Современная нейробиология Цікаві факті про черепах. 7 клас
Цікаві факті про черепах. 7 клас Цитология и гистология: введение
Цитология и гистология: введение Бактерии: строение и жизнедеятельность. 5 класс
Бактерии: строение и жизнедеятельность. 5 класс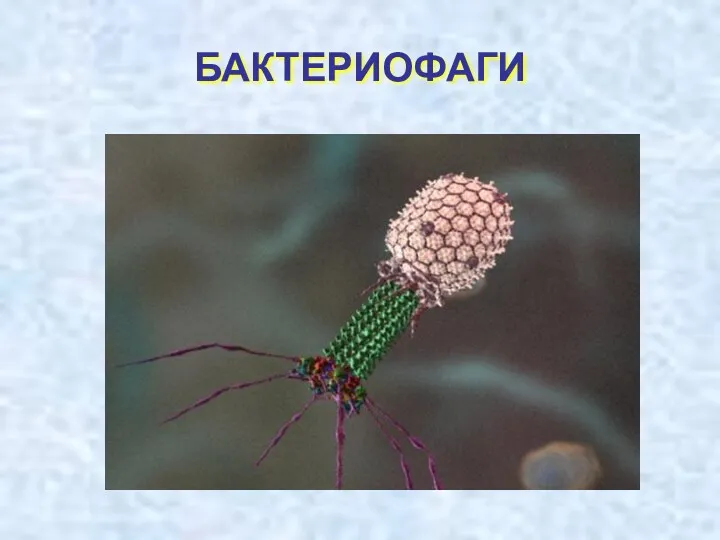 Бактериофаги. Особенности бактериофагов
Бактериофаги. Особенности бактериофагов Органогенез. Постэмбриональное развитие.
Органогенез. Постэмбриональное развитие. Физиология сна. Биологическое значение сна
Физиология сна. Биологическое значение сна Ноосфера
Ноосфера Критерии вида. Популяция – структурная единица вида и эволюции
Критерии вида. Популяция – структурная единица вида и эволюции Бактерии в геохимических круговоротах. Круговорот азота
Бактерии в геохимических круговоротах. Круговорот азота Захист зелених насаджень від шкідників і хвороб
Захист зелених насаджень від шкідників і хвороб Қол қаңқасының сүйектер
Қол қаңқасының сүйектер Классификация и краткие характеристики основных групп токсикантов
Классификация и краткие характеристики основных групп токсикантов Анатомия человека
Анатомия человека Презентация Витамины биология 8 класс
Презентация Витамины биология 8 класс Генетика. Наследственность
Генетика. Наследственность Анатомо-физиологические особенности нервной системы. Развитие нервной системы в онтогенезе
Анатомо-физиологические особенности нервной системы. Развитие нервной системы в онтогенезе Квалификационная работа. Использование охотничьих ресурсов в закрепленных и общедоступных угодьях Кировской области
Квалификационная работа. Использование охотничьих ресурсов в закрепленных и общедоступных угодьях Кировской области Опале листя, користь чи шкода
Опале листя, користь чи шкода Строение нуклеотидов и структура полинуклеотидных цепей ДНК и РНК
Строение нуклеотидов и структура полинуклеотидных цепей ДНК и РНК Цветок, его строение и значение. Соцветия
Цветок, его строение и значение. Соцветия Хомячки
Хомячки Методология селекции мутантов с дефектами экспрессии генов и регуляции обмена веществ
Методология селекции мутантов с дефектами экспрессии генов и регуляции обмена веществ