Содержание
- 2. Живые системы (клетка ? организм) – открытые системы: обмениваются с окружающей их средой ма- терией, энергией
- 3. Специфические функции метаболизма: Извлечение энергии из окружающей среды (хим. энергию из орган. веществ, либо энергию квантов
- 4. Процесс жизнедеятельности связан с выполнением следующих видов работы: Механическая работа. Организм и его части движутся, преодолевая
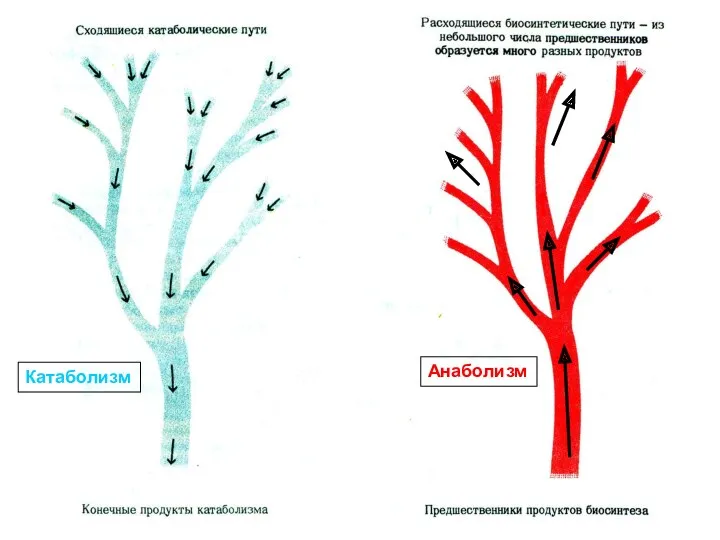
- 5. Метаболизм объединяет противоположно направ-ленные процессы: катаболизм и анаболизм. Катаболизм – ферментативное расщепление слож-ных, полимерных молекул (жиров,
- 6. Анаболизм – ферментативный синтез полимерных молекул из сравнительно простых по химическому строению предшественников (прекурсоров). Как всякий
- 7. Катаболизм и анаболизм протекают в клетках одно-временно. Они пространственно разделены (разобщены) путем компартментализации и/или с помощью
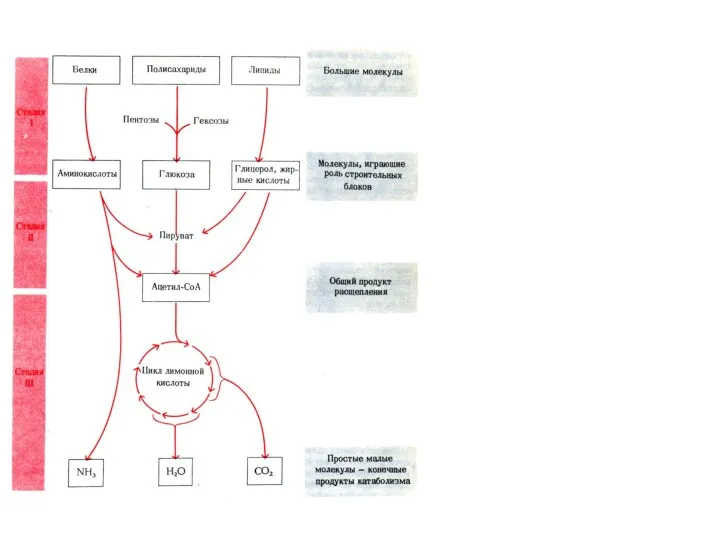
- 8. Метаболический путь – последовательность хими-ческих реакций, катализируемых мультиферментны-ми системами (от 2 до 20 ферментов). Все ферменты
- 9. Катаболизм Анаболизм
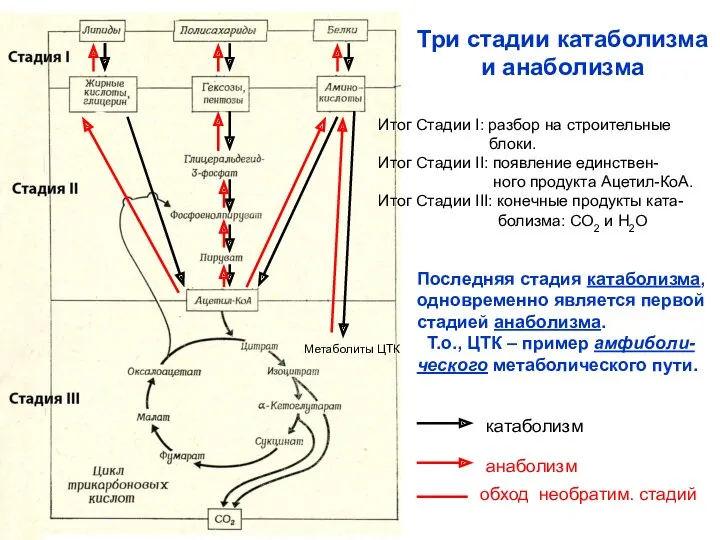
- 11. катаболизм анаболизм Три стадии катаболизма и анаболизма обход необратим. стадий Метаболиты ЦТК Итог Стадии I: разбор
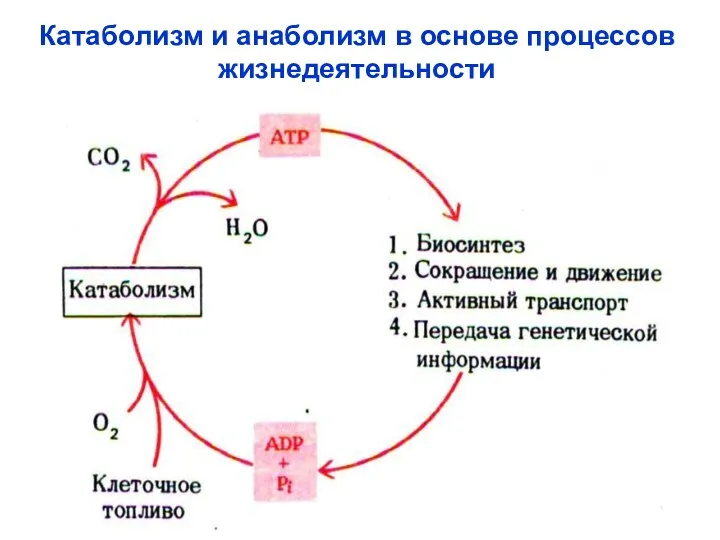
- 12. Катаболизм и анаболизм в основе процессов жизнедеятельности
- 13. Формы аккумулирования энергии в клетке: АТФ. Другие нуклеозид-трифосфаты: Гуано- зин-ТФ, Уридин-ТФ и Цитидин-ТФ. Содержат- ся в
- 14. 2. Пиридиновые и флавиновые нуклеотиды: НАДН, НАДФН и ФАДН2. 2.1. НАДН и ФАДН2 – специфические перенос-
- 15. 3. Трансмембранный градиент протонов (Н+) на внутренней мембране митохондрий, создаваемый дыхательной цепью.
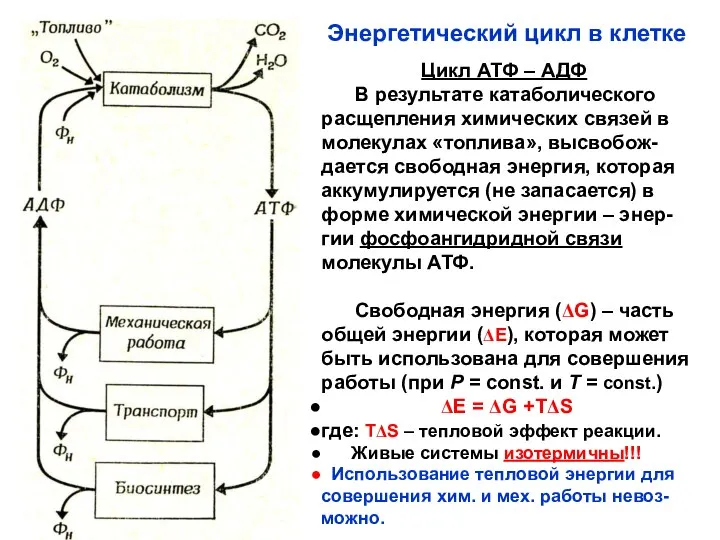
- 16. Энергетический цикл в клетке Цикл АТФ – АДФ В результате катаболического расщепления химических связей в молекулах
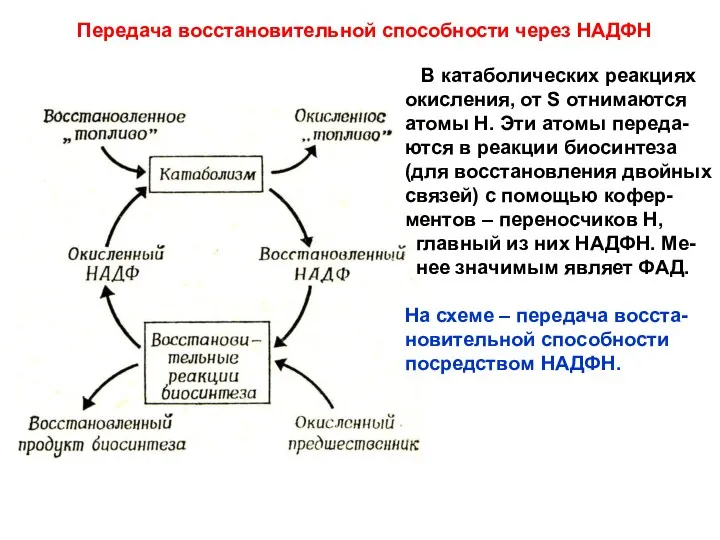
- 17. Передача восстановительной способности через НАДФН В катаболических реакциях окисления, от S отнимаются атомы Н. Эти атомы
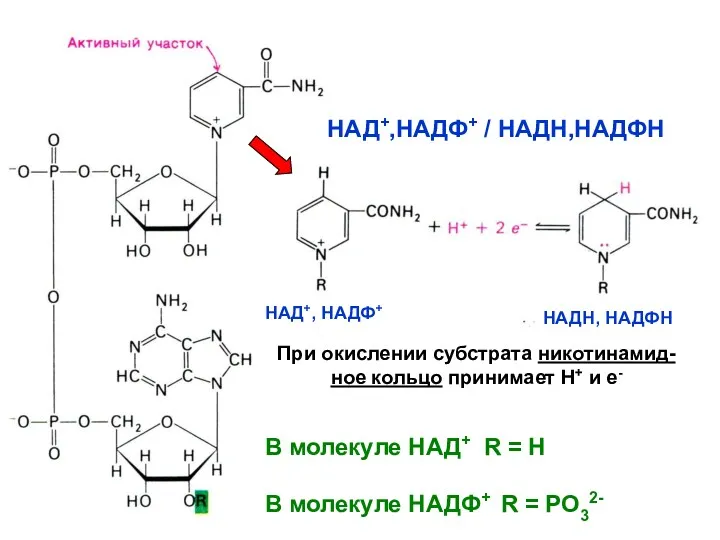
- 18. НАД+,НАДФ+ / НАДН,НАДФН В молекуле НАД+ R = H В молекуле НАДФ+ R = PO32- При
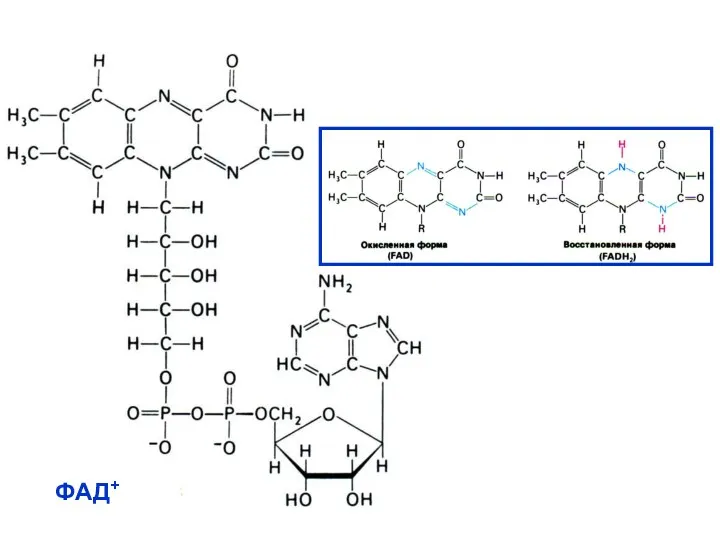
- 19. ФАД+
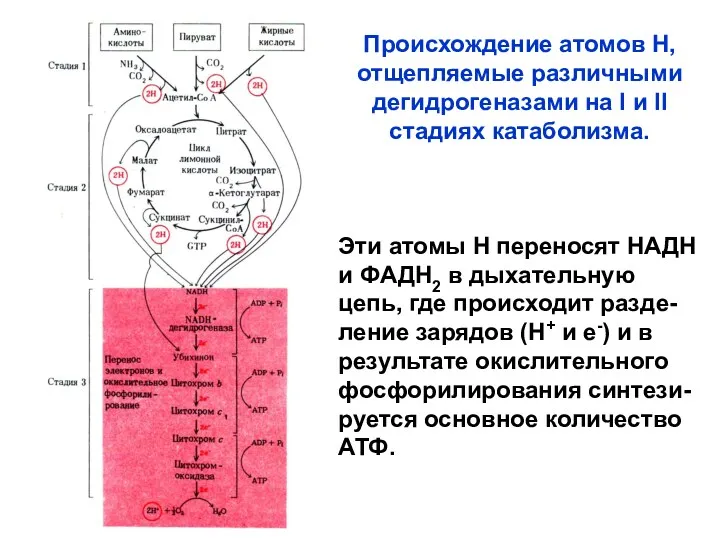
- 20. Происхождение атомов Н, отщепляемые различными дегидрогеназами на I и II стадиях катаболизма. Эти атомы Н переносят
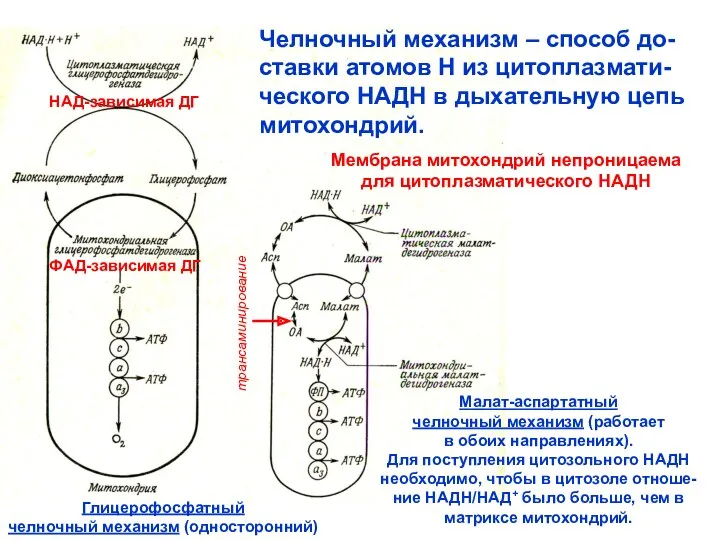
- 21. Челночный механизм – способ до- ставки атомов Н из цитоплазмати- ческого НАДН в дыхательную цепь митохондрий.
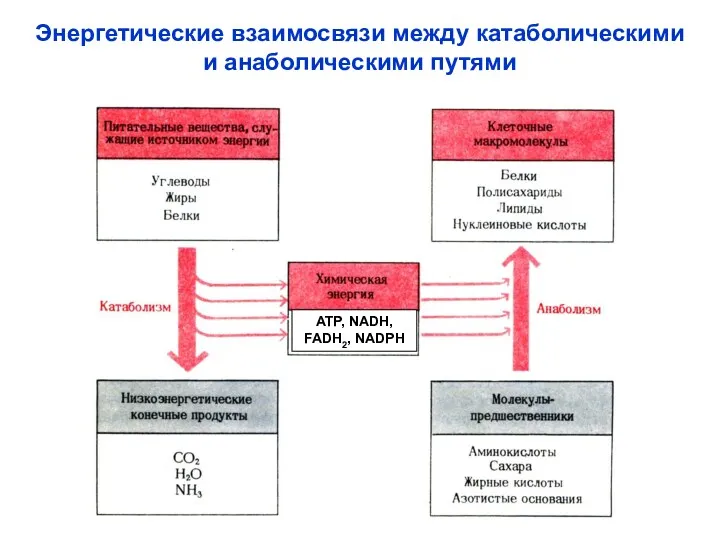
- 22. Энергетические взаимосвязи между катаболическими и анаболическими путями ATP, NADH, FADH2, NADPH
- 23. Согласно определению В.П.Скулачева: Биоэнергетика – раздел биохимии (биологии), изучающая превращение энергии внешних ресурсов в биологи-чески полезную
- 24. Законы биоэнергетики Липмана I закон биоэнеретики: катаболические процессы сопровождаются аккумулировани-ем энергии (в основном – АТФ). Все
- 25. Система АТФ ?? АДФ + Фн работает как центральный переносчик свободной энергии. 1929 г. – Фиске
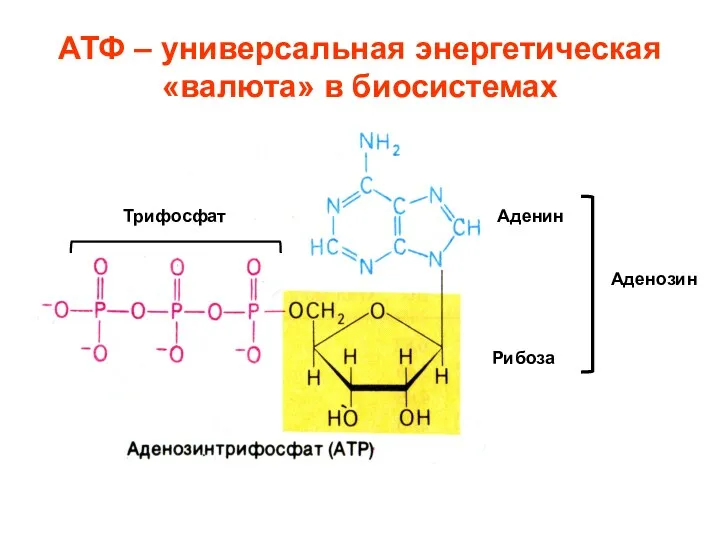
- 26. АТФ – универсальная энергетическая «валюта» в биосистемах Аденин Рибоза Трифосфат Аденозин
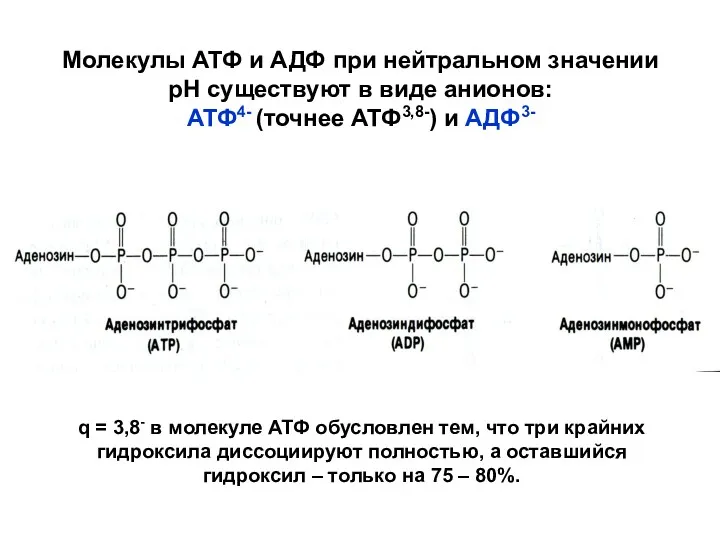
- 27. Молекулы АТФ и АДФ при нейтральном значении рН существуют в виде анионов: АТФ4- (точнее АТФ3,8-) и
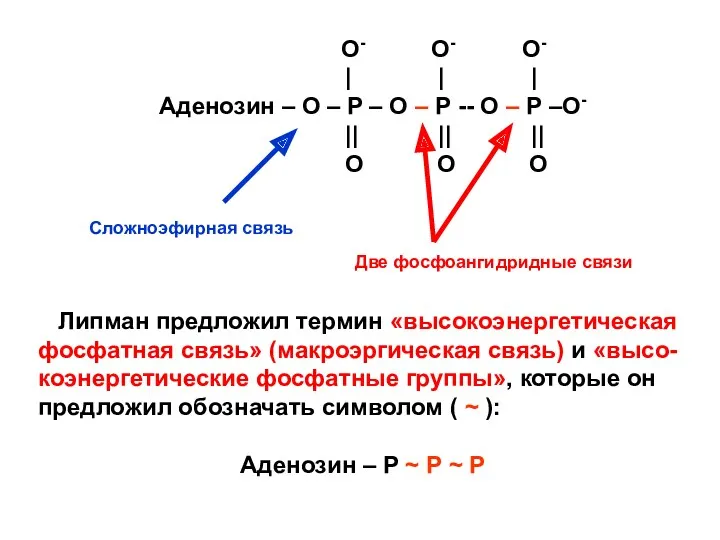
- 28. O- O- O- | | | Аденозин – О – Р – О – Р --
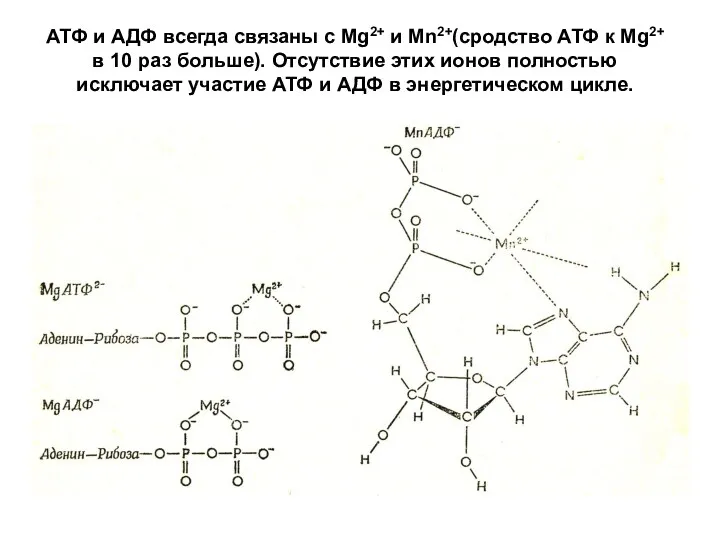
- 29. АТФ и АДФ всегда связаны с Mg2+ и Mn2+(сродство АТФ к Mg2+ в 10 раз больше).
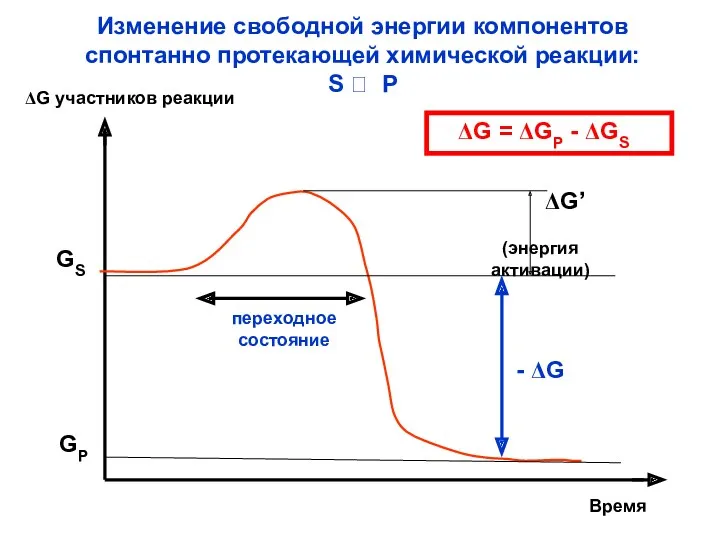
- 30. Изменение свободной энергии компонентов спонтанно протекающей химической реакции: S ? P ΔG участников реакции GS GP
- 31. Спонтанные химические процессы протекают до тех пор, пока не достигнут состояния равновесия: aA + bB ??
- 32. Стандартная свободная энергия гидролиза АТФ (ΔGo): Установлено, что ΔGo для реакации гидролиза концевой фосфоангидридной (макроэргической) связи
- 33. Чему равно изменение свободной энергии (ΔG) гидролиза АТФ в интактных клетках? ΔGo АТФ = - 7,3
- 34. Причины относительно высокой ΔGo гидролиза АТФ Три структурных фактора: При рН = 7,0 молекула АТФ полностью
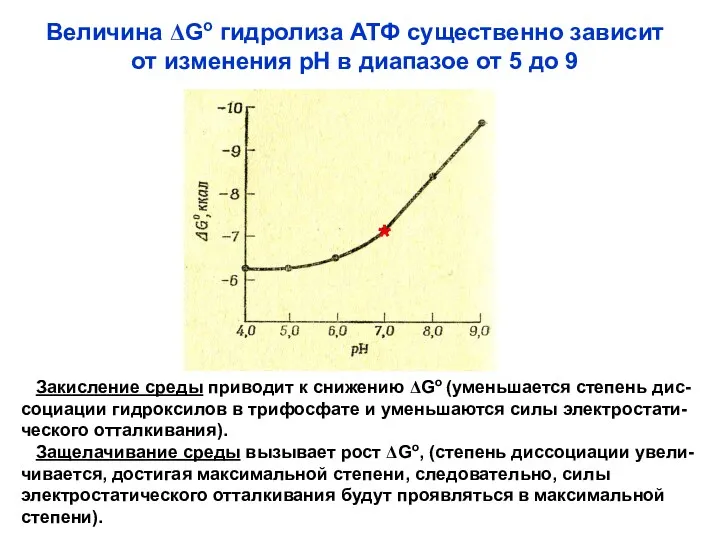
- 35. Величина ΔGo гидролиза АТФ существенно зависит от изменения рН в диапазое от 5 до 9 Закисление
- 36. При «классическом» гидролизе АТФ теряет одну концевую ортофосфатную группу - ортофосфатное расщепление АТФ: АТФ + Н2О
- 37. Показателем энергетического статуса клетки служит энергетический заряд (ЭЗ) по Д. Аткинсону: [ATP] + ½ [ADP] Энергетический
- 38. АТФ – непосредственно используемый донор сво-бодной энергии. Это не форма запасания свободной энергии. АТФ постоянно синтезируется
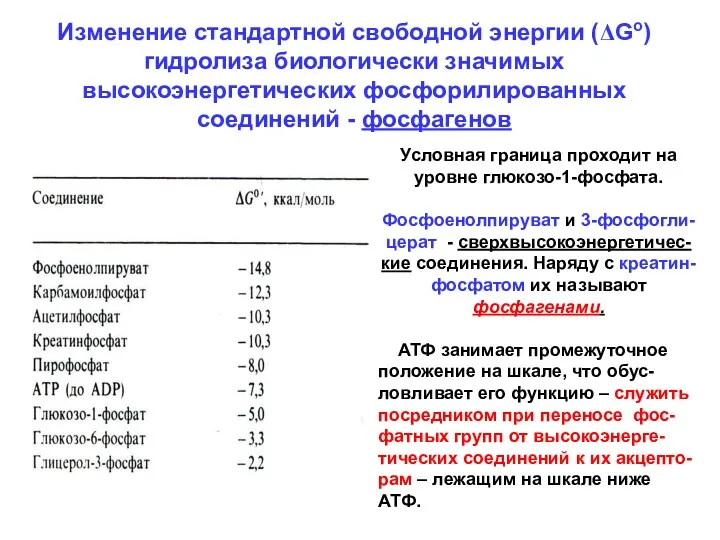
- 39. Изменение стандартной свободной энергии (ΔGo) гидролиза биологически значимых высокоэнергетических фосфорилированных соединений - фосфагенов Условная граница проходит
- 40. Перенос фосфатных групп от фосфогенов (доноров фосфатных групп) через АДФ к различным соединениям - акцепторам ФЕП
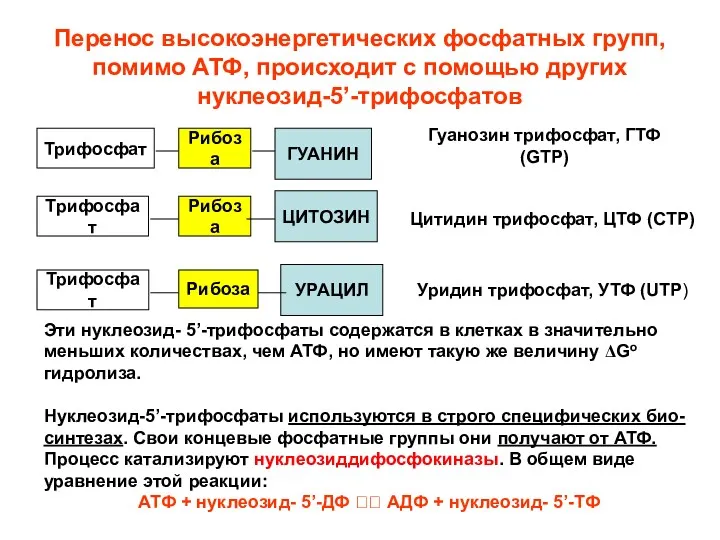
- 41. Перенос высокоэнергетических фосфатных групп, помимо АТФ, происходит с помощью других нуклеозид-5’-трифосфатов Трифосфат Трифосфат Рибоза ГУАНИН Рибоза
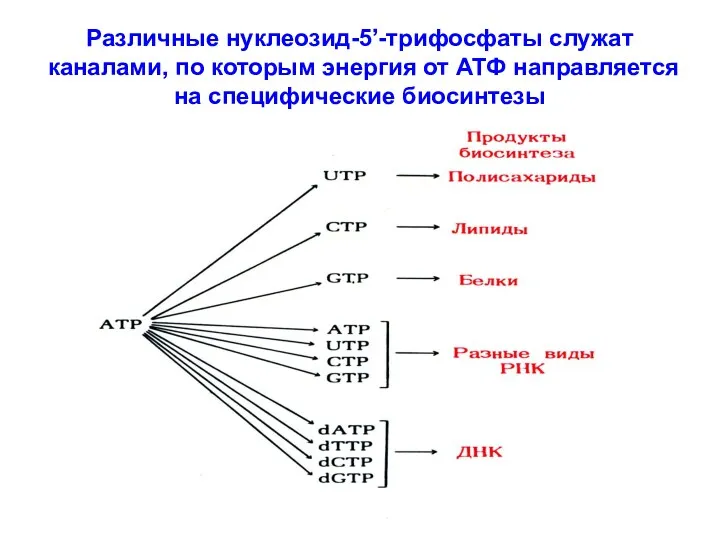
- 42. Различные нуклеозид-5’-трифосфаты служат каналами, по которым энергия от АТФ направляется на специфические биосинтезы
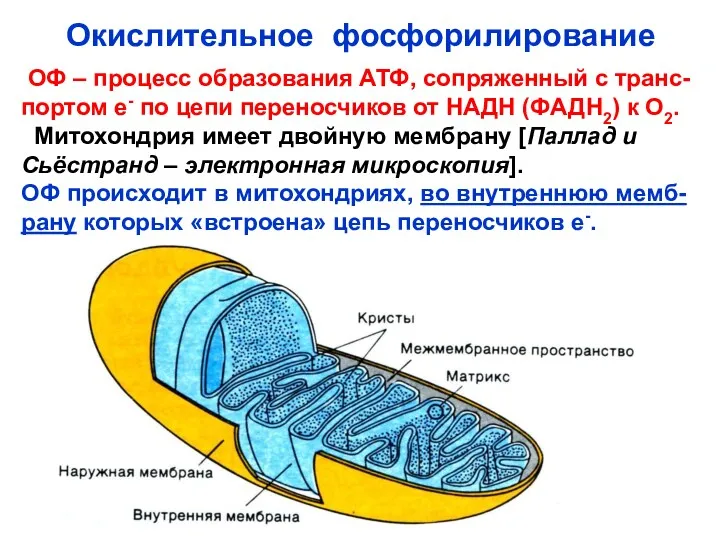
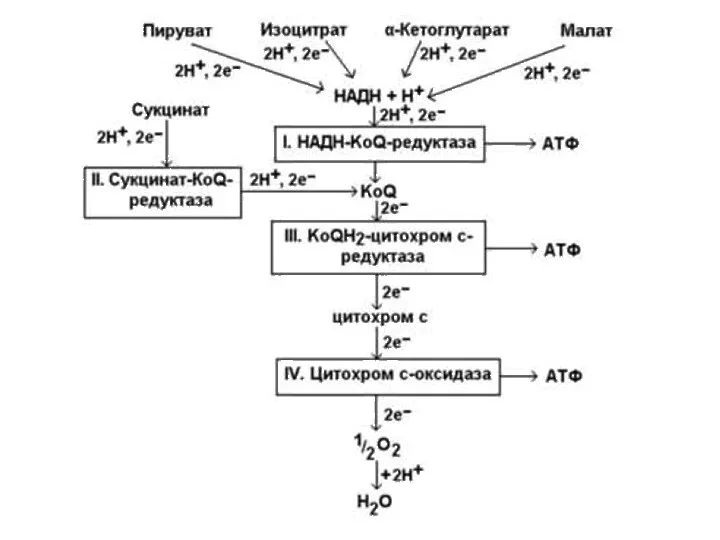
- 43. Окислительное фосфорилирование ОФ – процесс образования АТФ, сопряженный с транс- портом е- по цепи переносчиков от
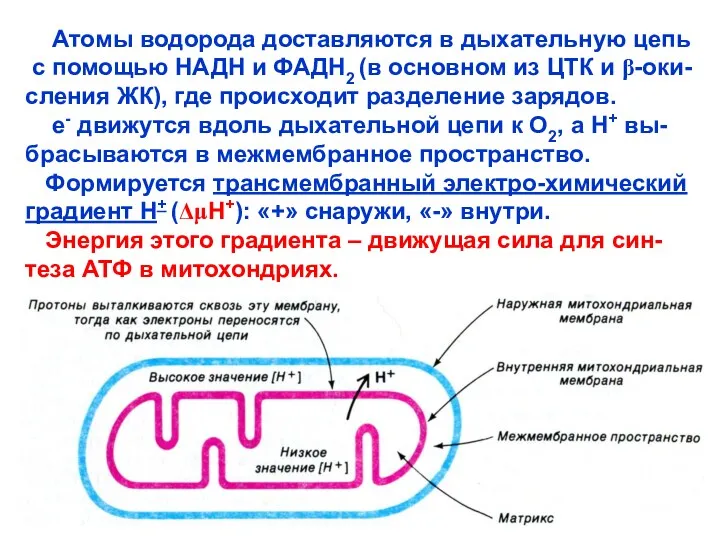
- 44. Атомы водорода доставляются в дыхательную цепь с помощью НАДН и ФАДН2 (в основном из ЦТК и
- 45. Во внутренней мембране митохондрий нахо- дятся переносчики е- , составляющие дыха- тельную цепь, и ферменты, синтезирующие
- 46. Свойства внутренней мембраны митохондрий Эта мембрана не проницаема для Н+ и большинства ионов, пиридиновых нуклеотидов, а
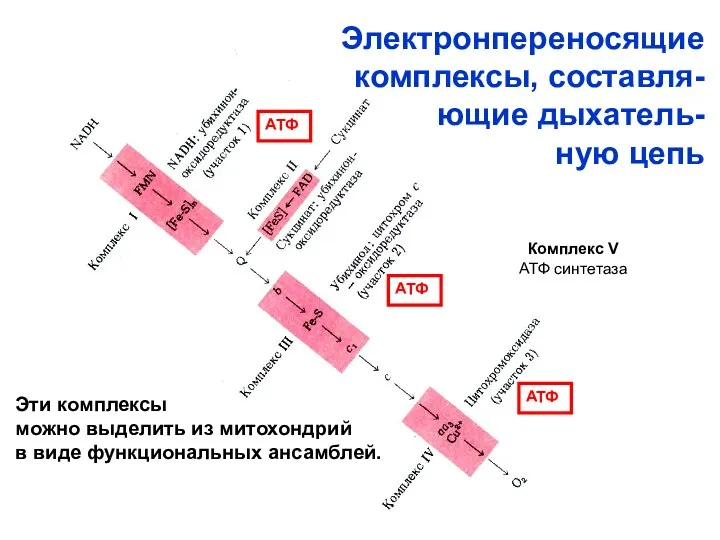
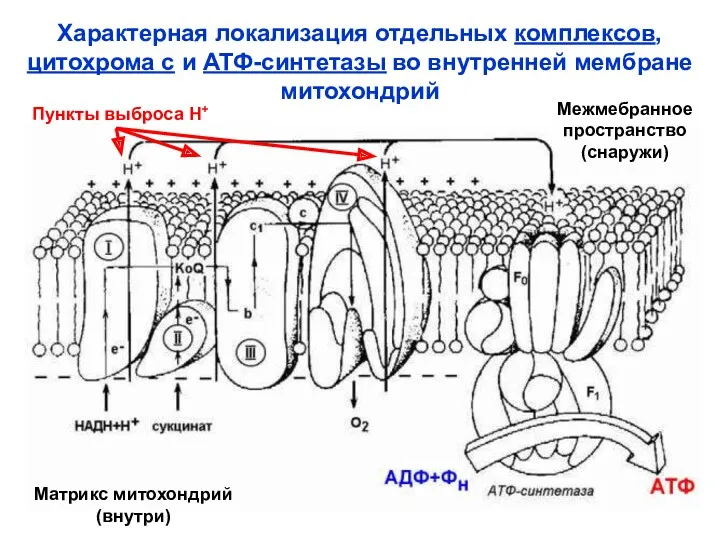
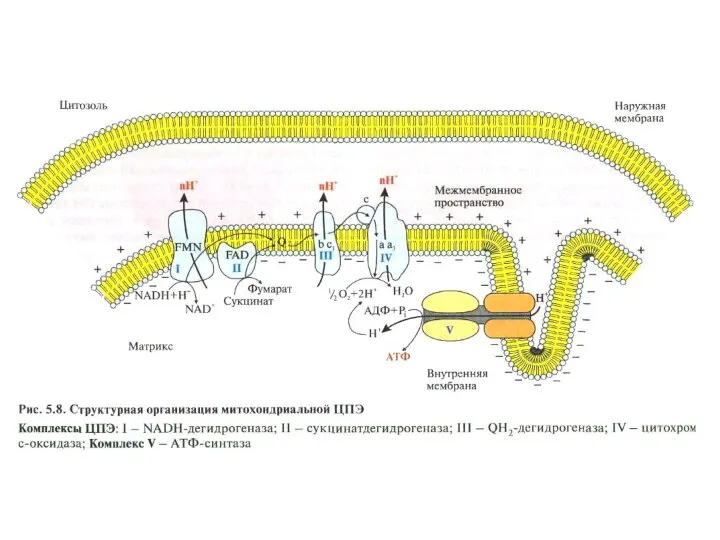
- 47. Переносчики Н+ и е- в дыхательной цепи организованы в форме пяти структурно обособленных комплексов, которые функцио-
- 48. Электронпереносящие комплексы, составля- ющие дыхатель- ную цепь АТФ АТФ АТФ Эти комплексы можно выделить из митохондрий
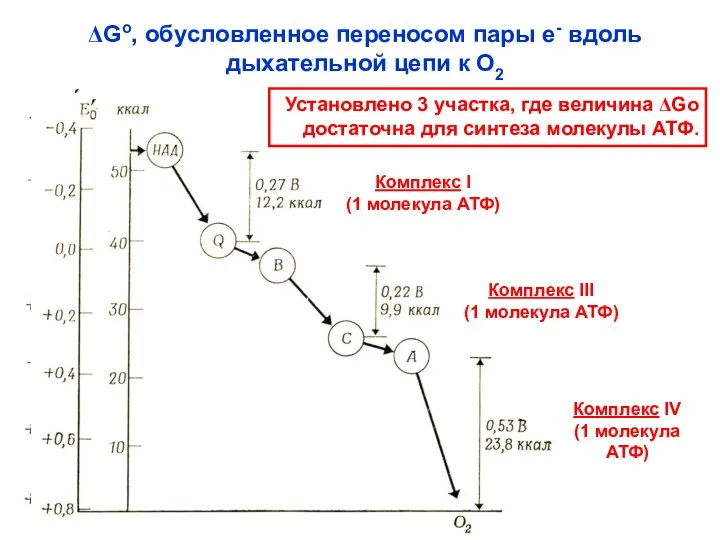
- 49. Последовательность переносчиков е- в дыха- тельной цепи находится в строгом соответст-вии с величиной их окислительно-восстанови-тельного потенциала
- 50. ΔGo, обусловленное переносом пары е- вдоль дыхательной цепи к О2 Установлено 3 участка, где величина ΔGo
- 51. Характерная локализация отдельных комплексов, цитохрома с и АТФ-синтетазы во внутренней мембране митохондрий Межмебранное пространство (снаружи) Матрикс
- 53. СТРОЕНИЕ КОМПЛЕКСОВ ДЫХАТЕЛЬНОЙ ЦЕПИ Комплекс I – НАДН : убихинон оксидоредуктаза (НАДН-ДГ). Сначала 2 е- от
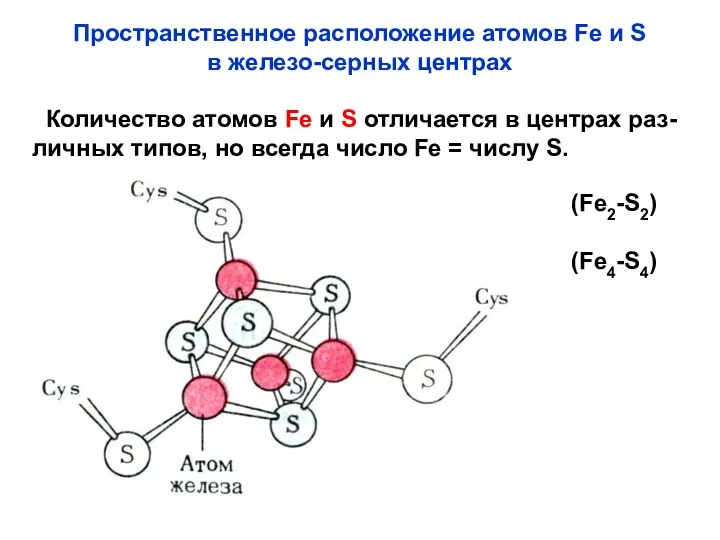
- 54. Пространственное расположение атомов Fe и S в железо-серных центрах Количество атомов Fe и S отличается в
- 55. Комплекс II – Сукцинат: убихинон оксидоредуктаза (Сукцинат-ДГ = СДГ) СДГ – флавопротеин, содержит ковалентно связан-ный ФАД
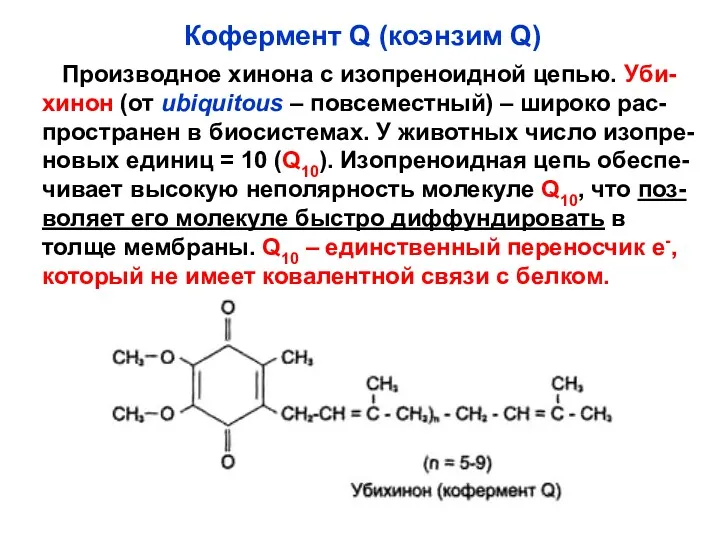
- 56. Кофермент Q (коэнзим Q) Производное хинона с изопреноидной цепью. Уби- хинон (от ubiquitous – повсеместный) –
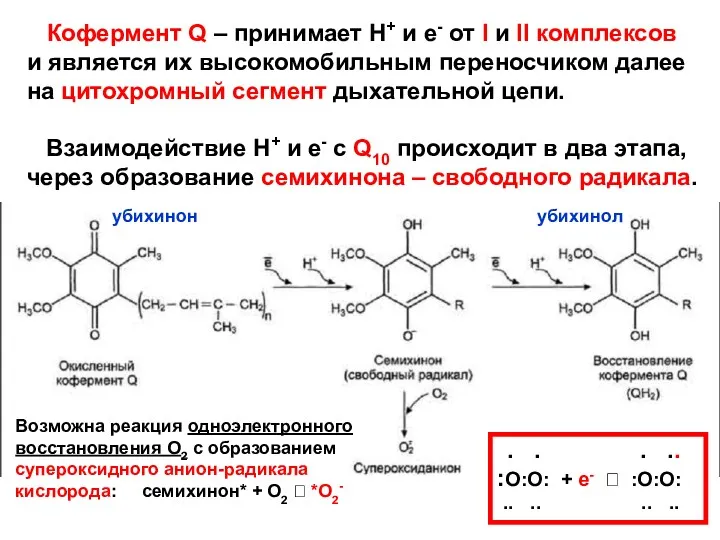
- 57. Кофермент Q – принимает Н+ и е- от I и II комплексов и является их высокомобильным
- 58. Комплекс III – Убихинол : цитохром с оксидоредуктаза Содержит цитохромы b и c1, а также Fe-S
- 59. Цитохромы – железосодержащие гемопротеиды, участвующие в переносе е- [Кейлин, 1925]. Простети-ческая группа – гем. В цит.
- 60. Комплекс IV – цитохром с-оксидаза (цитохромокси- даза) Содержит цитохромы а и а3. Их гемы отличаются от
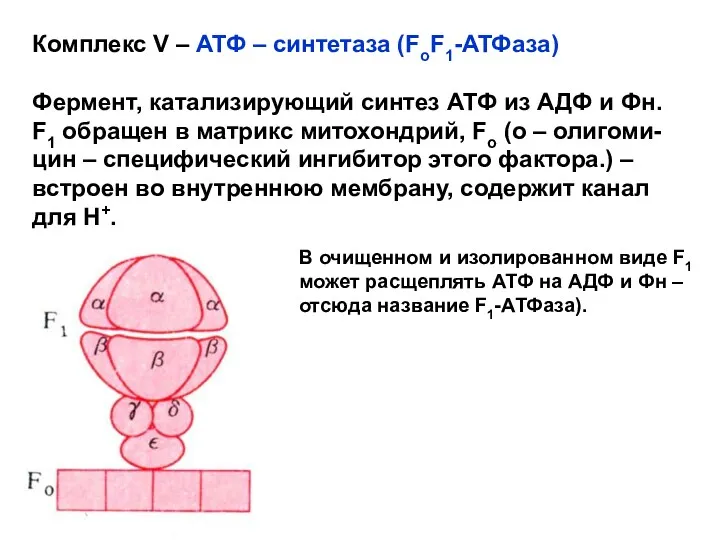
- 61. Комплекс V – АТФ – синтетаза (FoF1-АТФаза) Фермент, катализирующий синтез АТФ из АДФ и Фн. F1
- 63. Эволюция взглядов на механизмы сопряжения дыхания с фосфорилированием В начале 30-х годов ХХ века Энгельгардт (СССР)
- 64. В 1940 г. Белицер установил, что в результат переноса 2е- от субстрата к О2 образуется более
- 65. Гипотезы о механизмах окислительного фосфорилирования 1. Гипотеза химического сопряжения. В основе концепция, согласно которой перенос е-
- 66. За всю историю существования этой гипотезы и поисков промежуточного высокоэнергетического сое- динения (Aox.~I) – его так
- 67. 2. Химио-осмотическая гипотеза (Питер Митчел, 1961) Основные положения: Наличие замкнутой мембраны, непроницаемой для Н+. Дыхательная цепь
- 69. Скачать презентацию




























![Цитохромы – железосодержащие гемопротеиды, участвующие в переносе е- [Кейлин, 1925].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376689/slide-58.jpg)






 презентация Виртуальное путешествие по реке Белая НАО
презентация Виртуальное путешествие по реке Белая НАО Характеристика слухового анализатора
Характеристика слухового анализатора Гнили корней, стволов и ветвей деревьев, болезни, вызываемые дереворазрушающими грибами
Гнили корней, стволов и ветвей деревьев, болезни, вызываемые дереворазрушающими грибами Современные концепции происхождения человека и общества
Современные концепции происхождения человека и общества Прорастание семян
Прорастание семян Как классифицируют живые организмы
Как классифицируют живые организмы Паразитологические методы исследования
Паразитологические методы исследования Історія виноробства. Класифікація вин
Історія виноробства. Класифікація вин Необычные животные
Необычные животные Адаптационные особенности охраняемых животных северной территории Республики Коми
Адаптационные особенности охраняемых животных северной территории Республики Коми Лекарственные растения желчегонного действия
Лекарственные растения желчегонного действия Класс: Насекомые
Класс: Насекомые Мезозойская эра
Мезозойская эра Многообразие живых организмов. Царства живой природы
Многообразие живых организмов. Царства живой природы Функциональная анатомия спинного и головного мозга
Функциональная анатомия спинного и головного мозга Насекомые. Основные признаки насекомого
Насекомые. Основные признаки насекомого Кто живет в Африке
Кто живет в Африке Набута поведінка тварин. 7 клас
Набута поведінка тварин. 7 клас Пагін: будова, основні функції
Пагін: будова, основні функції Класс млекопитающие. Характеристика класса
Класс млекопитающие. Характеристика класса Живая и неживая природа. 2 класс
Живая и неживая природа. 2 класс Движение
Движение Экологические аспекты производства биопрепаратов
Экологические аспекты производства биопрепаратов Белый медведь
Белый медведь Обмен липидов. Особенности переваривания липидов у детей
Обмен липидов. Особенности переваривания липидов у детей Генетика пола
Генетика пола Биотические связи в природе. 9 класс
Биотические связи в природе. 9 класс Наследственность и изменчивость организмов
Наследственность и изменчивость организмов