Содержание
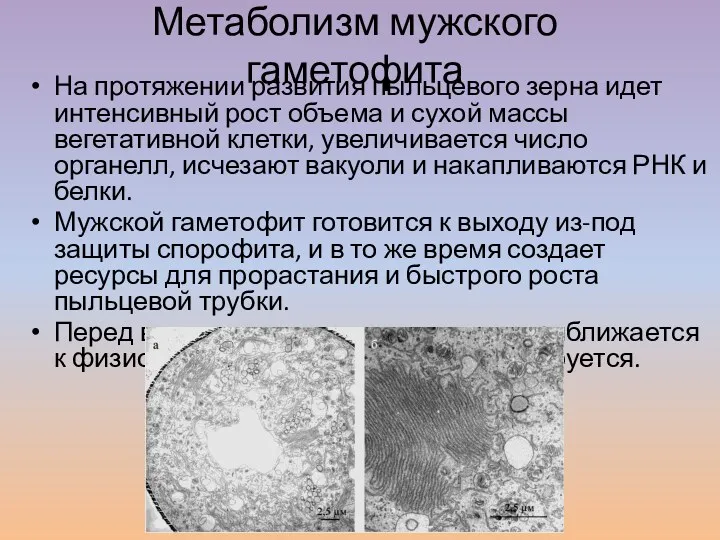
- 2. Метаболизм мужского гаметофита На протяжении развития пыльцевого зерна идет интенсивный рост объема и сухой массы вегетативной
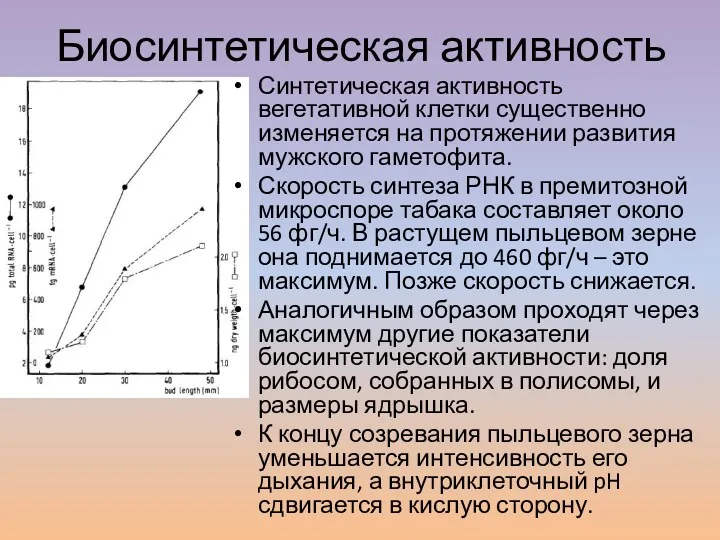
- 3. Биосинтетическая активность Синтетическая активность вегетативной клетки существенно изменяется на протяжении развития мужского гаметофита. Скорость синтеза РНК
- 4. Специфичные и обычные 1. Гены «домашнего хозяйства»(housekeeping genes), которые экспрессируются также в соматических клетках растений. 2.
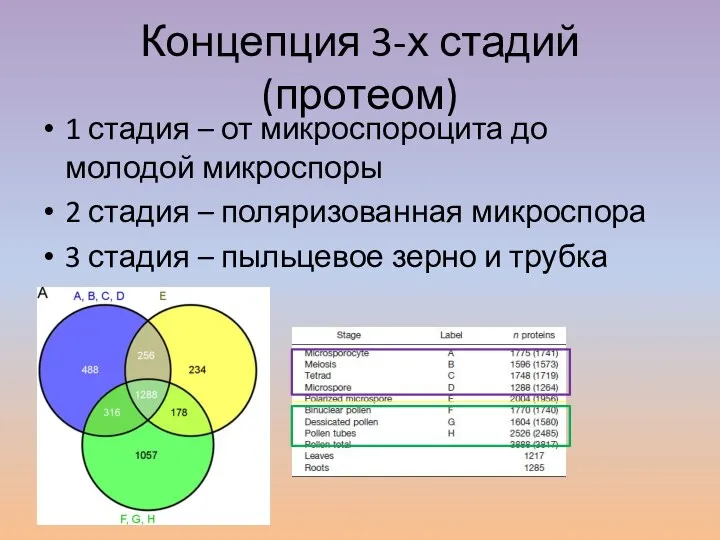
- 5. Концепция 3-х стадий (протеом) 1 стадия – от микроспороцита до молодой микроспоры 2 стадия – поляризованная
- 6. Поляризация и деления микроспоры, формирование оболочки Метаболизм, транскриптом и протеом мужского гаметофита Дегидратация пыльцевых зерен Адгезия
- 7. Изменение оводнённости Степень гидратации мужского гаметофита изменяется в ходе его развития. 1) Формирование пыльцевого зерна, когда
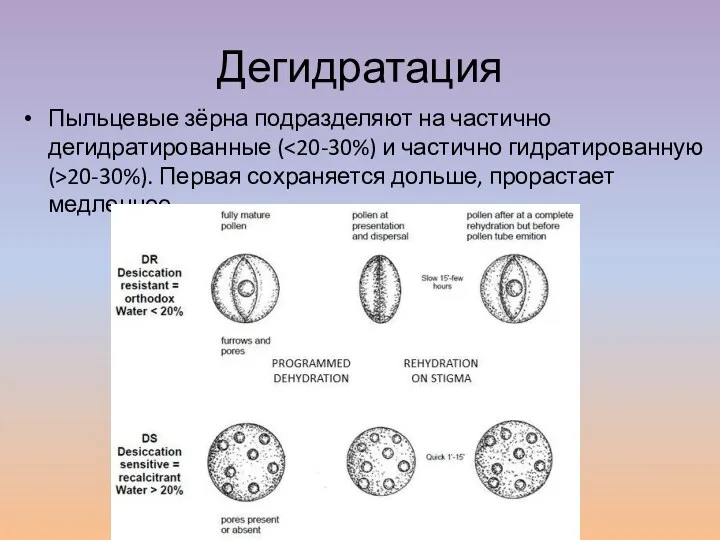
- 8. Дегидратация Пыльцевые зёрна подразделяют на частично дегидратированные ( 20-30%). Первая сохраняется дольше, прорастает медленнее.
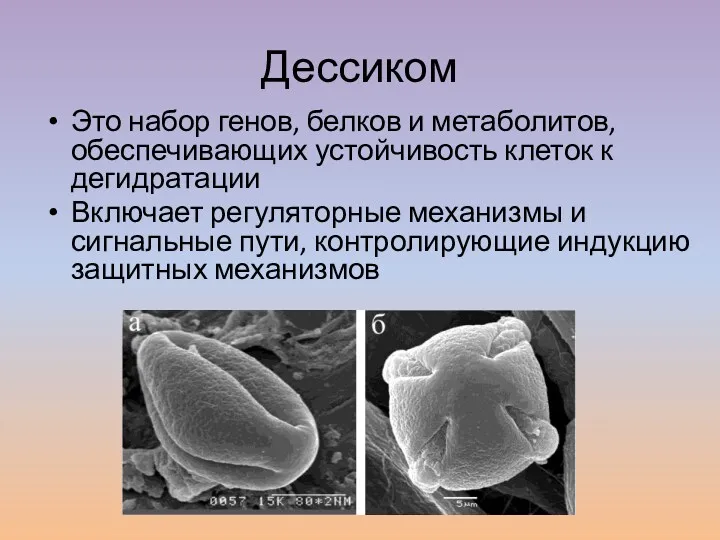
- 9. Дессиком Это набор генов, белков и метаболитов, обеспечивающих устойчивость клеток к дегидратации Включает регуляторные механизмы и
- 10. Гены, входящие в дессиком Стабилизация мембран и белков с помощью невосстанавливающих сахаров, белков теплового шока и
- 11. Поляризация и деления микроспоры, формирование оболочки Метаболизм, транскриптом и протеом мужского гаметофита Дегидратация пыльцевых зерен Адгезия
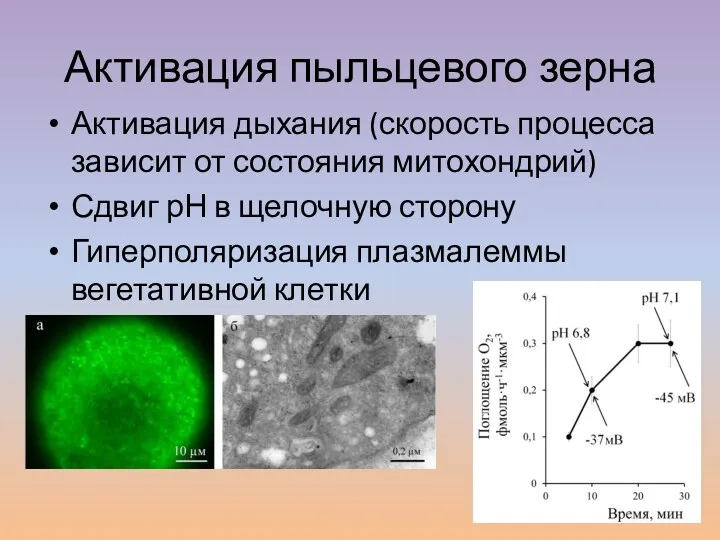
- 12. Активация пыльцевого зерна Активация дыхания (скорость процесса зависит от состояния митохондрий) Сдвиг рН в щелочную сторону
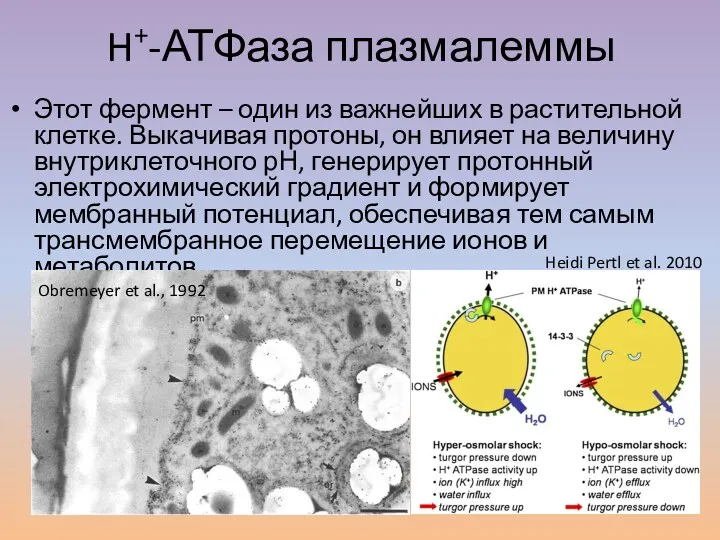
- 13. H+-АТФаза плазмалеммы Этот фермент – один из важнейших в растительной клетке. Выкачивая протоны, он влияет на
- 14. Всему голова – Са2+ Концентрация кальция возрастает в месте выхода пыльцевой трубки Ингибиторы подавляют прорастание. Iwano
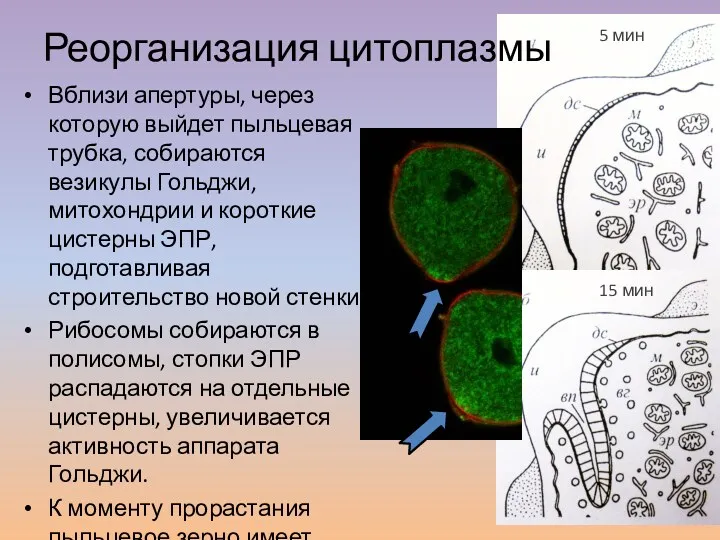
- 15. Вблизи апертуры, через которую выйдет пыльцевая трубка, собираются везикулы Гольджи, митохондрии и короткие цистерны ЭПР, подготавливая
- 16. Поляризация и деления микроспоры, формирование оболочки Метаболизм, транскриптом и протеом мужского гаметофита Дегидратация пыльцевых зерен Адгезия
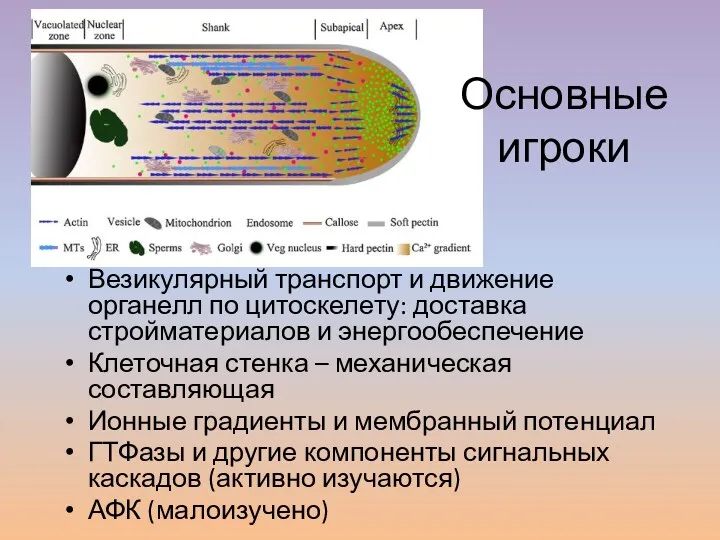
- 17. Везикулярный транспорт и движение органелл по цитоскелету: доставка стройматериалов и энергообеспечение Клеточная стенка – механическая составляющая
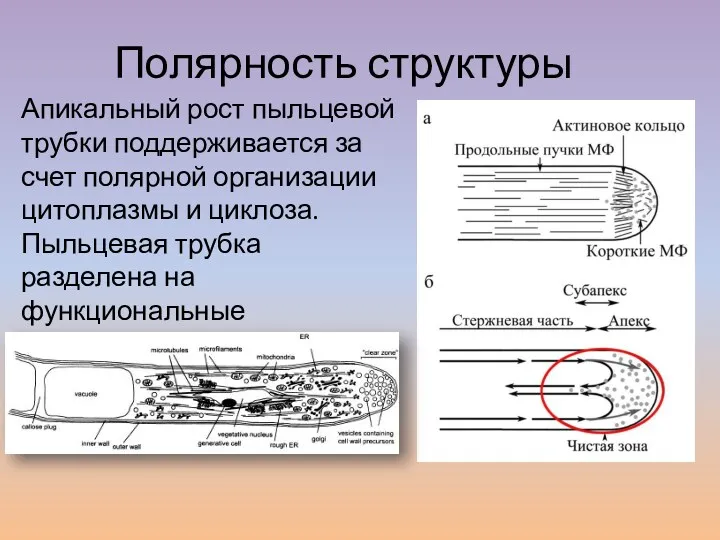
- 18. Апикальный рост пыльцевой трубки поддерживается за счет полярной организации цитоплазмы и циклоза. Пыльцевая трубка разделена на
- 19. Функции циклоза 1. Транспорт мужского гаметного модуля (MGU). 2. Транспорт в апекс сигнальных молекул и ферментов
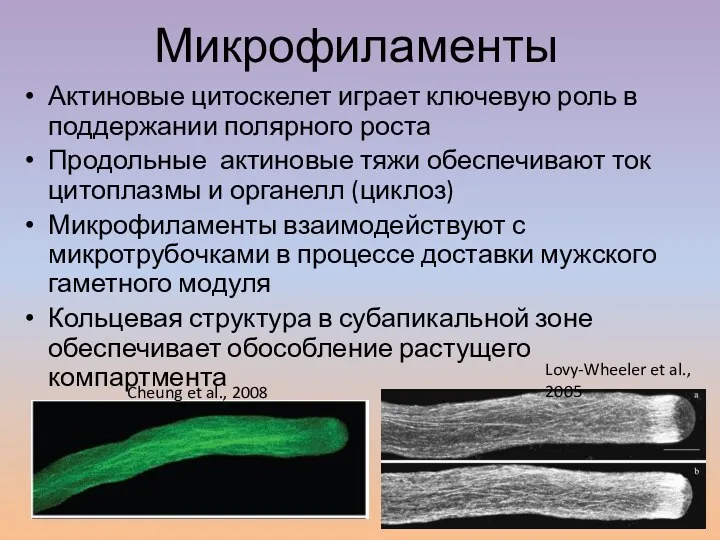
- 20. Актиновые цитоскелет играет ключевую роль в поддержании полярного роста Продольные актиновые тяжи обеспечивают ток цитоплазмы и
- 21. Микротрубочки Играют ключевую роль в доставке мужского гаметного модуля У цветковых не участвуют в циклозе У
- 22. Везикулы аппарата Гольджи, содержащие материал для строительства апикальной мемраны и стенки, путешествуют в апекс по актиновым
- 23. Клеточная стенка: градиент жёсткости Движущей силой для роста является тургорное давление. Однако, оно не является направленной
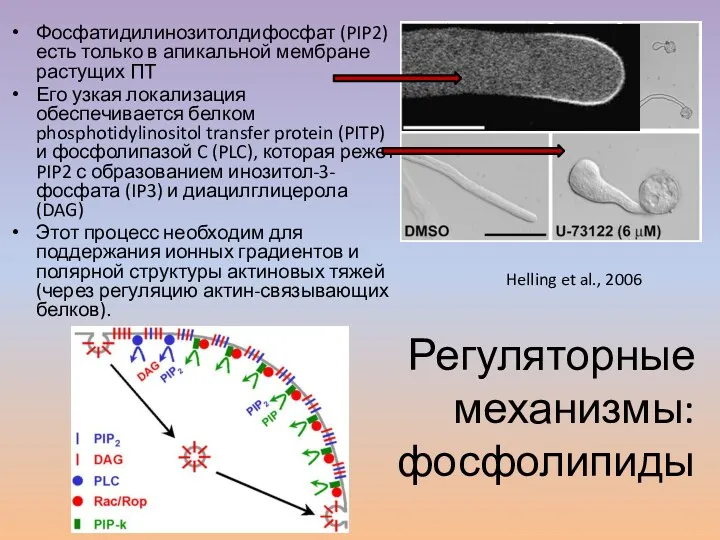
- 24. Фосфатидилинозитолдифосфат (PIP2) есть только в апикальной мембране растущих ПТ Его узкая локализация обеспечивается белком phosphotidylinositol transfer
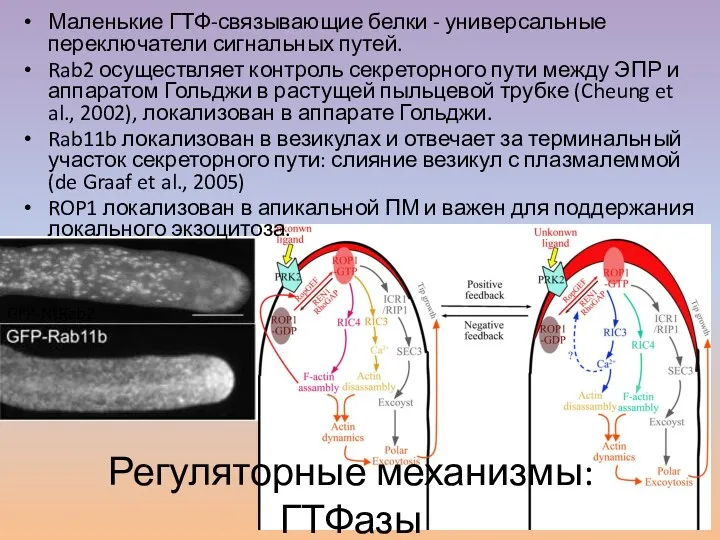
- 25. Регуляторные механизмы: ГТФазы Qin, Yang, 2011 GFP-NtRab2 Маленькие ГТФ-связывающие белки - универсальные переключатели сигнальных путей. Rab2
- 26. Таким образом, пыльцевая трубка – прекрасная модель для изучения ИОННОЙ РЕГУЛЯЦИИ РОСТА, которая включает в себя
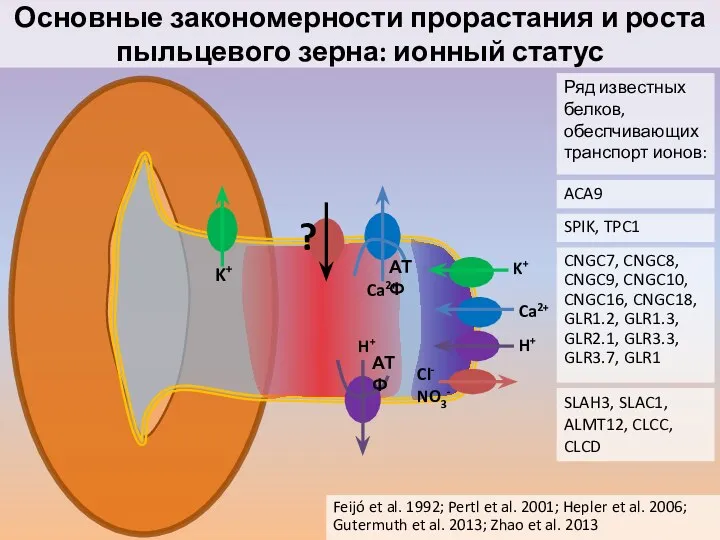
- 27. Основные закономерности прорастания и роста пыльцевого зерна: ионный статус Feijó et al. 1992; Pertl et al.
- 28. Регуляторные механизмы: кальций Hepler, 2012 Кальций входит в кончике трубки через каналы , а в субапикальной
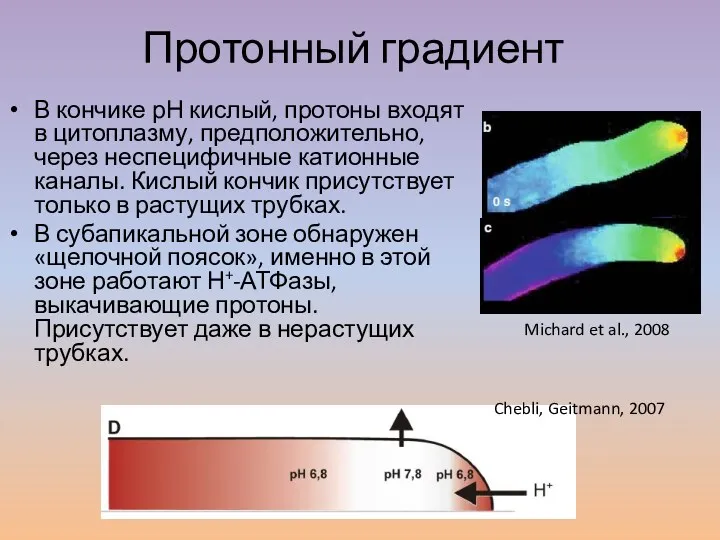
- 29. В кончике рН кислый, протоны входят в цитоплазму, предположительно, через неспецифичные катионные каналы. Кислый кончик присутствует
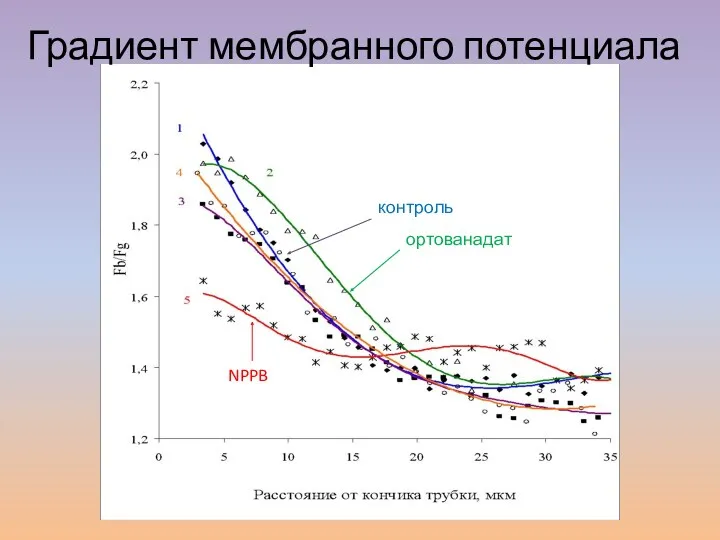
- 30. контроль ортованадат фузикокцин Брейгина и др., 2010 Градиент мембранного потенциала контроль ортованадат NPPB Брейгина и др.,
- 31. АФК ионный транспорт ? АФК в прогамной фазе оплодотворения, по-видимому, могут передавать сигнал и регулировать рост.
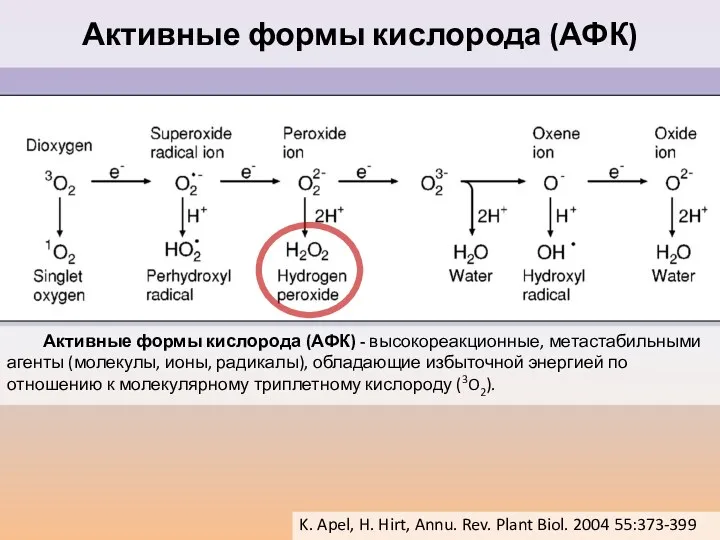
- 32. Активные формы кислорода (АФК) - высокореакционные, метастабильными агенты (молекулы, ионы, радикалы), обладающие избыточной энергией по отношению
- 33. АФК и пероксидазы на рыльце Пероксидазы и АФК накапливаются при подготовке к опылению.
- 34. H2O2 – один из регуляторов прогамной фазы оплодотворения H2O2 в низких концентрациях (100 µM) стимулирует прорастание
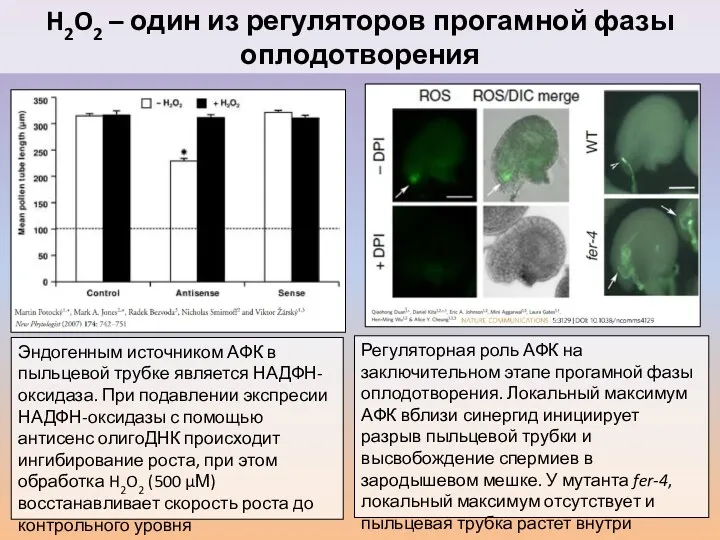
- 35. H2O2 – один из регуляторов прогамной фазы оплодотворения Эндогенным источником АФК в пыльцевой трубке является НАДФН-оксидаза.
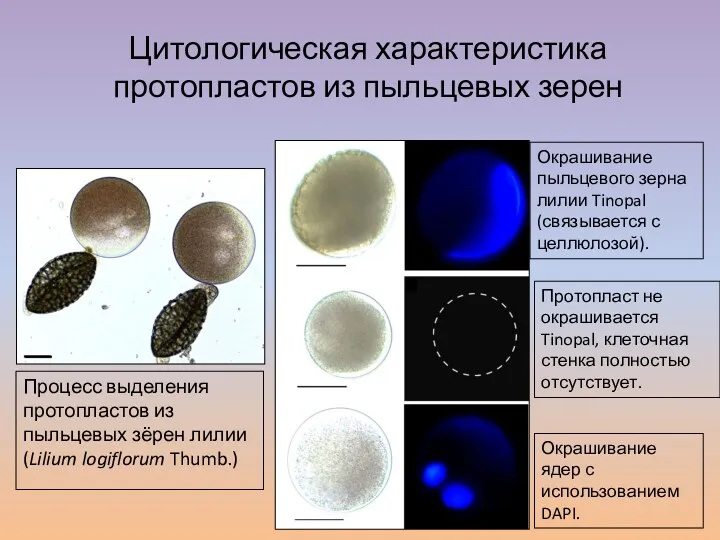
- 36. Цитологическая характеристика протопластов из пыльцевых зерен Процесс выделения протопластов из пыльцевых зёрен лилии (Lilium logiflorum Thumb.)
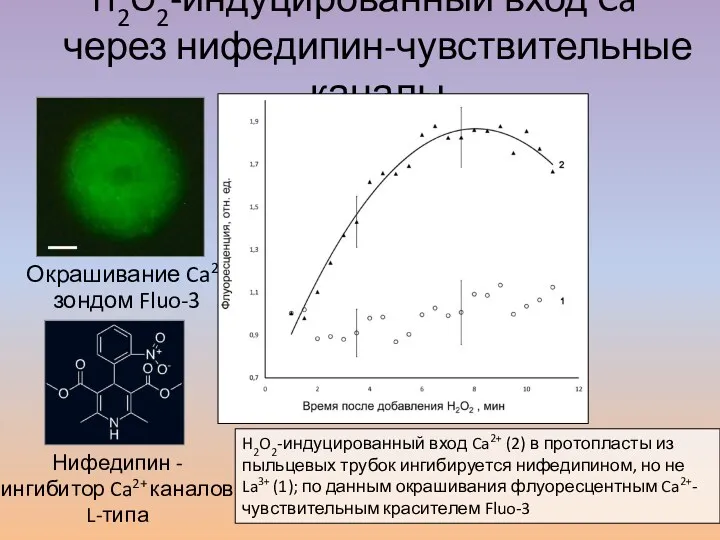
- 37. Окрашивание Ca2+ зондом Fluo-3 Нифедипин - ингибитор Ca2+ каналов L-типа H2O2-индуцированный вход Ca2+ через нифедипин-чувствительные каналы
- 38. H2O2 активирует Ca2+ ток в протопластах из пыльцевых зёрен Оригинальная репрезентативная запись входящего Ca2+ тока, индуцированного
- 39. H2O2-индуцированный вход Ca2+ (2) в протопласты из пыльцевых трубок ингибируется нифедипином, но не La3+ (1); по
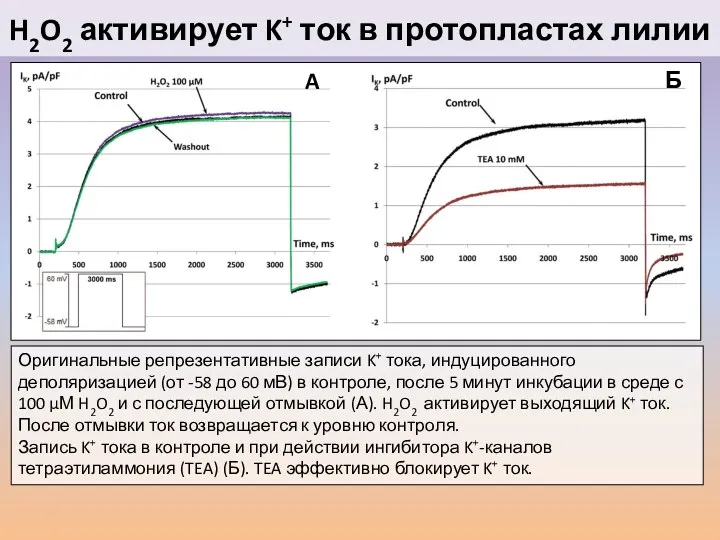
- 40. H2O2 активирует K+ ток в протопластах лилии Оригинальные репрезентативные записи K+ тока, индуцированного деполяризацией (от -58
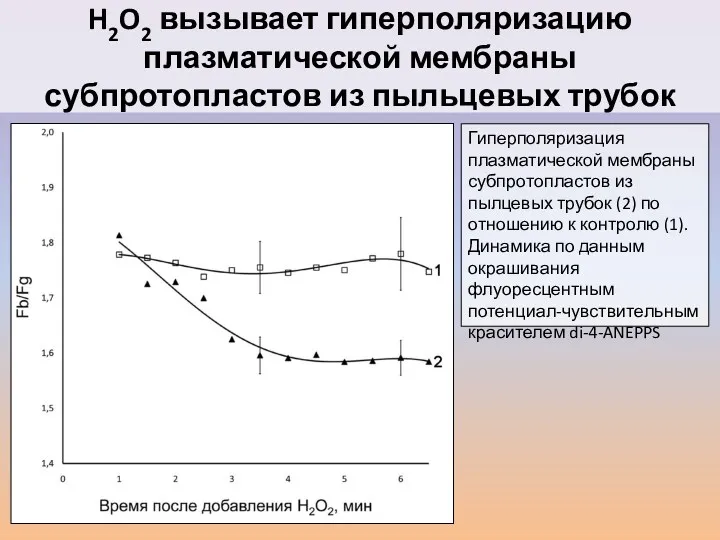
- 41. Гиперполяризация плазматической мембраны субпротопластов из пылцевых трубок (2) по отношению к контролю (1). Динамика по данным
- 43. Скачать презентацию

















 Химическая эволюция и биогенез
Химическая эволюция и биогенез Жизнь организмов на разных материках
Жизнь организмов на разных материках презентация Углеводы. Липиды
презентация Углеводы. Липиды Концепция коэволюции Н.Н. Моисеева
Концепция коэволюции Н.Н. Моисеева Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Эволюция кровеносной системы животных
Эволюция кровеносной системы животных Лекарственные растения Ленинградской области
Лекарственные растения Ленинградской области 3D Bioprinting Solutions Company Overview
3D Bioprinting Solutions Company Overview Многообразие растений семейства сложноцветных
Многообразие растений семейства сложноцветных Биоэнергетика Часть третья. Брожение как способ рециркуляции НАДН
Биоэнергетика Часть третья. Брожение как способ рециркуляции НАДН Биологическое действие ионизирующего излучения
Биологическое действие ионизирующего излучения Животный организм и его особенности
Животный организм и его особенности Строение ядра, его роль для клетки и организма. Кариотип организма
Строение ядра, его роль для клетки и организма. Кариотип организма Биохимия крови
Биохимия крови Беспозвоночные животные
Беспозвоночные животные Эмоции животных в рисунках и фотографиях
Эмоции животных в рисунках и фотографиях Наши верные друзья - собаки
Наши верные друзья - собаки Организация работы со способными и одарёнными детьми на уроках биологии и во внеурочной деятельности.
Организация работы со способными и одарёнными детьми на уроках биологии и во внеурочной деятельности. Endangered animals and plants
Endangered animals and plants Хронические вирусные инфекции кошек
Хронические вирусные инфекции кошек Обонятельный и вкусовой анализаторы
Обонятельный и вкусовой анализаторы Черноморский дельфин афалина
Черноморский дельфин афалина Скелет туловища
Скелет туловища Дендрологічні парки
Дендрологічні парки Хвоегрызущие и листогрызущие вредители. (Лекция 7)
Хвоегрызущие и листогрызущие вредители. (Лекция 7) Движение
Движение урок 3 Скелет, кости, суставы
урок 3 Скелет, кости, суставы Уровни организации жизни на земле
Уровни организации жизни на земле