Содержание
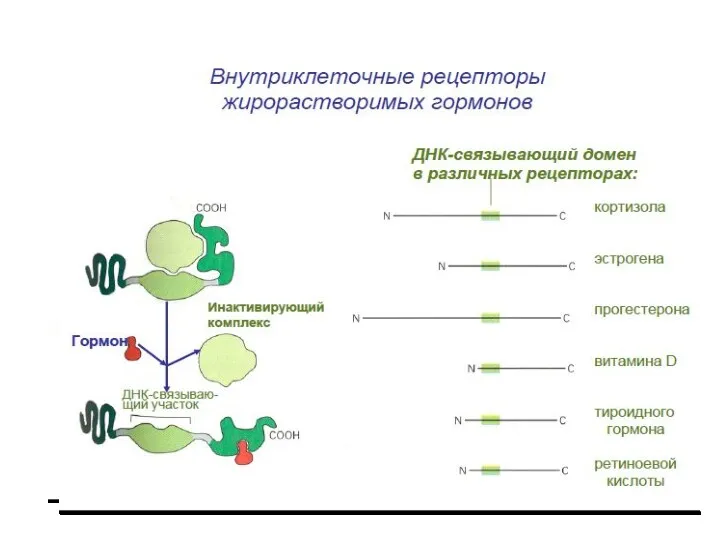
- 2. Передача сигнала липофильными гормонами
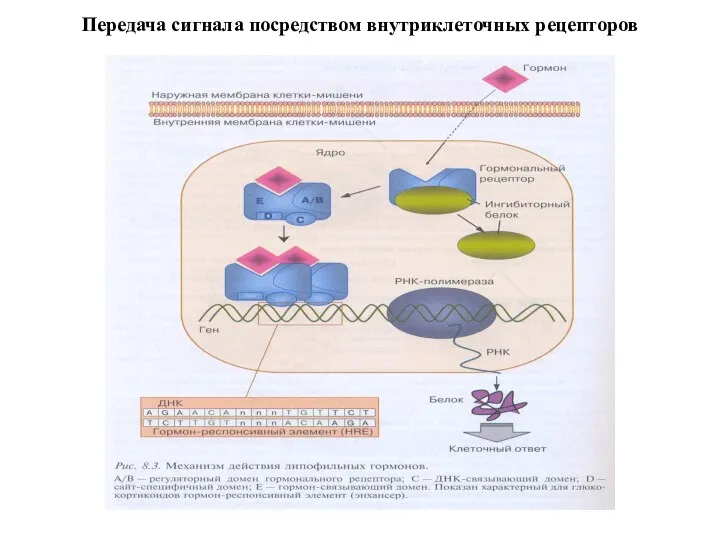
- 4. Передача сигнала посредством внутриклеточных рецепторов
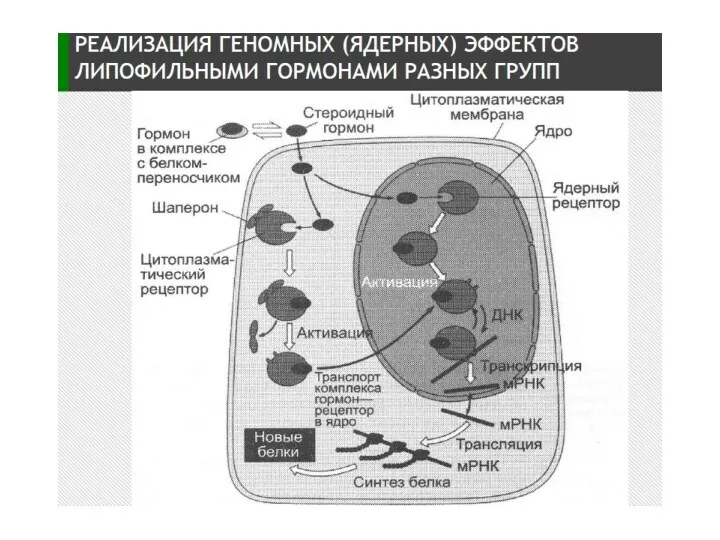
- 5. Механизм действия стероидных гормонов (СГ) 1.СГ→СГ+белок-переносчик→по кровотоку к клетке-мишени → диссоциация комплекса → диффузия СГ внутрь
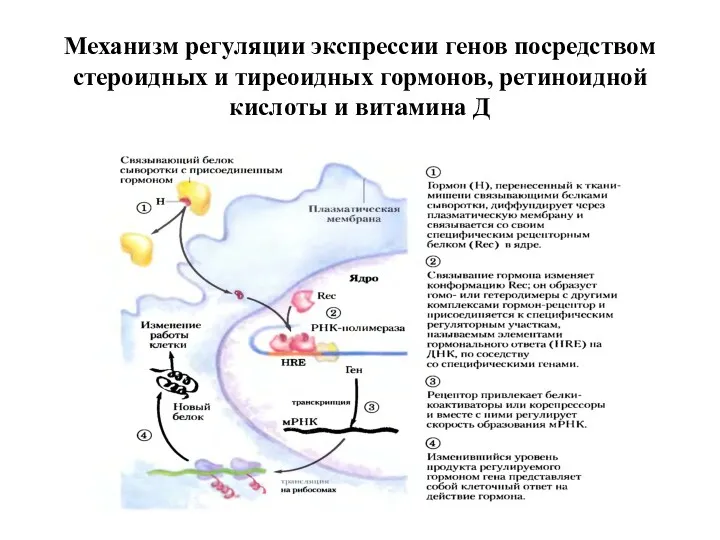
- 7. Механизм регуляции экспрессии генов посредством стероидных и тиреоидных гормонов, ретиноидной кислоты и витамина Д
- 9. Вторичные посредники Пути образования и проведение сигнала (цАМФ, цГМФ, NO, липидные мессенджеры)
- 10. Вторичные посредники – это низкомолекулярные вещества, небелковой природы, образуются и действуют внутри клеток, и обеспечивают передачу
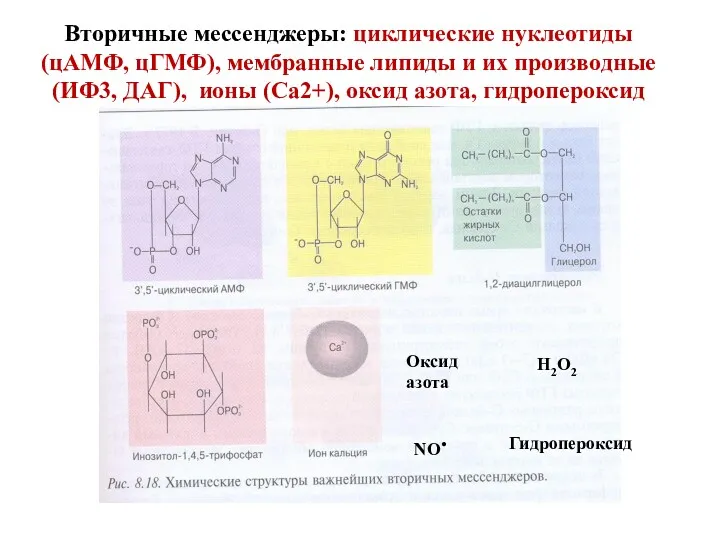
- 11. Вторичные мессенджеры: циклические нуклеотиды (цАМФ, цГМФ), мембранные липиды и их производные (ИФ3, ДАГ), ионы (Са2+), оксид
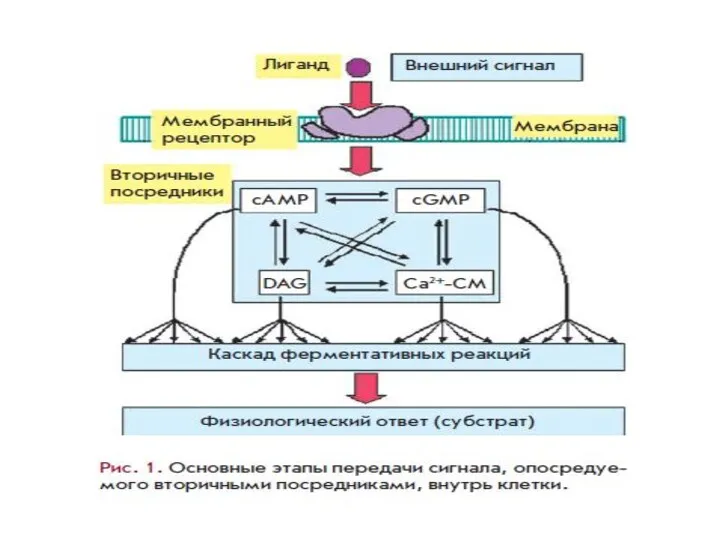
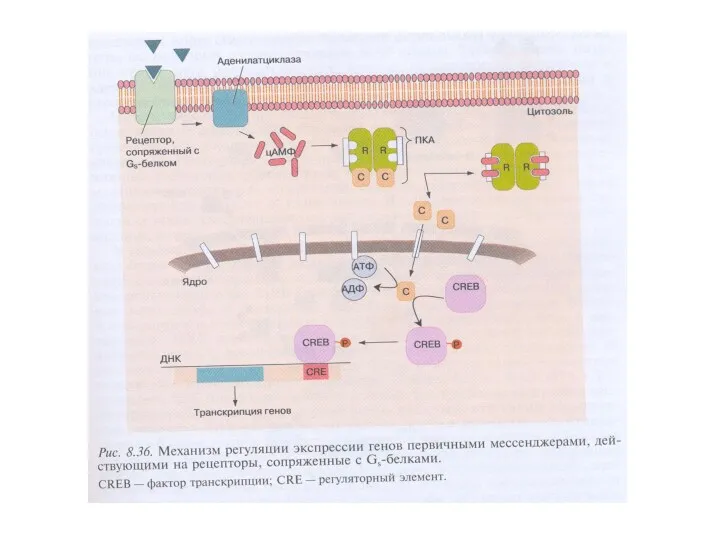
- 13. Ключевые этапы передачи сигнала посредством ВП являются общими для регуляторных систем: агонист→рецептор→эффекторный белок→вторичный посредник→модулируемый белок→физиологический эффект
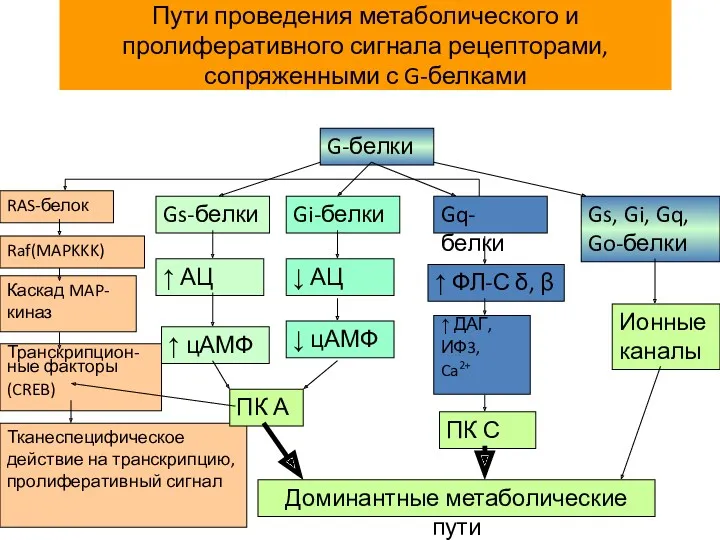
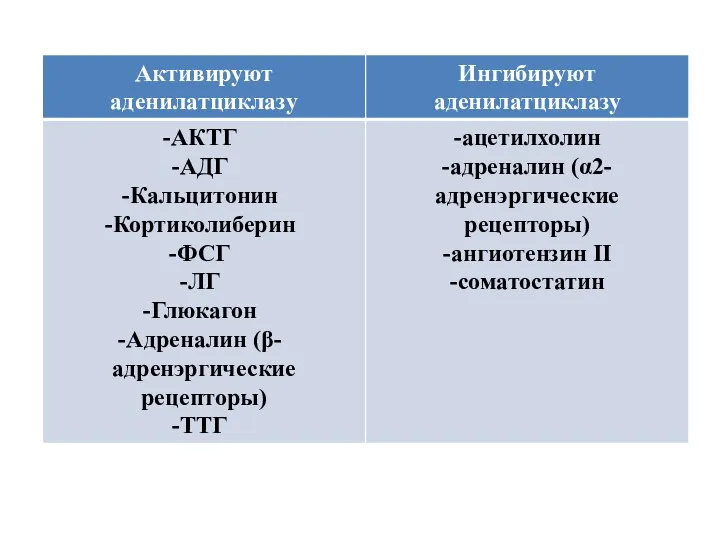
- 14. Пути проведения метаболического и пролиферативного сигнала рецепторами, сопряженными с G-белками G-белки Gs-белки Gi-белки Gq-белки Gs, Gi,
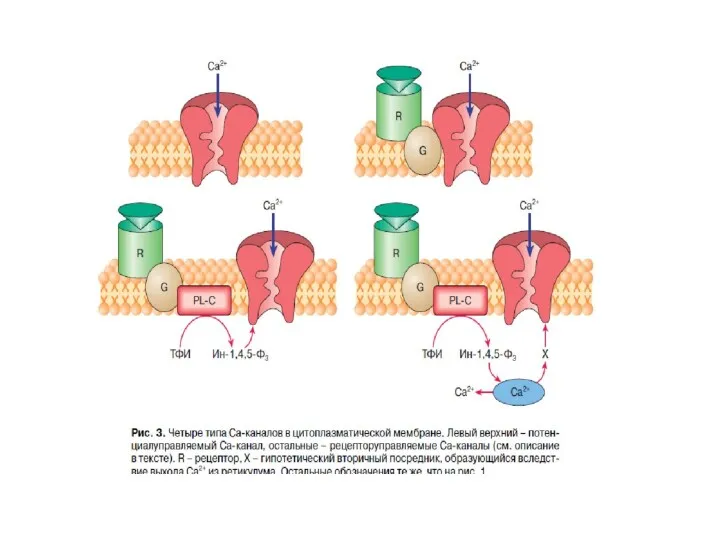
- 15. Существует 2 пути, с помощью которых GPCRs запускают образование вторичных посредников: сАМР – путь: активация GPCRs
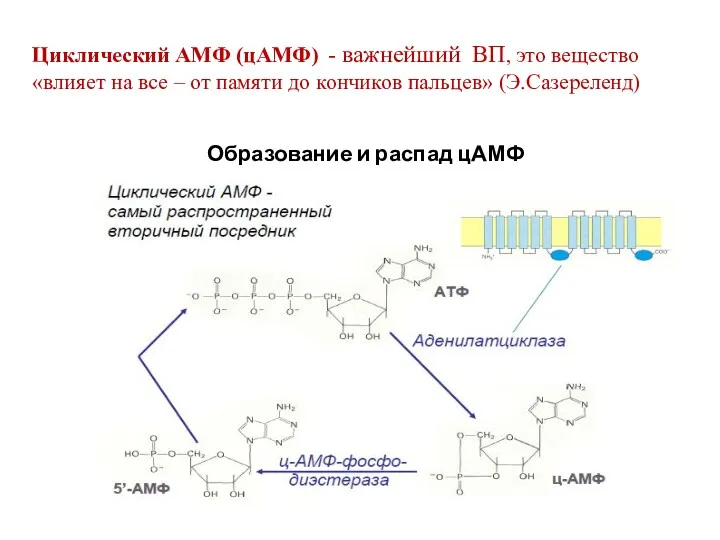
- 16. Циклический АМФ (цАМФ) - важнейший ВП, это вещество «влияет на все – от памяти до кончиков
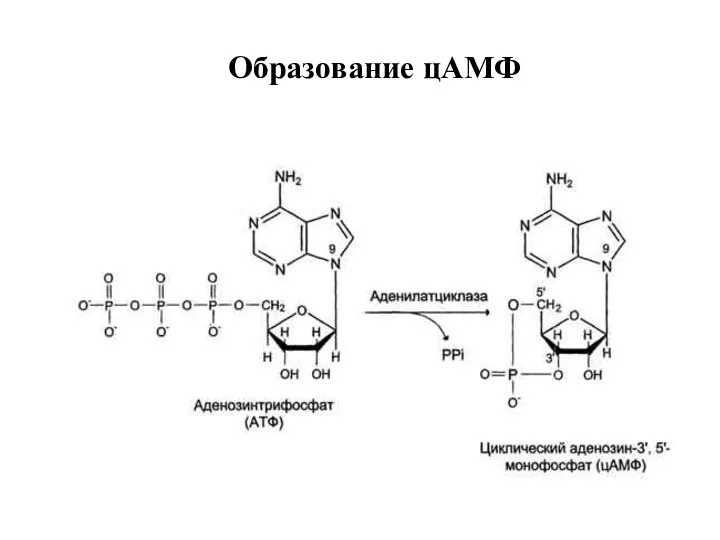
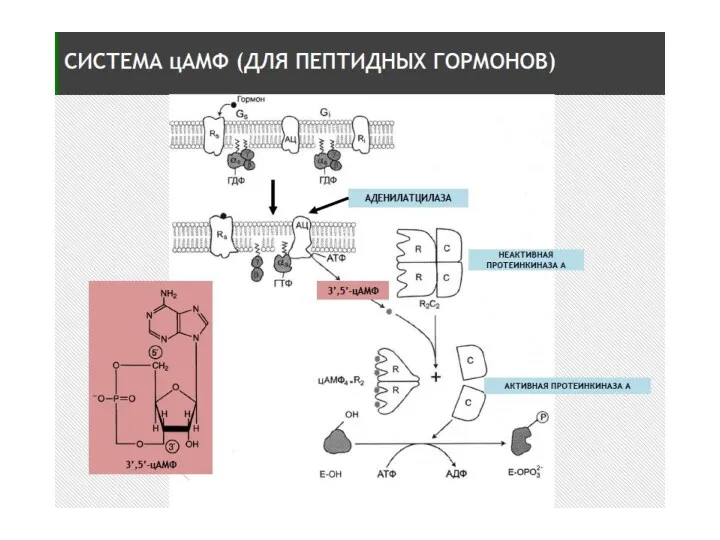
- 17. Образование цАМФ
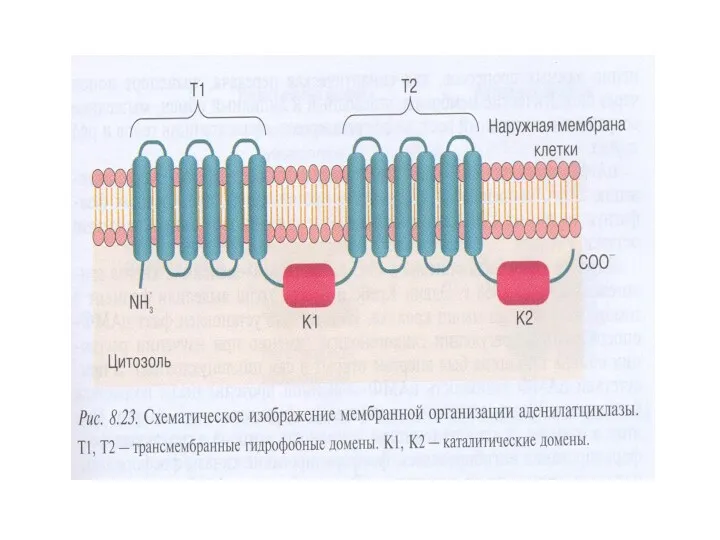
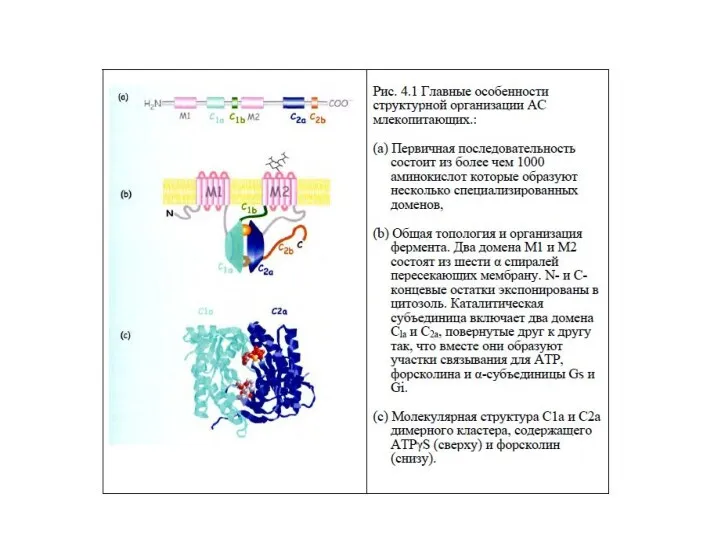
- 18. Характеристика аденилатциклазы (АЦ) Интегральный белок плазматической мембраны Гликопротеин, М – 110-180 кДа Полипептидная цепь содержит 12
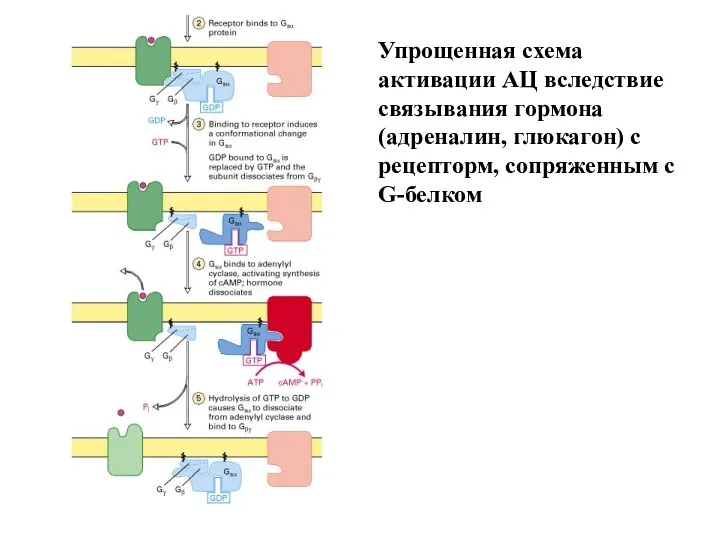
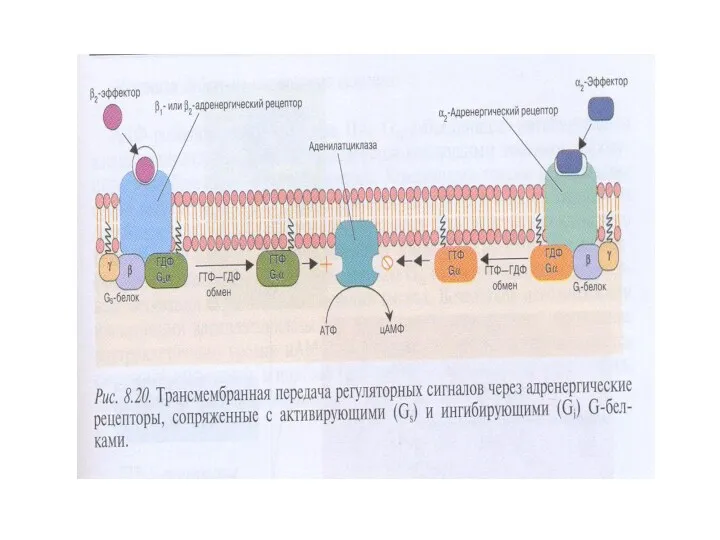
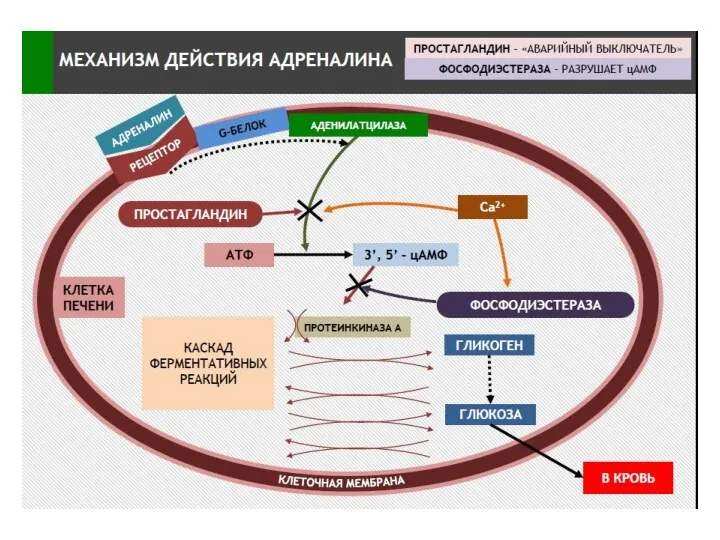
- 21. Упрощенная схема активации АЦ вследствие связывания гормона (адреналин, глюкагон) с рецепторм, сопряженным с G-белком
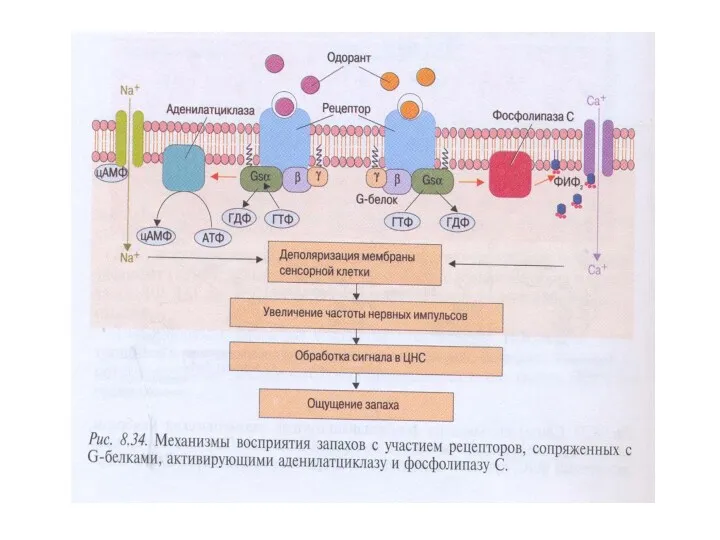
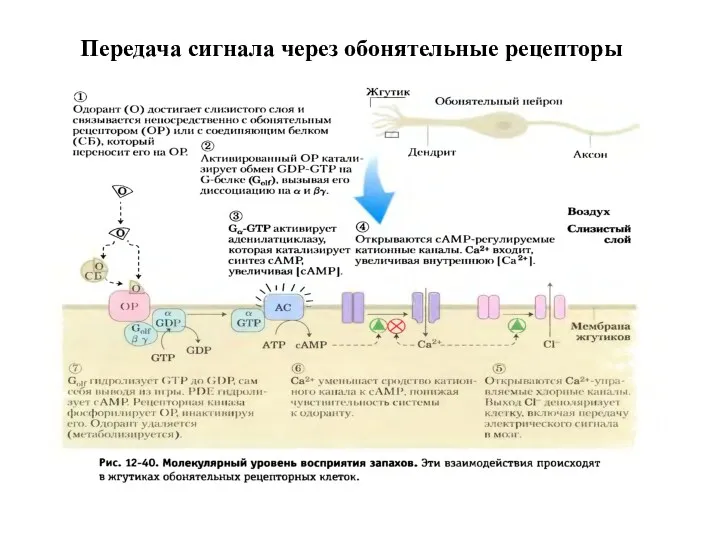
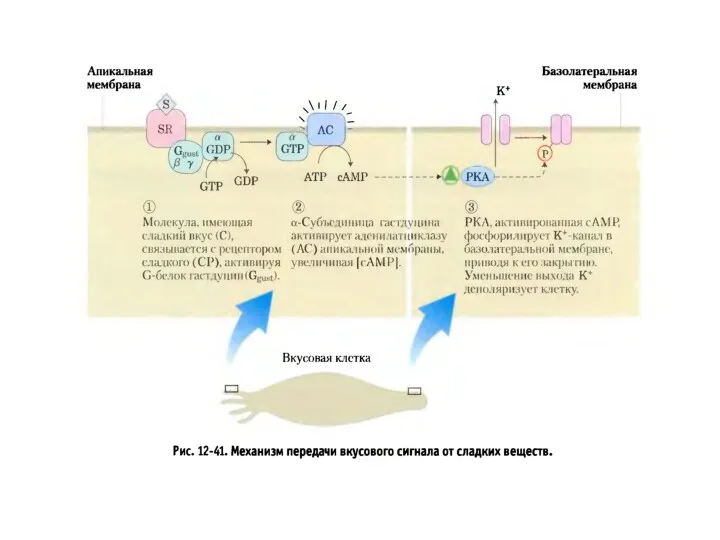
- 25. Передача сигнала через обонятельные рецепторы
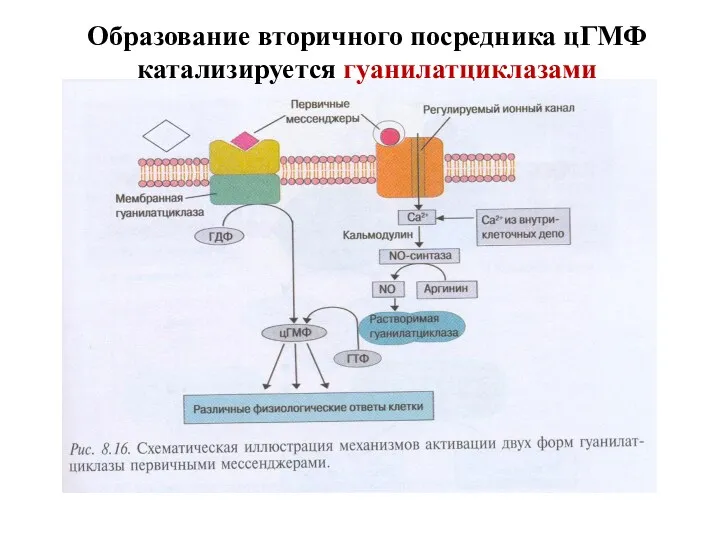
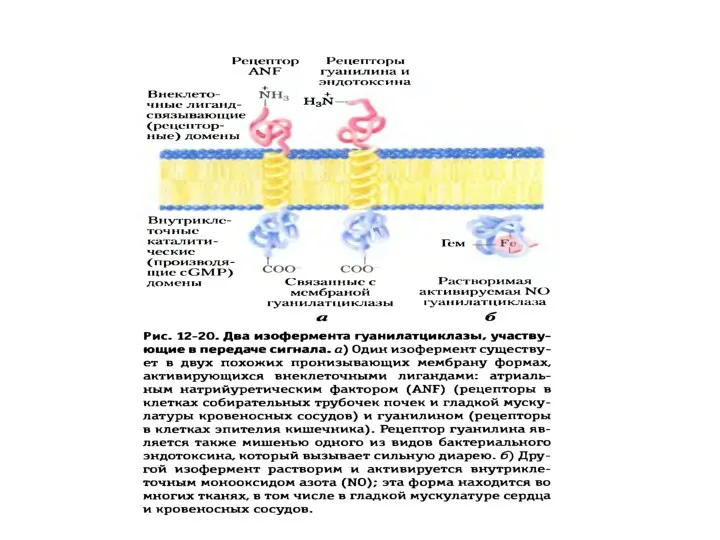
- 28. Образование вторичного посредника цГМФ катализируется гуанилатциклазами
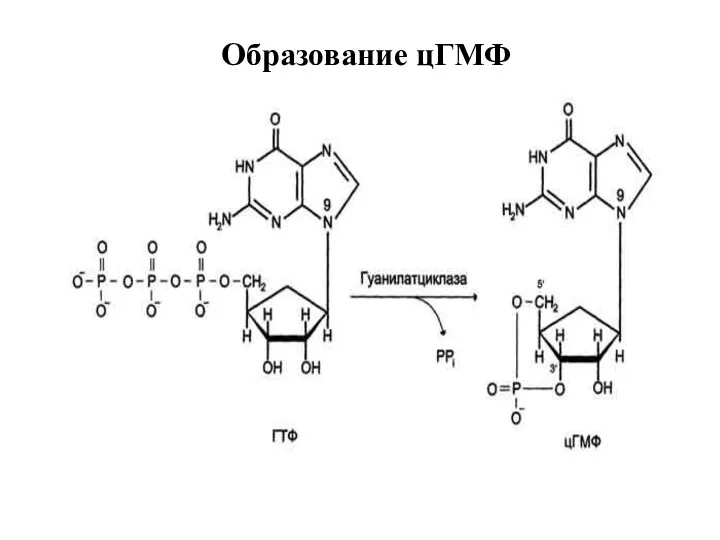
- 29. Образование цГМФ
- 30. Гуанилатциклазы (ГЦ) 1. ГЦ катализирует образование вторичного посредника цГМФ из ГТФ. 2. В клетке имеется 2
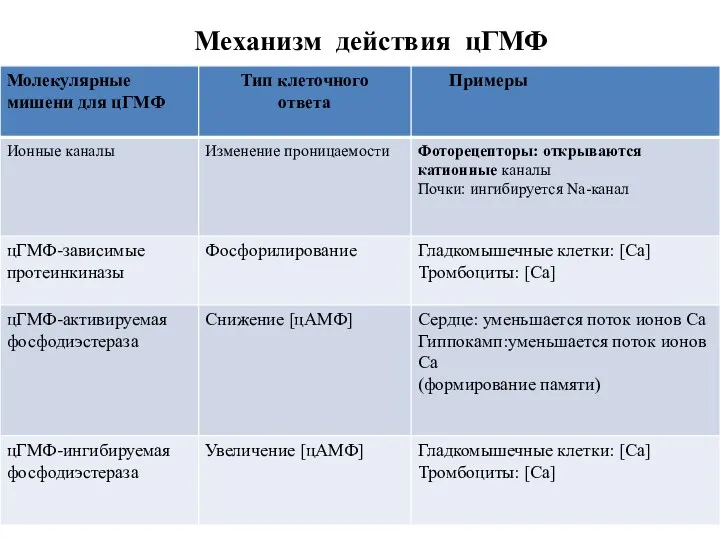
- 31. Механизм действия цГМФ
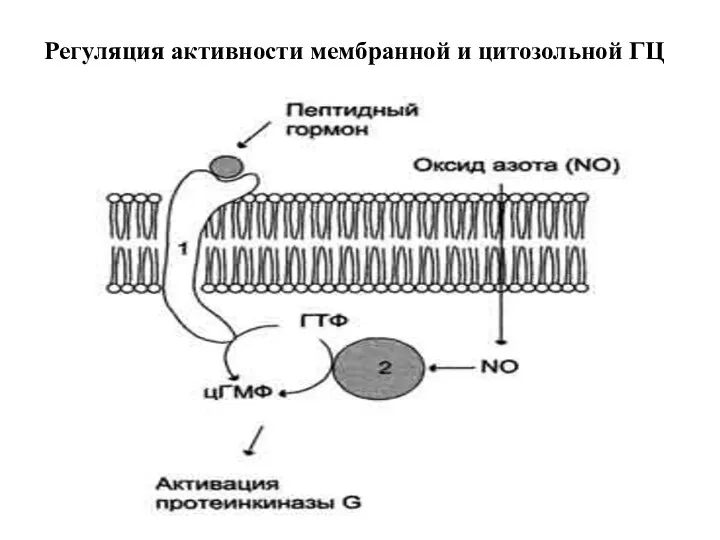
- 32. Регуляция активности мембранной и цитозольной ГЦ
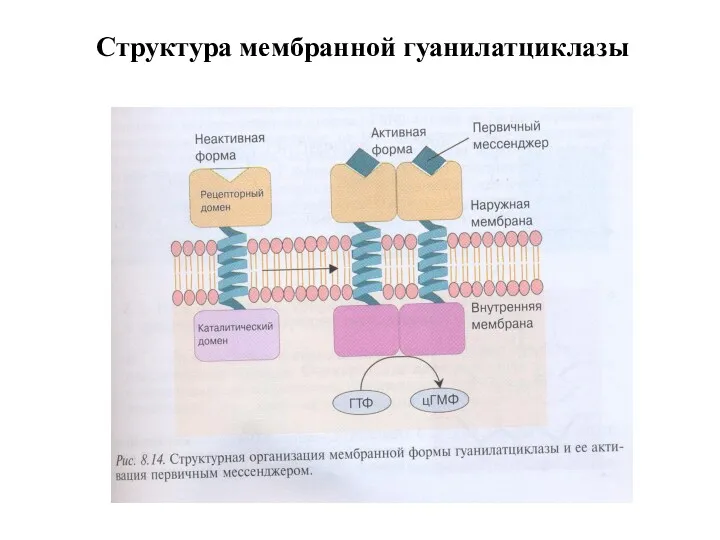
- 34. Структура мембранной гуанилатциклазы
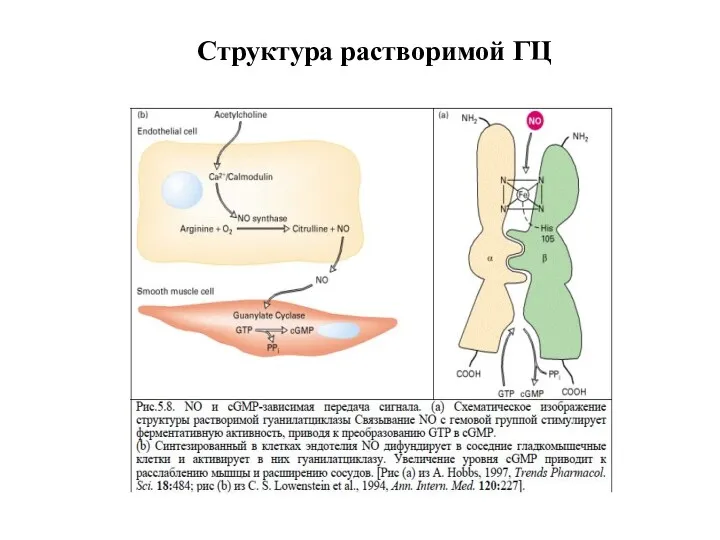
- 35. Структура растворимой ГЦ
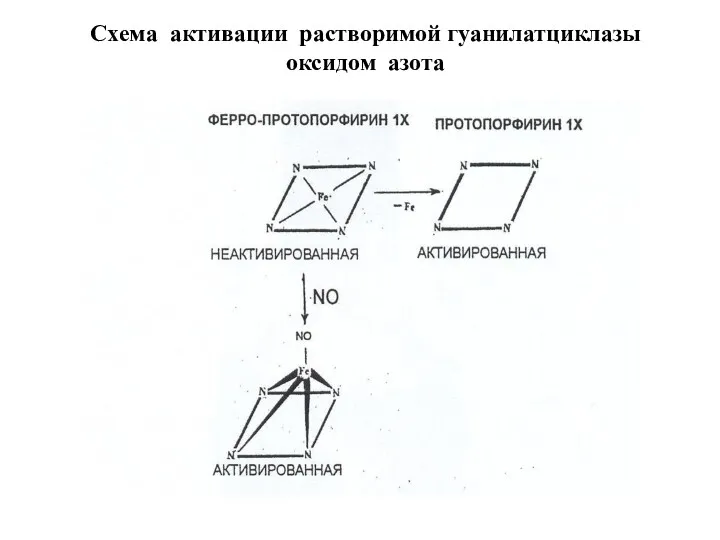
- 36. Схема активации растворимой гуанилатциклазы оксидом азота
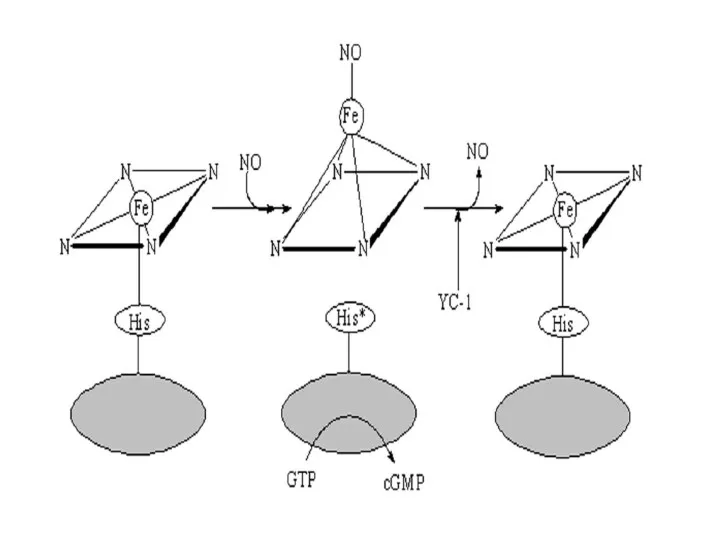
- 38. 1. В неактивированном состоянии гем гуанилатциклазы связан координационно с четырьмя атомами азота центрального кольца гема, а
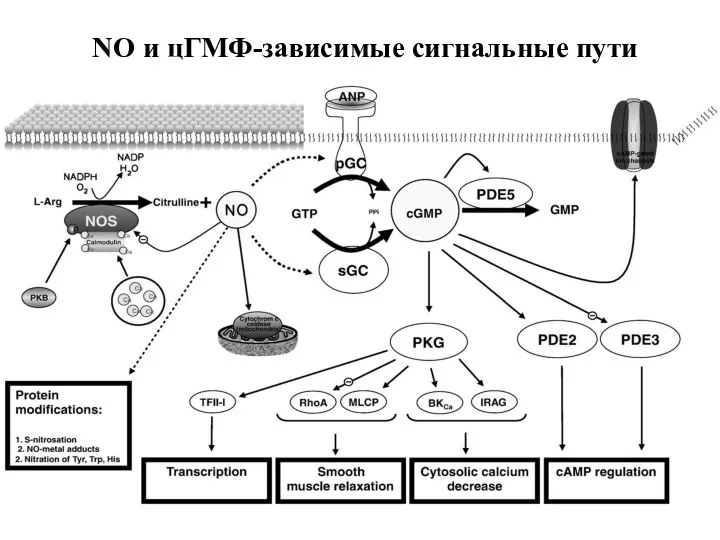
- 39. NO и цГМФ-зависимые сигнальные пути
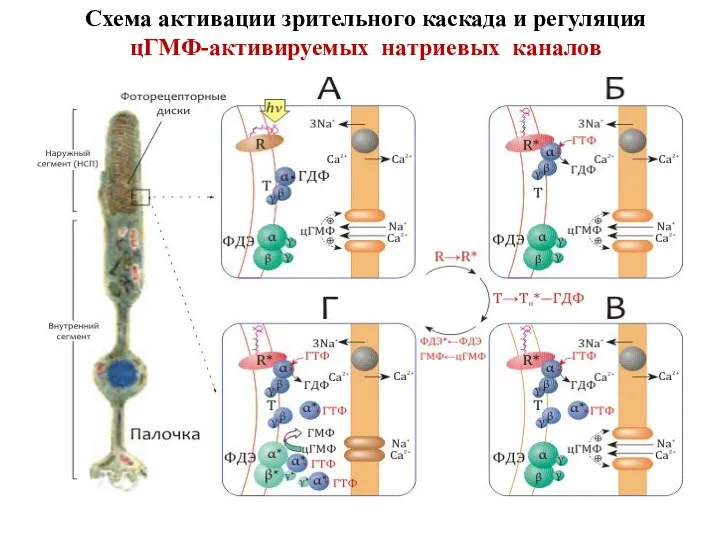
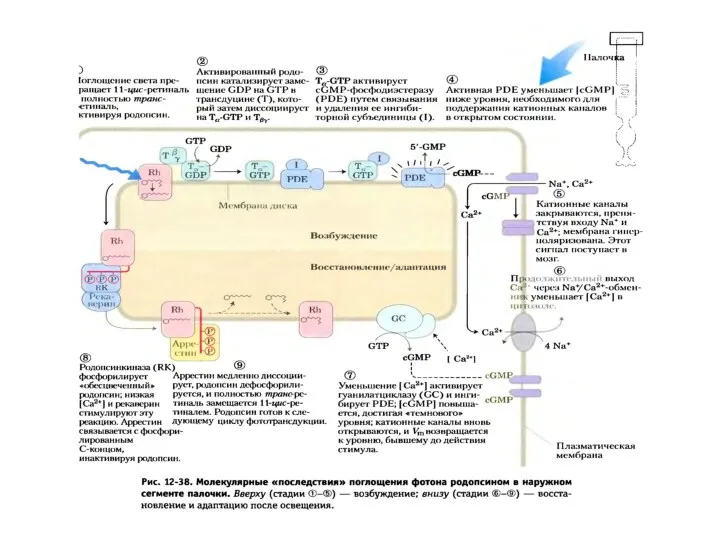
- 40. Схема активации зрительного каскада и регуляция цГМФ-активируемых натриевых каналов
- 41. цГМФ и гуанилатциклазы (Нельсон, Кокс, 2011)
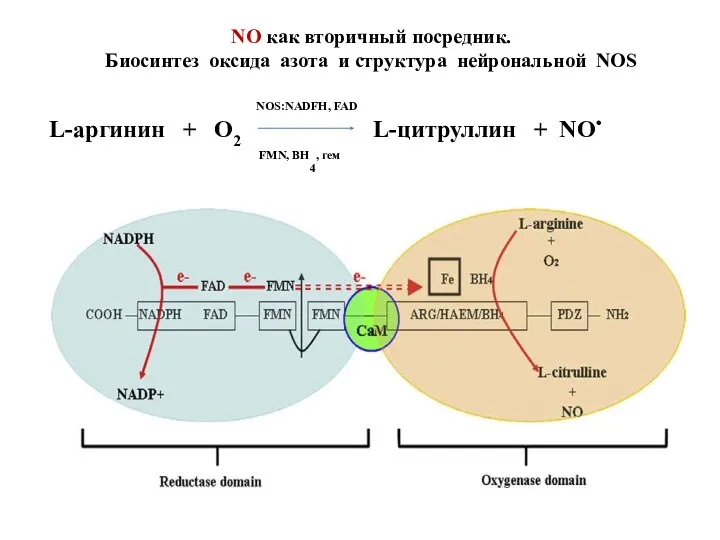
- 42. NO как вторичный посредник. Биосинтез оксида азота и структура нейрональной NOS FMN, ВH4, гем NOS:NADFH, FAD
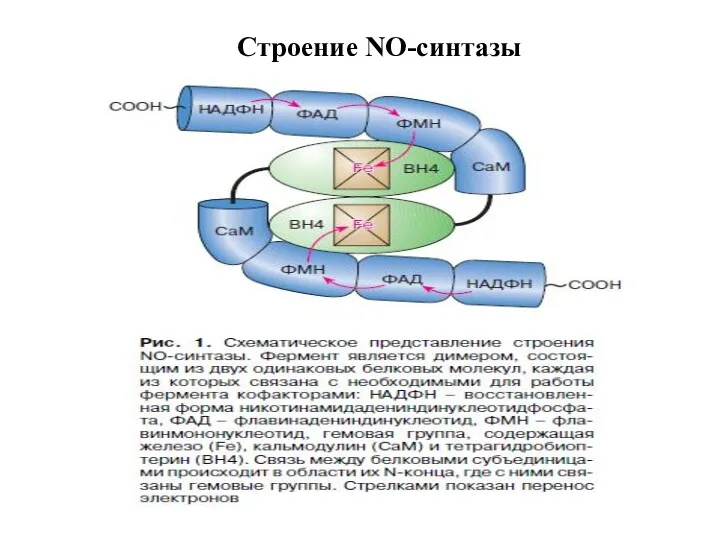
- 43. Строение NO-синтазы
- 44. Активность NOS регулируется : Фосфорилированием - ПКА - ПКС - Са/кальмодулин-зависимой киназой Дефосфорилированием - фосфатазой 1
- 45. NO запускает различные downstream пути и регулирует: вазодилятацию нейротрансмиссию макрофагальную цитотоксичность релаксацию гладкомышечных клеток ЖКТ бронходилятацию
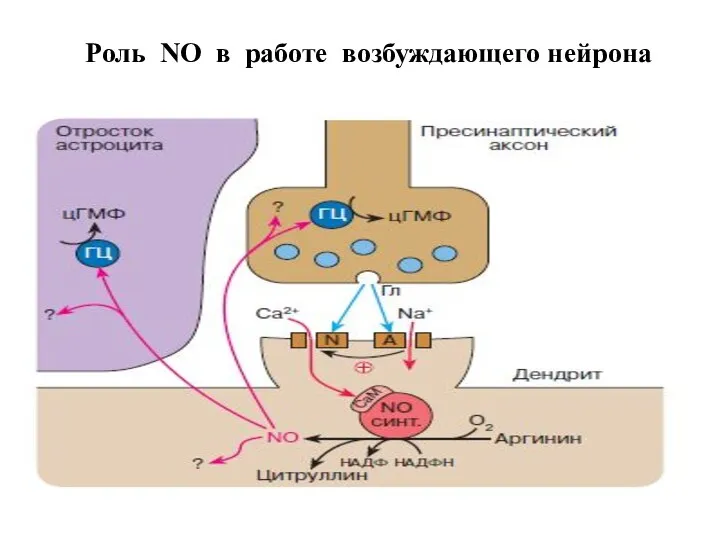
- 46. Роль NO в работе возбуждающего нейрона
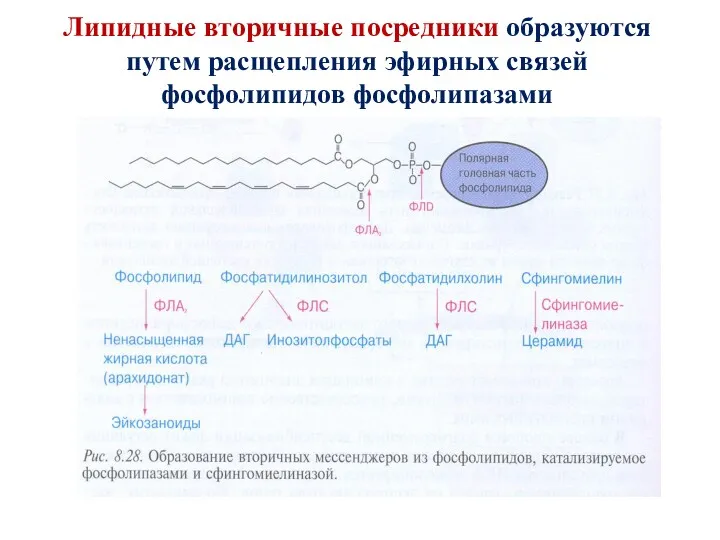
- 47. Липидные вторичные посредники образуются путем расщепления эфирных связей фосфолипидов фосфолипазами
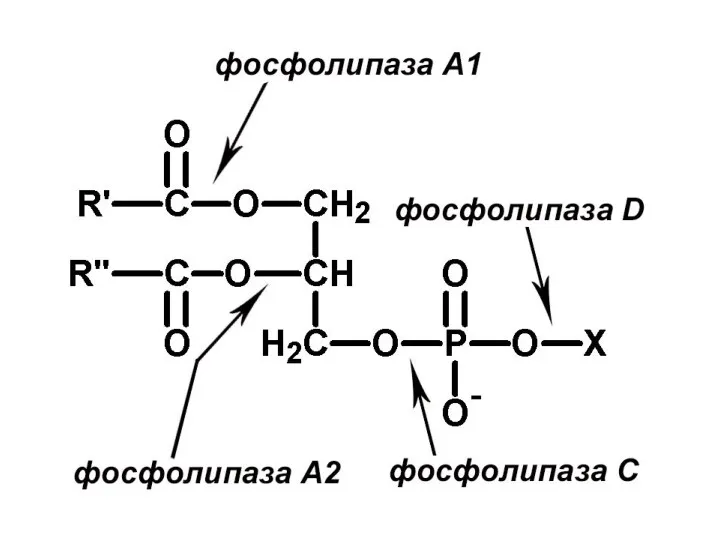
- 48. Характеристика фосфолипаз (ФЛ) ФЛ - гидролазы, катализирующие катаболизм глицеро-фосфолипидов. Различают: 1) секреторные ФЛ (панкреа-тический сок); 2)
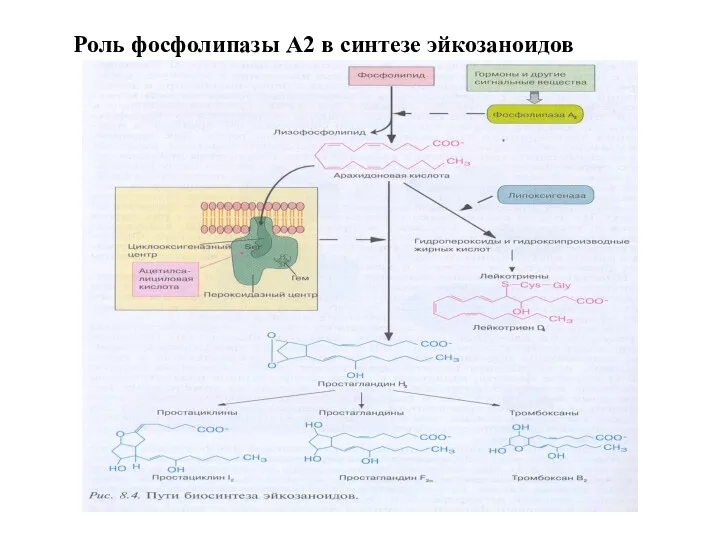
- 51. Роль фосфолипазы А2 в синтезе эйкозаноидов
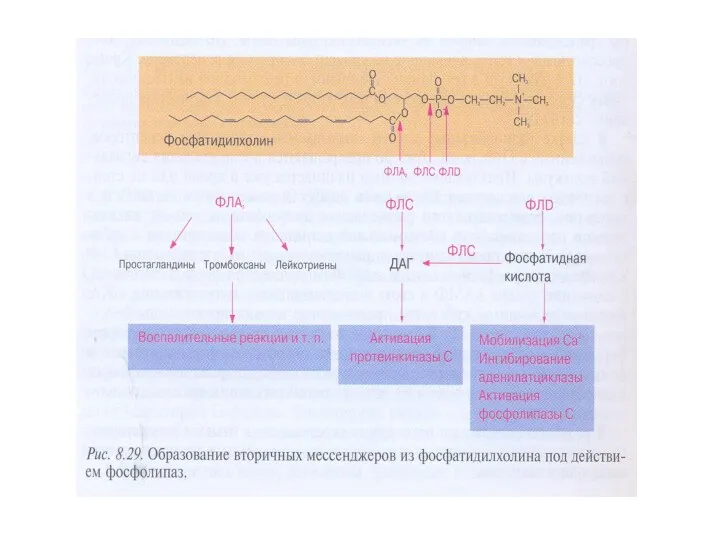
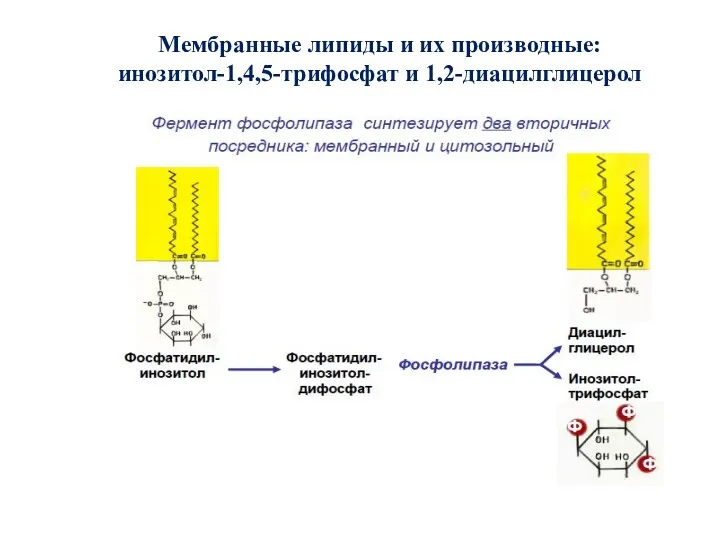
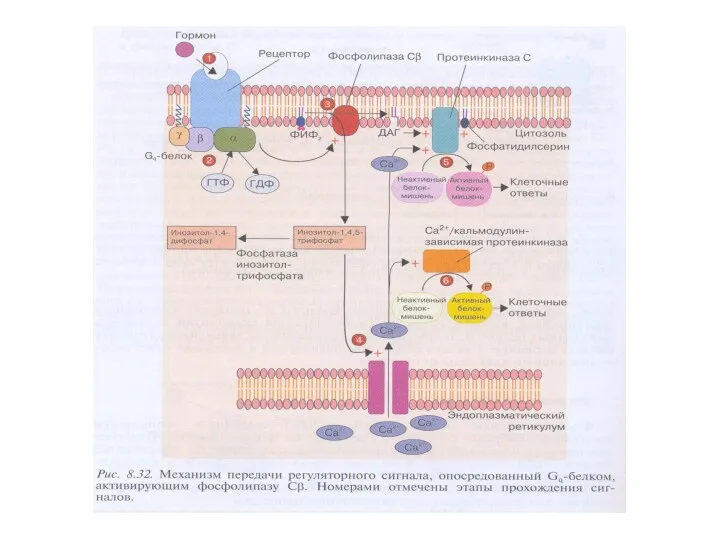
- 52. Мембранные липиды и их производные: инозитол-1,4,5-трифосфат и 1,2-диацилглицерол
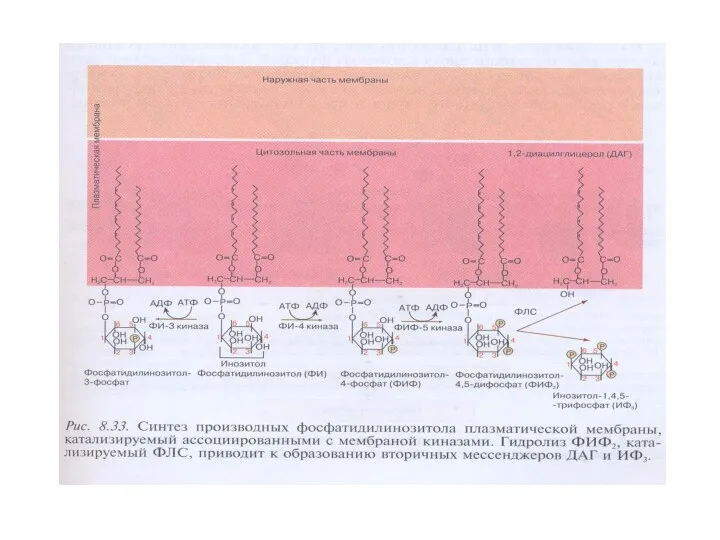
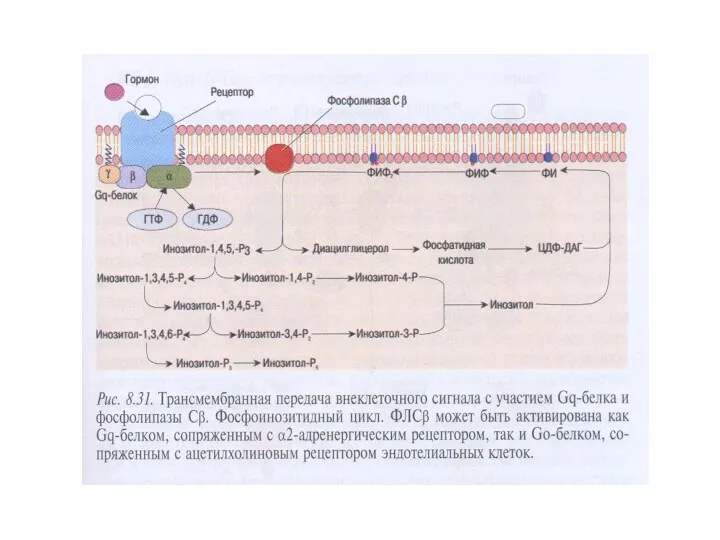
- 54. Синтез производных фосфатидилинозитола в плазматической мембране, гидролиз ФИФ2 фосфолипазой С ФИ-4-киназа → ФИ → ФИ-4-фосфат (ФИФ)
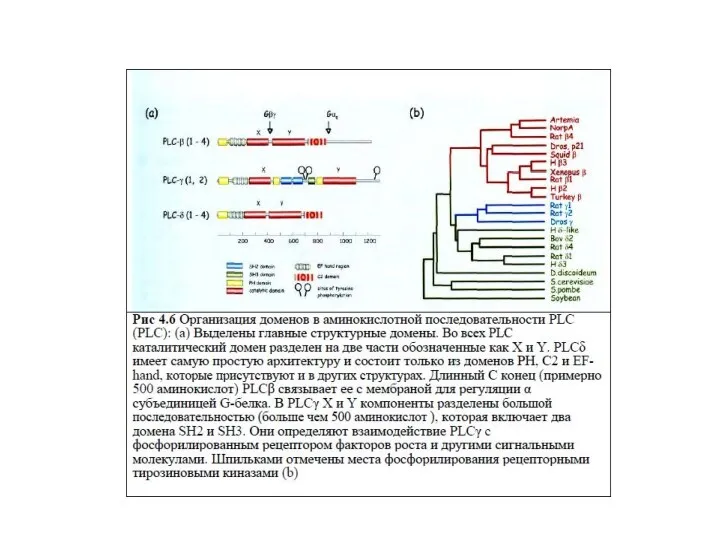
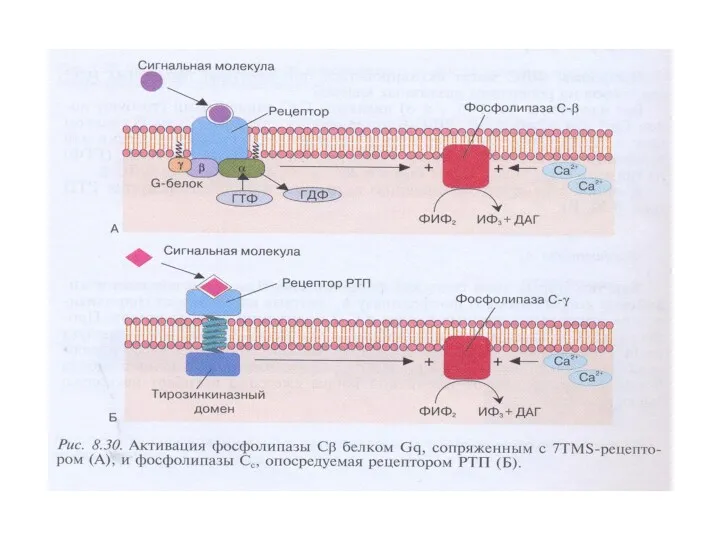
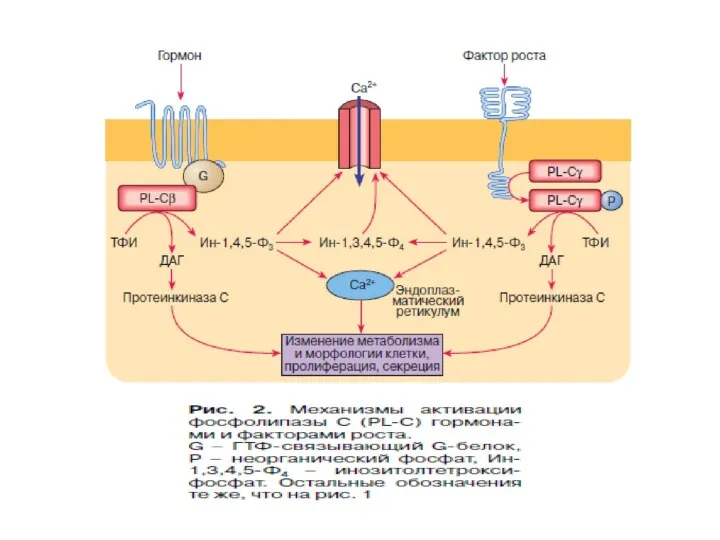
- 55. Характеристика фосфолипазы С 1.Известно 3 класса ФЛС: ФЛСβ, ФЛСγ, ФЛСδ, которые включают 16 изоформ. 2.ФЛСβ активируется
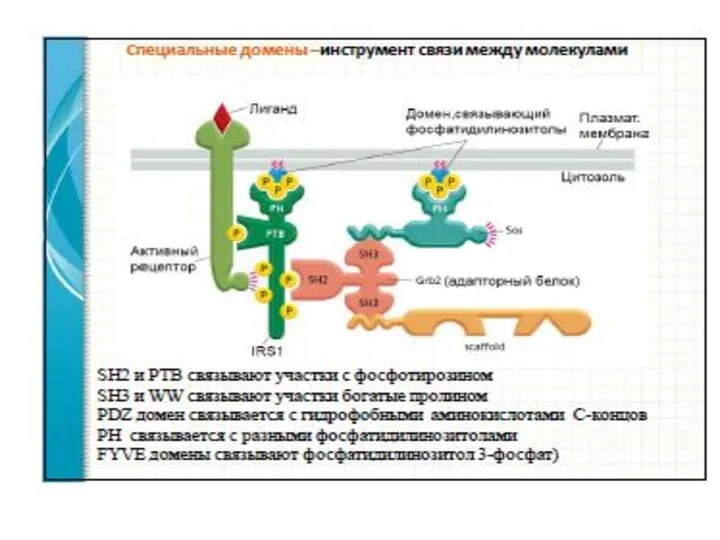
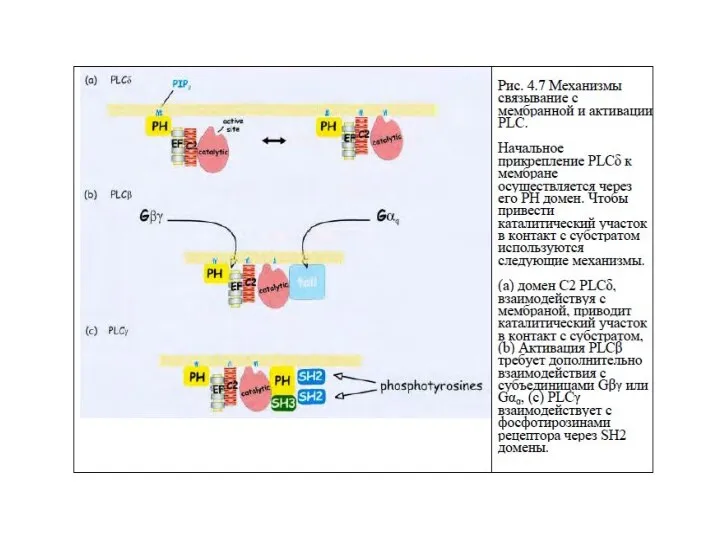
- 58. Механизм связывания с мембраной и активация ФЛС 1.Начальное связывание ФЛС с мембраной происходит через домен РН
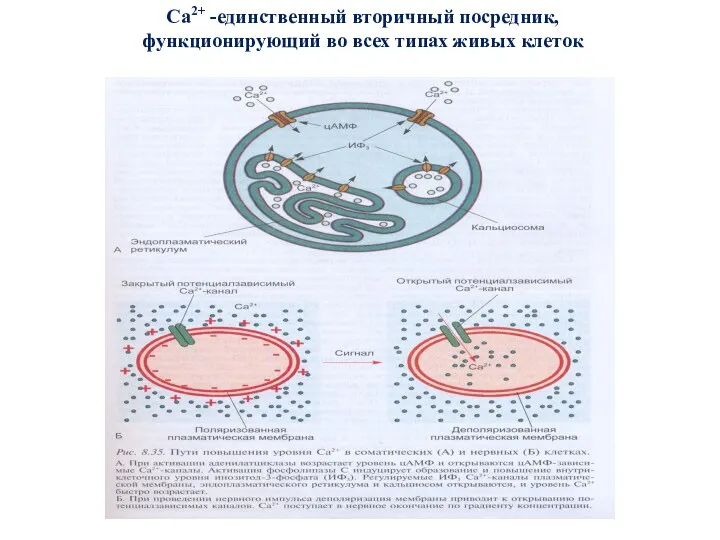
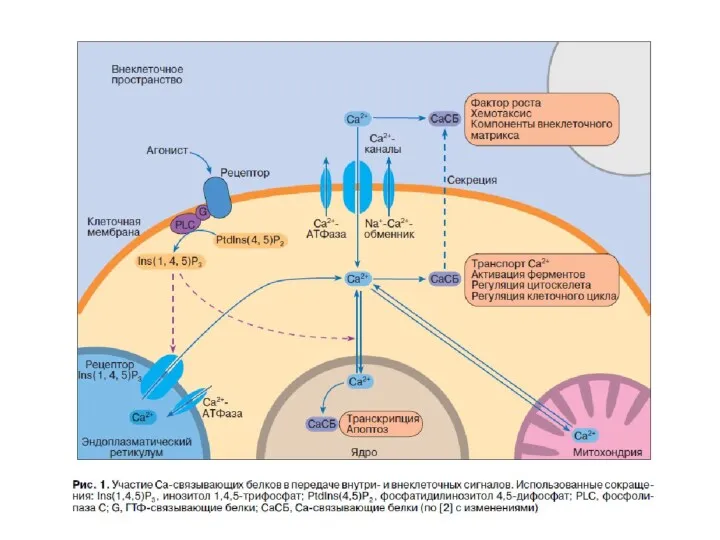
- 63. Са2+ -единственный вторичный посредник, функционирующий во всех типах живых клеток
- 64. Са 2+ - ключевой вторичный посредник Различают 3 состояния Са2+ в клетках нескелетообра-зующих тканей: 1.Са2+, локализованный
- 65. Особенности Са 2+ как вторичного посредника 1. Са 2+ - неметаболизируемый (стабильный) катион и его внутриклеточной
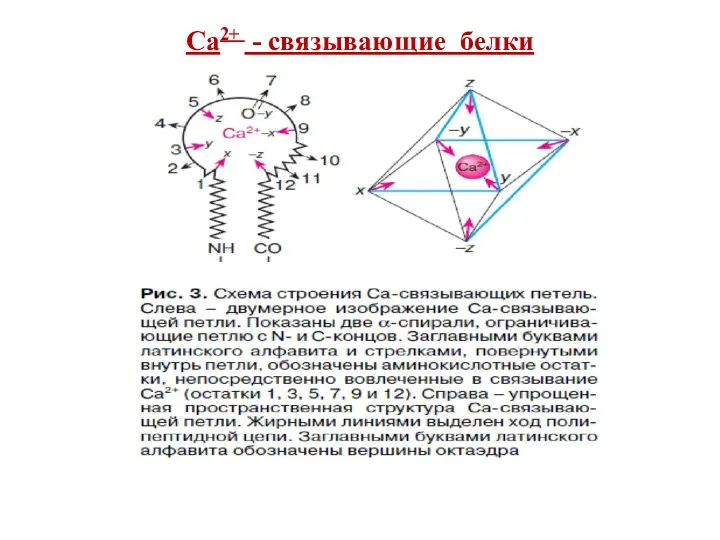
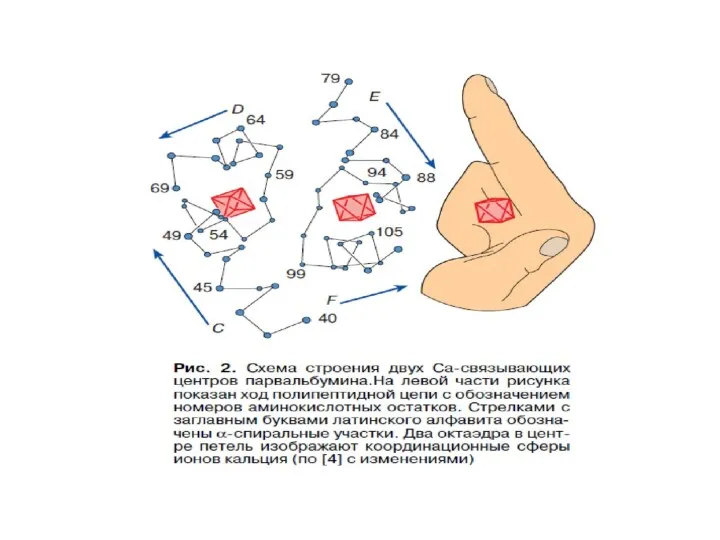
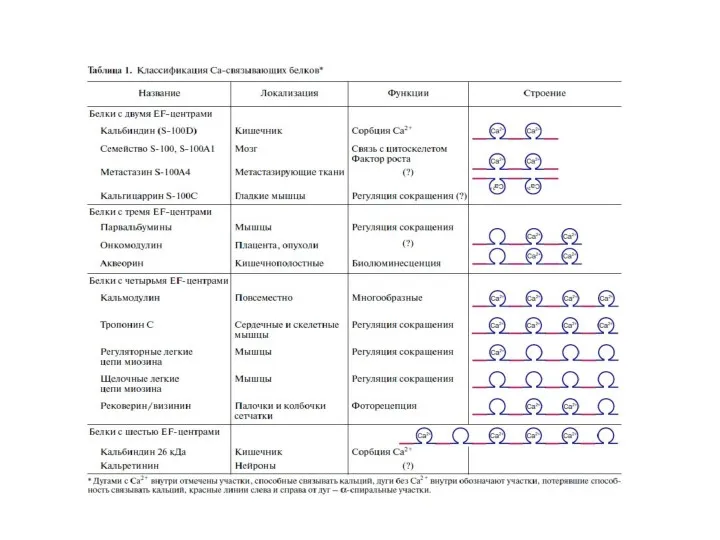
- 66. Внутриклеточные Са2+-связывающие белки определяют Са2-опосредованные сигналы Выделяют 3 группы Са2+-связывающих белков: 1.ЕF-hand-белки (цитоплазма, ядро)- содержат EFH-фраг-мент
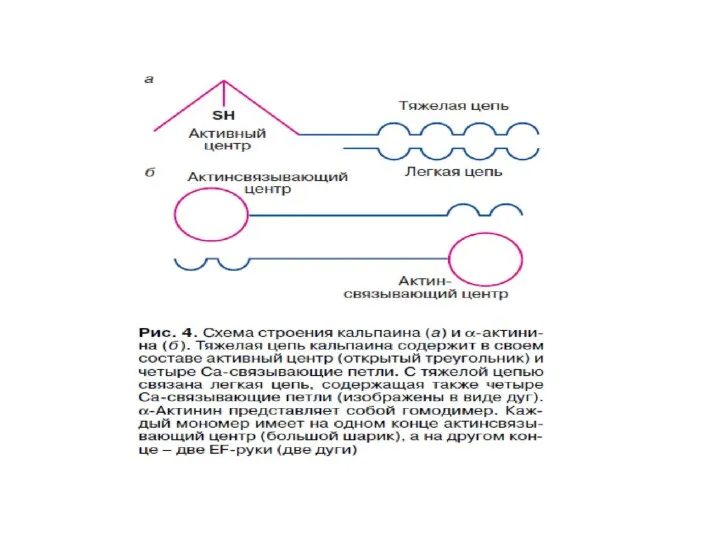
- 67. Са2+ - связывающие белки
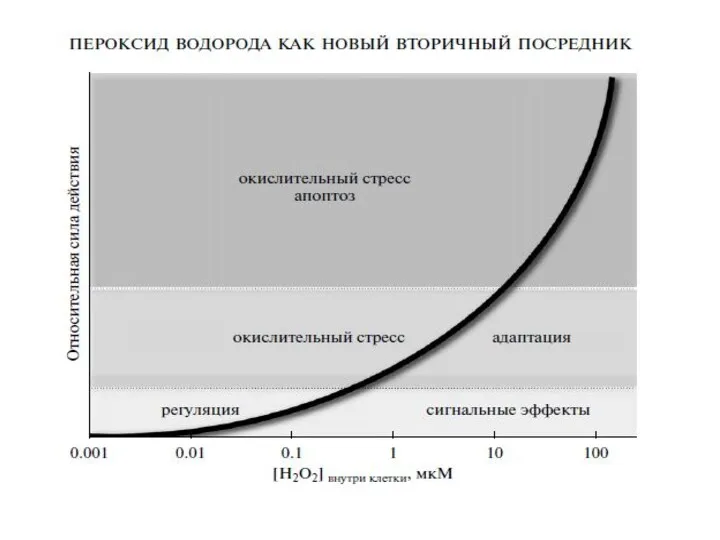
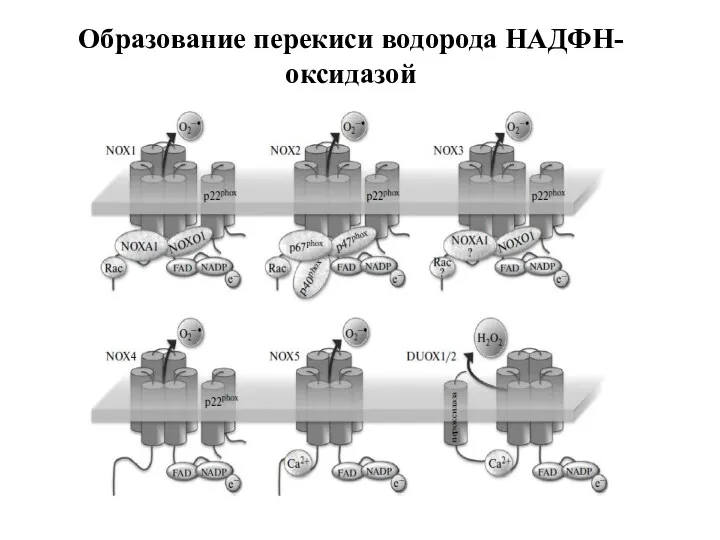
- 76. Источники перекиси водорода в клетке: НАДФН-оксидаза Электрон-транспортная цепь митохондрий Электрон-транспортная цепь микросом Ксантиноксидоредуктаза (КОР) Супероксиддисмутаза Пути
- 77. Образование перекиси водорода НАДФН-оксидазой
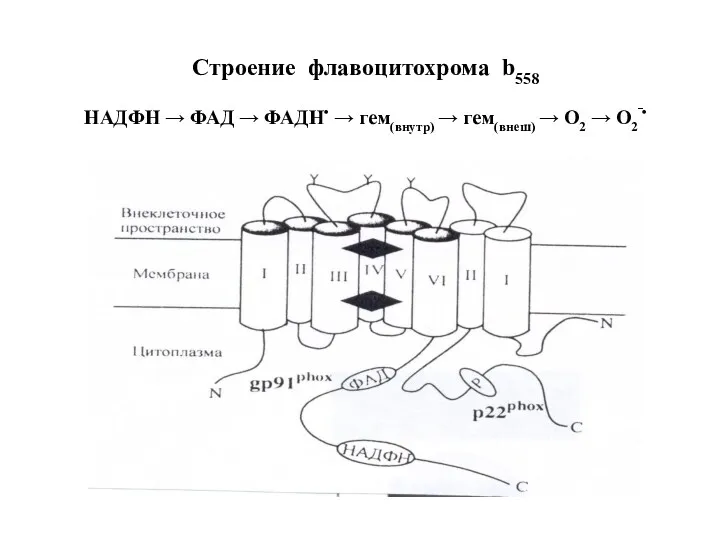
- 78. Строение флавоцитохрома b558 НАДФН → ФАД → ФАДН• → гем(внутр) → гем(внеш) → О2 → О2‾•
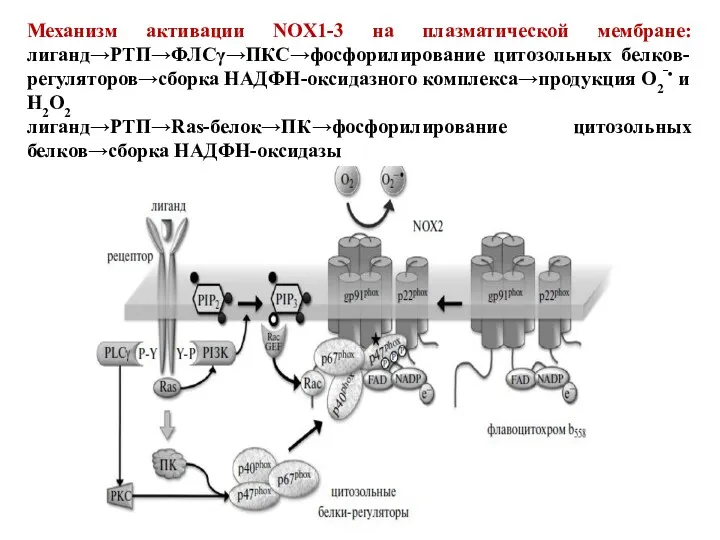
- 79. Механизм активации NOX1-3 на плазматической мембране: лиганд→РТП→ФЛСγ→ПКС→фосфорилирование цитозольных белков-регуляторов→сборка НАДФН-оксидазного комплекса→продукция О2‾• и Н2О2 лиганд→РТП→Ras-белок→ПК→фосфорилирование цитозольных
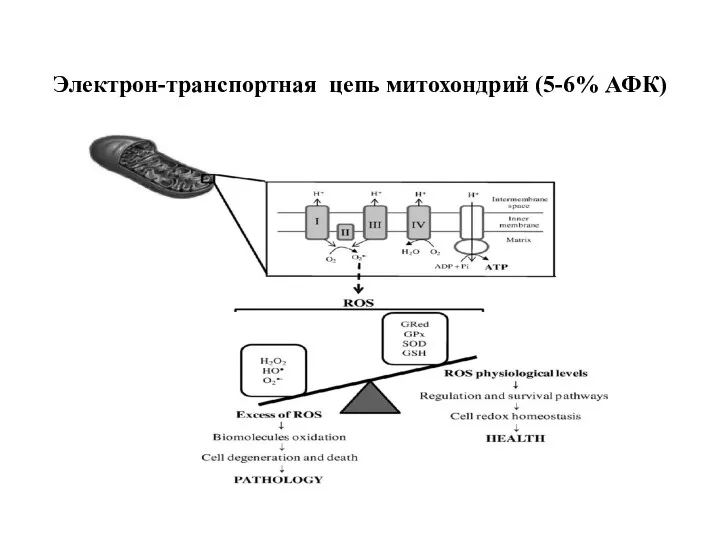
- 80. Электрон-транспортная цепь митохондрий (5-6% АФК)
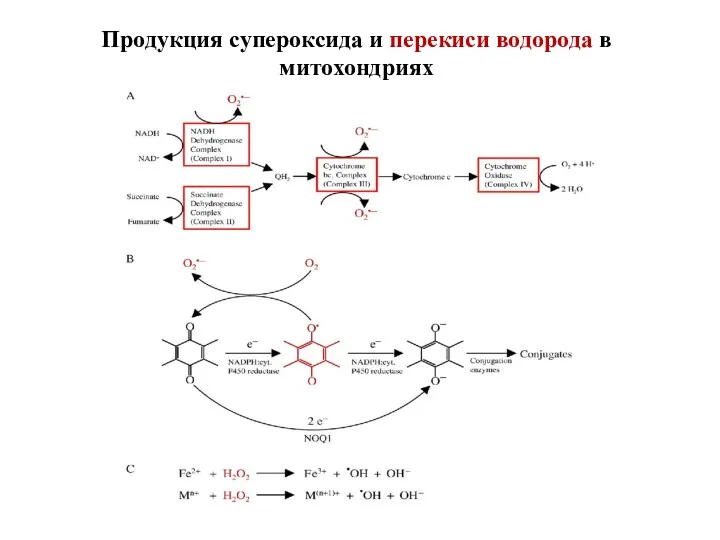
- 81. Продукция супероксида и перекиси водорода в митохондриях
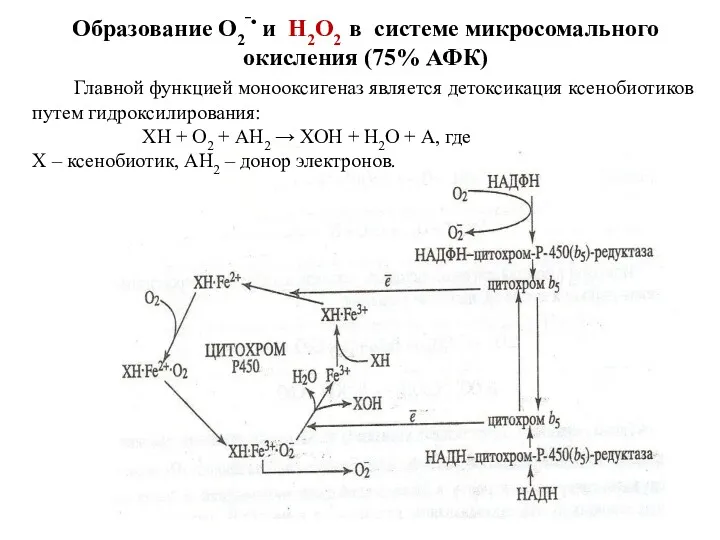
- 82. Образование О2‾• и Н2О2 в системе микросомального окисления (75% АФК) Главной функцией монооксигеназ является детоксикация ксенобиотиков
- 83. Ксантиноксидоредуктаза – источник перекиси водорода в клетке Ксантиноксидоредуктаза представлена двумя изоформами: ксантиндегидрогеназой (КД) и ксантиноксидазой (КО).
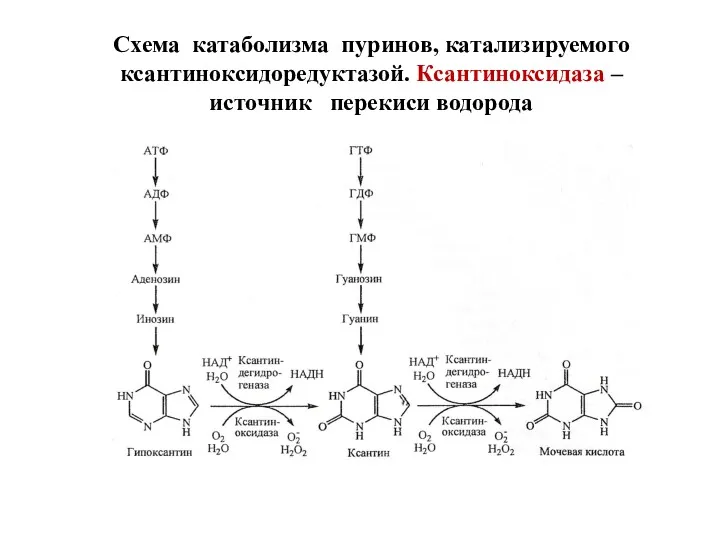
- 84. Схема катаболизма пуринов, катализируемого ксантиноксидоредуктазой. Ксантиноксидаза – источник перекиси водорода
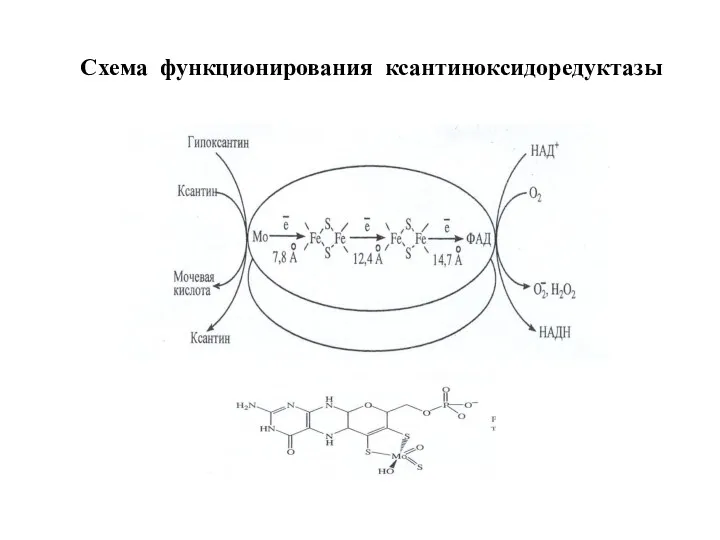
- 85. Схема функционирования ксантиноксидоредуктазы
- 86. Супероксиддисмутазы (СОД) – суперсемейство ферментов, относящихся к классу оксидоредуктаз и катализирующих реакцию дисмутации супероксидного анион-радикала с
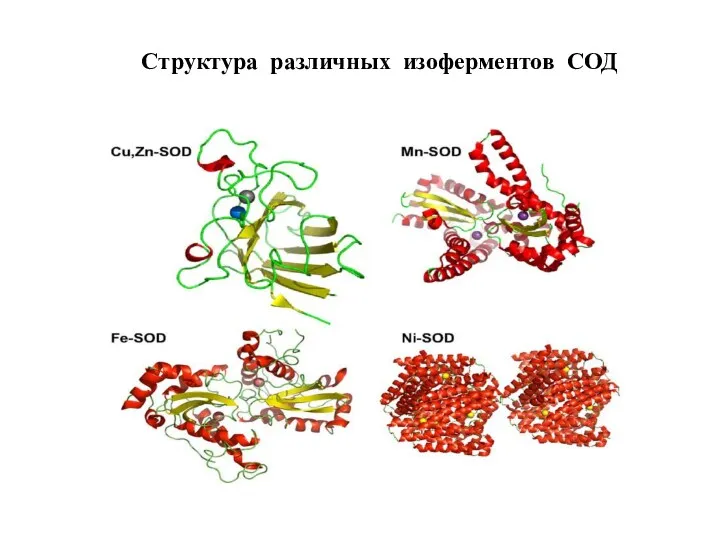
- 87. Структура различных изоферментов СОД
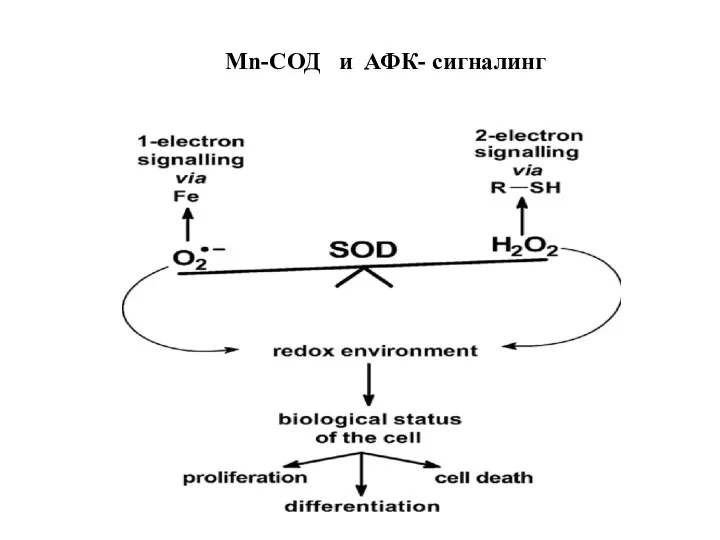
- 88. Mn-СОД и АФК- сигналинг
- 89. Элиминация перекиси водорода в клетке осуществляется ферментативным путем: 1.Каталаза – гемсодержащий внутриклеточный фермент (тетрамер): 2Н2О2 →
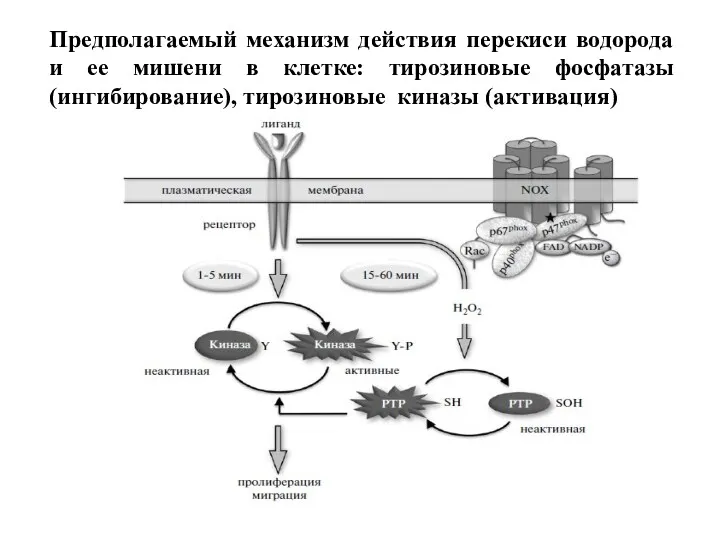
- 90. Предполагаемый механизм действия перекиси водорода и ее мишени в клетке: тирозиновые фосфатазы (ингибирование), тирозиновые киназы (активация)
- 91. Дополнительные слайды
- 100. Скачать презентацию



























 Растительный и животный мир пустыни
Растительный и животный мир пустыни Промысловые рыбы
Промысловые рыбы Энергообеспечение мышечной деятельности
Энергообеспечение мышечной деятельности Урок-презентация. Плоды, их строение, значение, распространение в природе
Урок-презентация. Плоды, их строение, значение, распространение в природе Жизнь в Мировом океане
Жизнь в Мировом океане Что такое онтогенез? Представления об онтогенезе: эпигенез, преформизм, современное
Что такое онтогенез? Представления об онтогенезе: эпигенез, преформизм, современное Биотехнология в селекции растений. Часть 1. Селекция на важнейшие хозяйственные свойства
Биотехнология в селекции растений. Часть 1. Селекция на важнейшие хозяйственные свойства Пищеварение в кишечнике. 8 класс
Пищеварение в кишечнике. 8 класс Уход за комнатными растениями в уголке природы
Уход за комнатными растениями в уголке природы Семя, его строение и значение
Семя, его строение и значение Влияние экологических факторов на организмы
Влияние экологических факторов на организмы КЛЕТКА
КЛЕТКА Генетическая инженерия. Тема №1
Генетическая инженерия. Тема №1 Вид. Критерии вида
Вид. Критерии вида Популяционно-статистический метод
Популяционно-статистический метод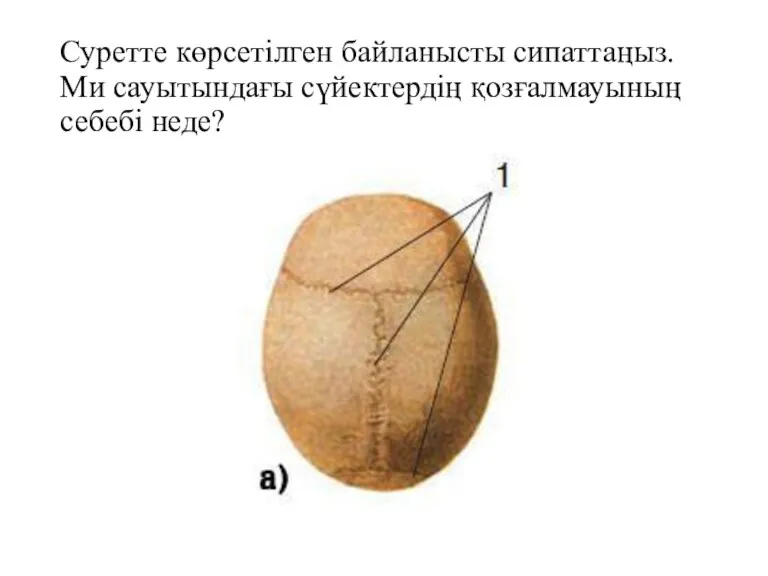 Сүйектің байланысу түрлері
Сүйектің байланысу түрлері Тип круглые черви
Тип круглые черви Проявления генов в развитии. Плейотропное действие гена
Проявления генов в развитии. Плейотропное действие гена Энергетический обмен углеводов. 10 класс
Энергетический обмен углеводов. 10 класс среда обитания 9 класс
среда обитания 9 класс Повреждение ядра клетки
Повреждение ядра клетки Достижения в селекции животных
Достижения в селекции животных головоногия моллюски
головоногия моллюски 7 самых ядовитых растений России
7 самых ядовитых растений России Адаптация организма человека к факторам окружающей среды
Адаптация организма человека к факторам окружающей среды презентация Интеллектуальный марафон
презентация Интеллектуальный марафон Корень. Типы корневых систем. Урок биологии, 6 класс
Корень. Типы корневых систем. Урок биологии, 6 класс Физиология вегетативной нервной системы (ВНС)
Физиология вегетативной нервной системы (ВНС)