Содержание
- 2. Существует мнение: Все, что сделано ранее и делается сегодня – редукционистская биология. Надо изучать биологические системы
- 3. Системная биология (systems biology) — междисциплинарная наука о жизни, изучающая сложные взаимодействия в живых системах, использующая
- 4. Компьютерная модель полного жизненного цикла патогена Mycoplasma genitalium (2012 г.) Идея: Если на базе огромного количества
- 5. Однако: Без достижений редукционистской биологии невозможно создать «системную биологию».
- 6. 2006 – Э. Файер и К. Мелло «за открытие РНК-интерференции — эффекта гашения активности генов». 2007
- 7. Утром белки-активаторы BMal1 и Clock переходят из цитоплазмы в ядро клетки и там прикрепляются к участку
- 8. Генная инженерия in vitro Векторы (плазмиды, вирусы, фаги и др.) Ферменты (рестриктазы, лигазы, фосфатазы, ревертазы) (1967-1970
- 9. культивирование соматических клеток животных in vitro (конец 50-х годов XX века, в России – Н.И. Шапиро),
- 10. Селективная среда ГAT (НАТ) (гипоксантин, аминоптерин и тимидин) 1) Основной путь синтеза пуриновых и пиримидиновых оснований
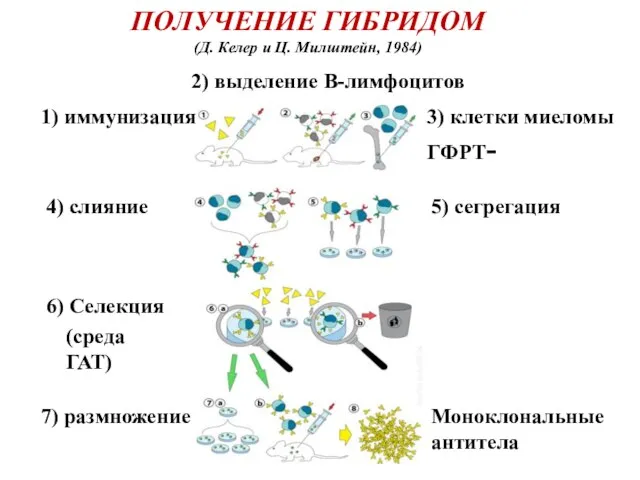
- 11. 1) иммунизация 2) выделение В-лимфоцитов 3) клетки миеломы ГФРТ- 4) слияние 5) сегрегация 6) Селекция 7)
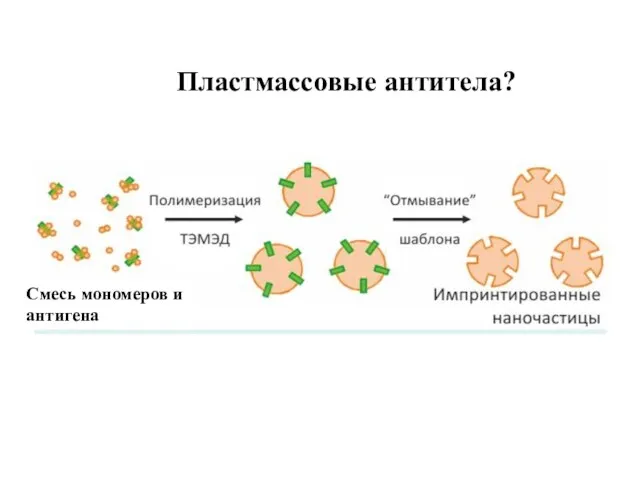
- 12. Пластмассовые антитела? Смесь мономеров и антигена
- 13. Трансдукция (transduction) [лат. transductio — перемещение] — перенос ДНК (генов) из одной бактериальной клетки в другую,
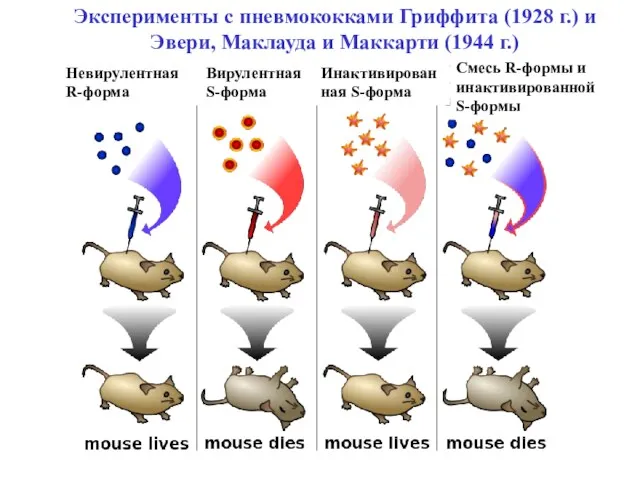
- 14. Эксперименты с пневмококками Гриффита (1928 г.) и Эвери, Маклауда и Маккарти (1944 г.) Вирулентная S-форма Невирулентная
- 15. Трансфекция (transfection) [лат. trans — сквозь, через, за и inficere — портить, заражать] — 1) в
- 16. Искусственный перенос генов в целые организмы и клетки (трансфекция) – начальный этап Бенуа (1957 г.) –
- 17. Методы, используемые для транфекции эукариотических клеток Кальций-фосфатный метод (Грехем, Ван дер Еб, 1973) Декстрановый метод ДМСО-метод
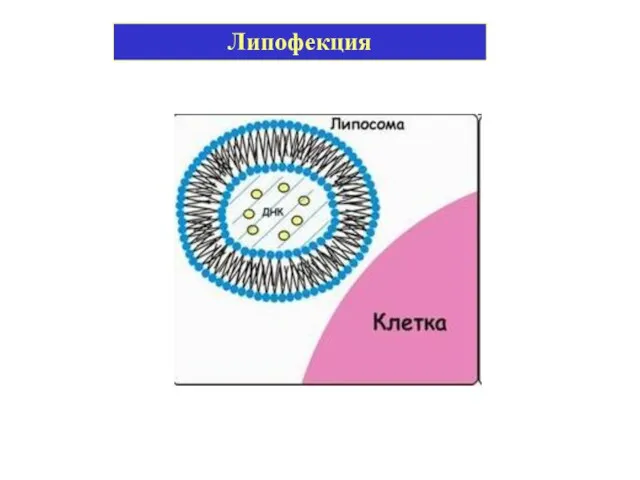
- 18. Липофекция
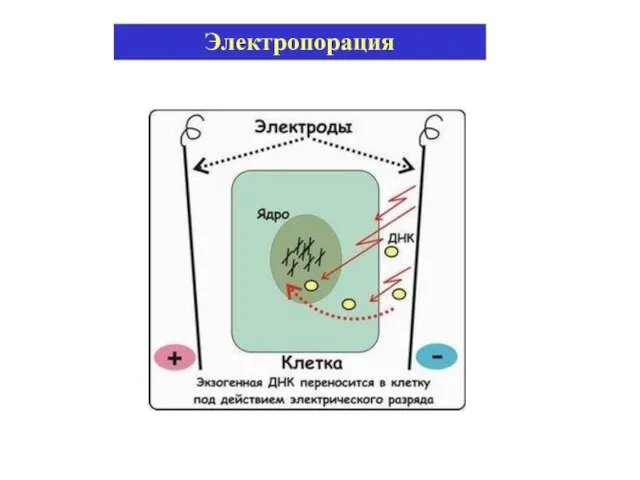
- 19. Электропорация
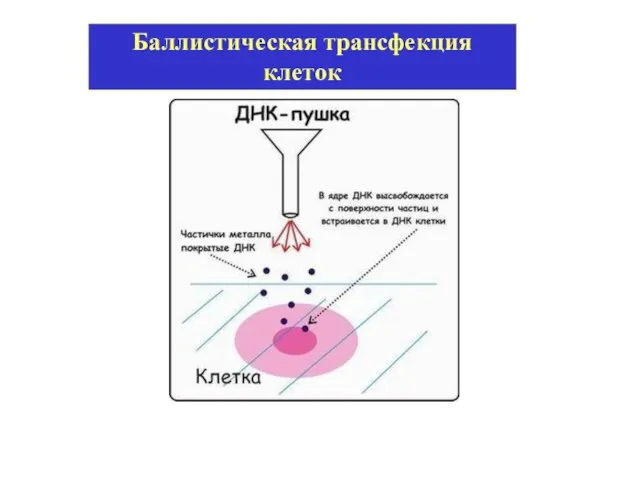
- 20. Баллистическая трансфекция клеток
- 21. Импалефекция – метод доставки генов с применением наноматериалов (углеродные нанотрубки и нановолокна).
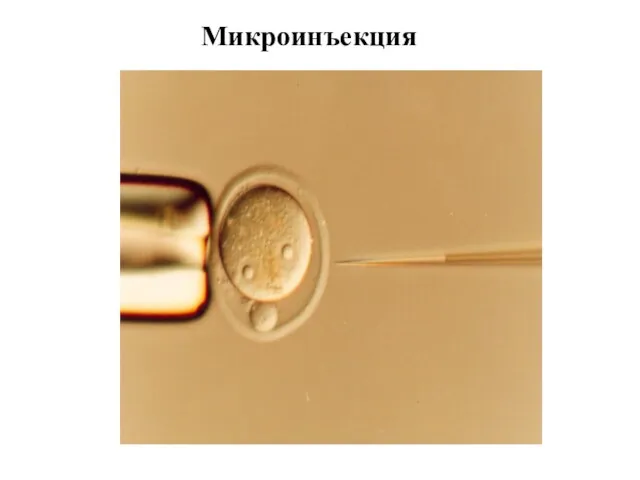
- 22. Микроинъекция
- 23. Перенос ранних зародышей от донора реципиенту 1890 г. – Уолтор Хип – первый успешный перенос ранних
- 24. Культивирование эмбрионов in vitro 1958 – Мак Ларен и Бриггс – культивирование эмбрионов мыши со стадии
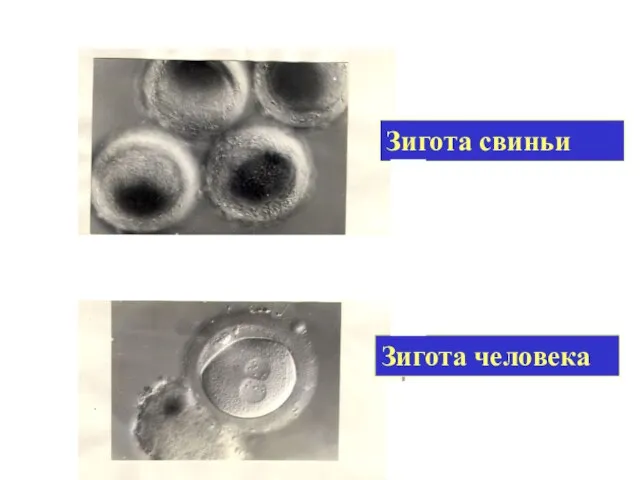
- 25. Зигота человека Зигота свиньи
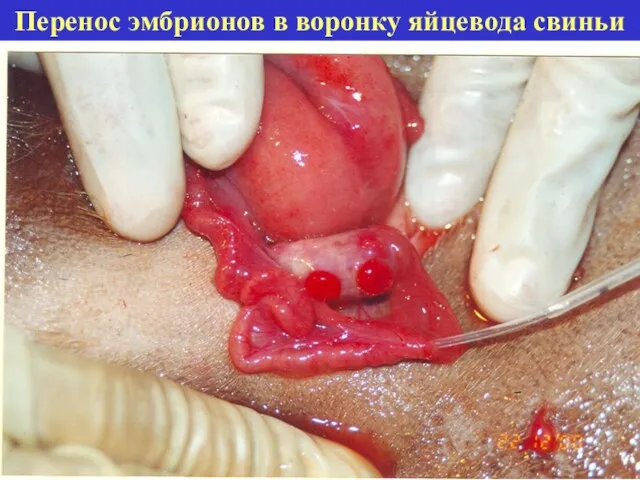
- 26. Перенос эмбрионов в воронку яйцевода свиньи
- 27. 1-й день – выделение яйцеклеток из фолликулов яичников шприцом с иглой (в каждом яичнике от 10
- 28. Химера (chimera, chimaera) [греч. Chimaira — мифическое чудовище, имеющее голову льва, туловище козы и хвост дракона]
- 29. Виды химеризма Первичный химеризм: - искусственная комбинация клеток зародышей предимплатационных стадий, - спонтанное оплодотворение сперматозоидами яйцеклетки
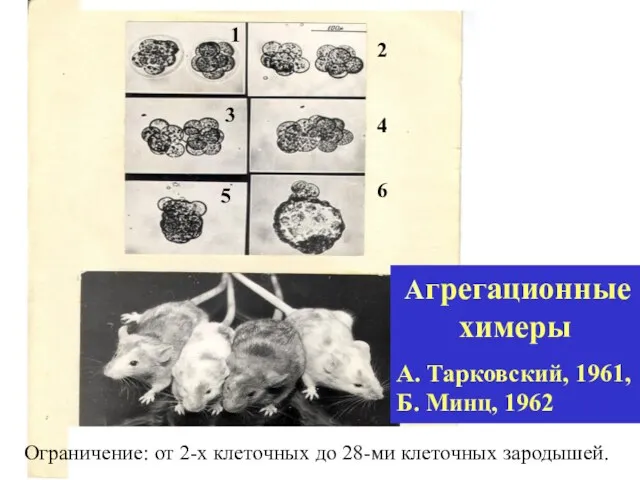
- 30. Агрегационные химеры А. Тарковский, 1961, Б. Минц, 1962 1 2 3 4 5 6 Ограничение: от
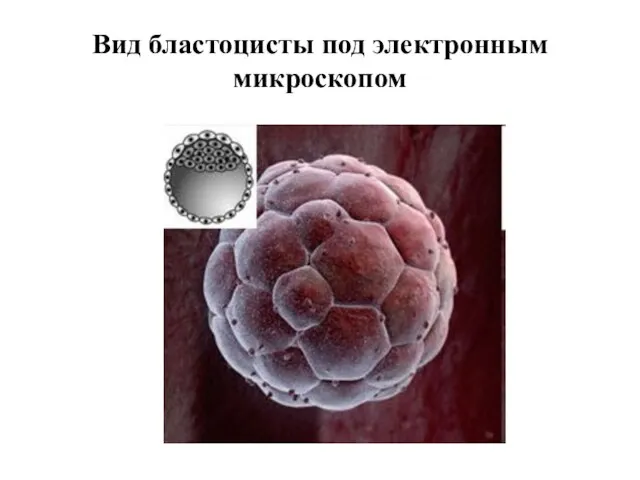
- 31. Вид бластоцисты под электронным микроскопом
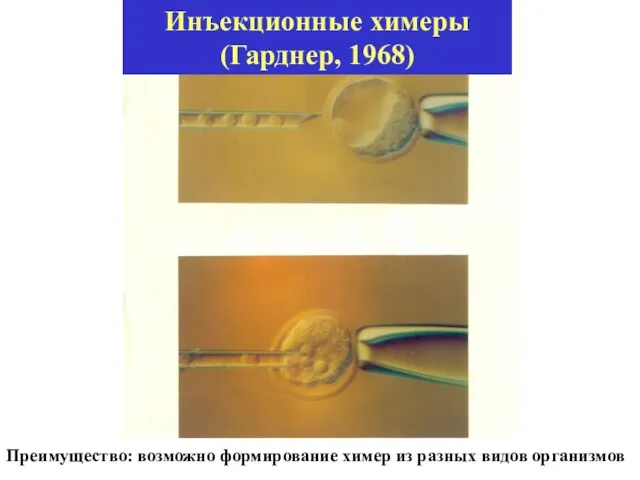
- 32. Инъекционные химеры (Гарднер, 1968) Преимущество: возможно формирование химер из разных видов организмов
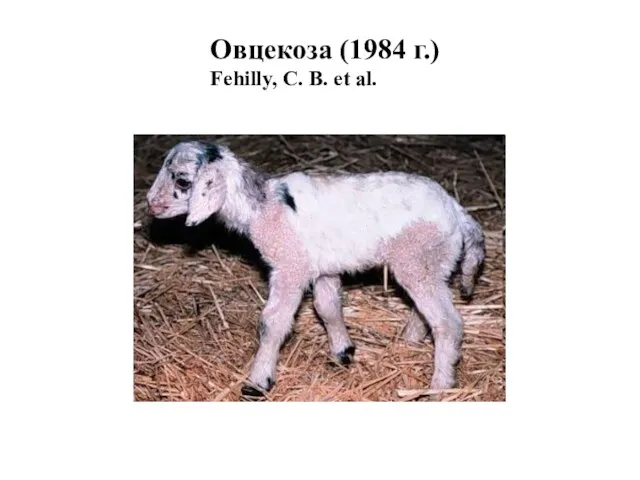
- 34. Овцекоза (1984 г.) Fehilly, C. B. et al.
- 35. Химерные макаки как результат агрегации бластомеров (Ш. Миталипов и др., 2012 г.) Потомки 12-ти родителей
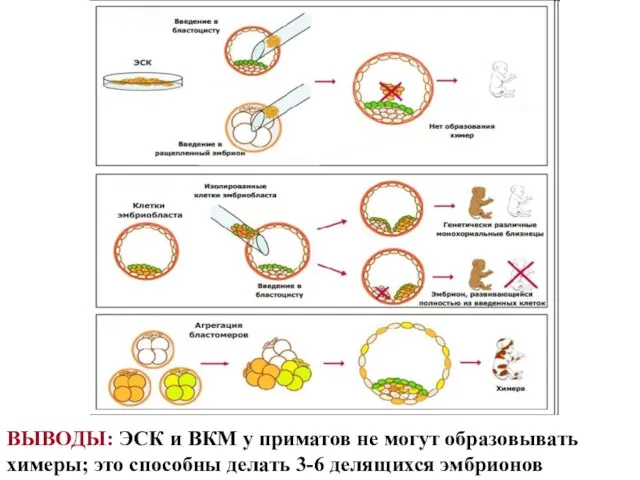
- 36. ВЫВОДЫ: ЭСК и ВКМ у приматов не могут образовывать химеры; это способны делать 3-6 делящихся эмбрионов
- 37. Главный вывод: Культивированные in vitro эмбриональные стволовые клетки не обладают полностью свойствами стволовых клеток, существующих в
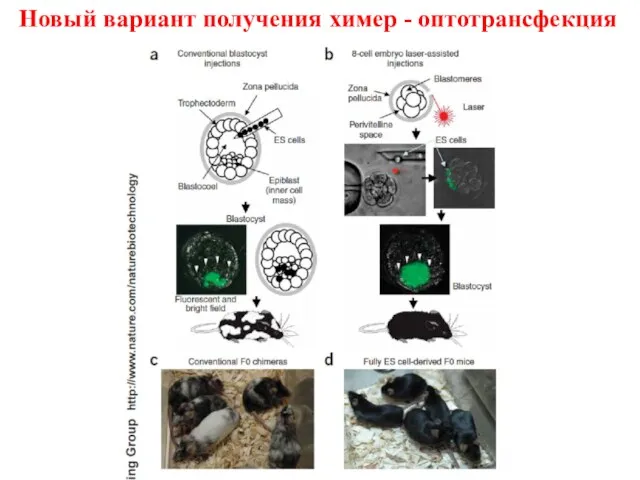
- 38. Новый вариант получения химер - оптотрансфекция
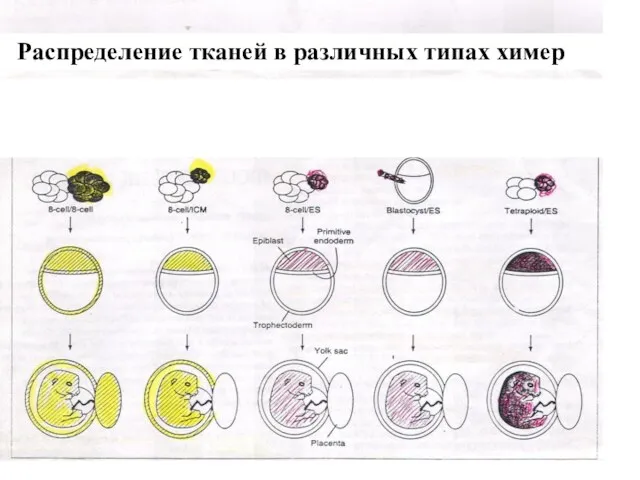
- 39. Распределение тканей в различных типах химер
- 40. Что можно выяснять с помощью метода создания химер? Используя две клеточные популяции, можно проследить в онтогенезе
- 41. Примеры использования химер для решения проблем онтогенеза Тарковский: наличие в зачатке гонады клеток мужского пола предотвращают
- 42. Стволовые клетки
- 43. Тотипотентность (totipotency) [лат. totus — весь, целый и potentia — сила] — способность клетки дифференцироваться в
- 44. Плюри- или тотипотентны эмбриональные стволовые клетки?
- 46. Скачать презентацию









![Трансдукция (transduction) [лат. transductio — перемещение] — перенос ДНК (генов)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/433665/slide-12.jpg)

















 Тип хордовые
Тип хордовые Клетка.10 класс
Клетка.10 класс Презентация к уроку биологии 7 класс Круглые черви
Презентация к уроку биологии 7 класс Круглые черви Презентация к уроку на тему Видоизменение побегов в 6 классе
Презентация к уроку на тему Видоизменение побегов в 6 классе Многолетние бобовые травы. Клевер луговой, гибридный, ползучий
Многолетние бобовые травы. Клевер луговой, гибридный, ползучий Зарождение человека. Процесс оплодотворения. Эмбриональное развитие плода
Зарождение человека. Процесс оплодотворения. Эмбриональное развитие плода Царство Бактерии
Царство Бактерии Лист – вегетативный орган растения
Лист – вегетативный орган растения Алоэ өсімдігінің шипалық қасиеті
Алоэ өсімдігінің шипалық қасиеті Раздел анатомии спланхнология. (Лекция 1)
Раздел анатомии спланхнология. (Лекция 1) Фрукти і овочі: характеристика, вимоги до якості, умови зберігання
Фрукти і овочі: характеристика, вимоги до якості, умови зберігання Sistemul nervos
Sistemul nervos Презентация Гигиена органов пищеварения
Презентация Гигиена органов пищеварения Ғарыш және биологиялық ырғақ
Ғарыш және биологиялық ырғақ Строение, свойства и функции углеводов и липидов в клетке
Строение, свойства и функции углеводов и липидов в клетке Генна інженерія та її досягнення
Генна інженерія та її досягнення Ядро клетки. Хромосомный набор клетки
Ядро клетки. Хромосомный набор клетки туберкулез
туберкулез Испарение воды растениями
Испарение воды растениями Тренажёр Вода
Тренажёр Вода Методическая копилка
Методическая копилка Три среды обитания организмов
Три среды обитания организмов Азотное питание растений
Азотное питание растений Культивирование бактерий
Культивирование бактерий Семейства кошачих. Домашние кошки, тигры
Семейства кошачих. Домашние кошки, тигры Класс Двудольные. Семейство Крестоцветные
Класс Двудольные. Семейство Крестоцветные Life cycle assessment
Life cycle assessment Биологические ритмы человека. Сон и его значение
Биологические ритмы человека. Сон и его значение