Содержание
- 2. План лекции Что такое КЩР? Откуда берутся кислоты в организме и как их нейтрализовать? Что такое
- 3. Кислотно-основное состояние Кислотность - концентрация свободных ионов Н в растворе (РН) Кислота отдает ионы водорода (Н),
- 4. Что такое КЩР? Важнейшим показателем постоянства внутренней среды организма является рН крови. Кровь млекопитающих и человека
- 5. Несмотря на непрерывное поступление в кровь кислых и щелочных продуктов обмена, рН крови поддерживается на достаточно
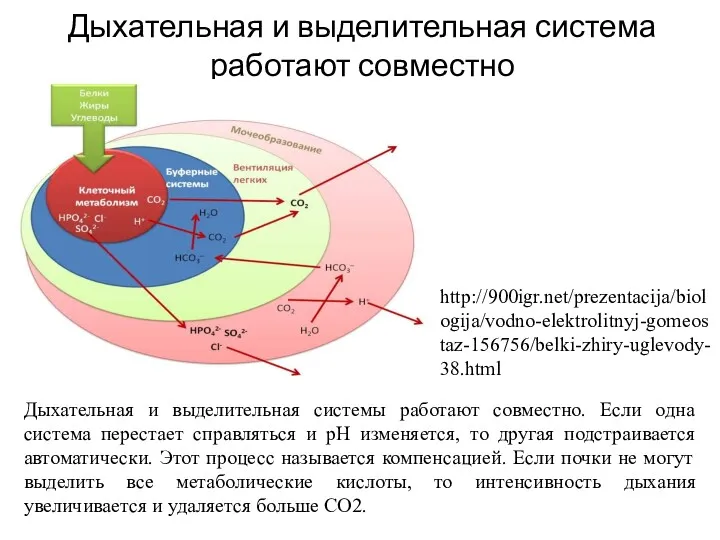
- 6. Дыхательная и выделительная система работают совместно Дыхательная и выделительная системы работают совместно. Если одна система перестает
- 7. Как удаляется Н+? Дыхательный механизм : легкие удаляют избыток СО2 через 1-3 мин. РаСО2 зависит от
- 8. Буферными называют растворы, связывающие кислоты или щелочи и, тем самым, препятствующие изменению рН. Главные пути поддержания
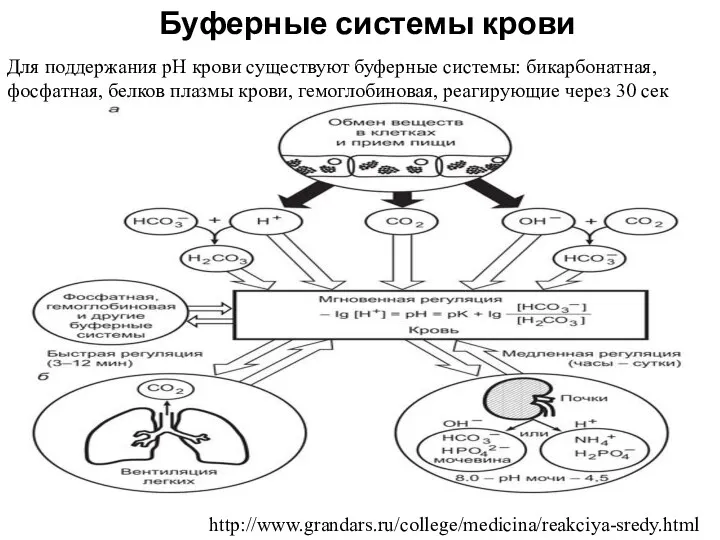
- 9. Буферные системы крови http://www.grandars.ru/college/medicina/reakciya-sredy.html Для поддержания рН крови существуют буферные системы: бикарбонатная, фосфатная, белков плазмы крови,
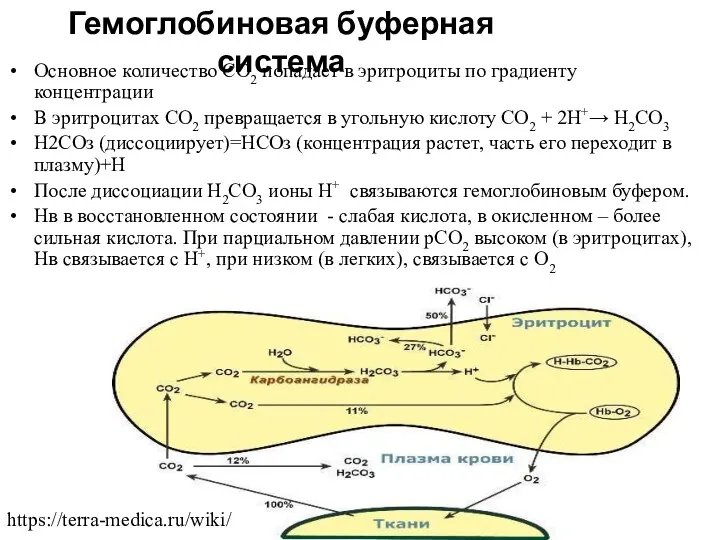
- 10. Основное количество СО2 попадает в эритроциты по градиенту концентрации В эритроцитах СО2 превращается в угольную кислоту
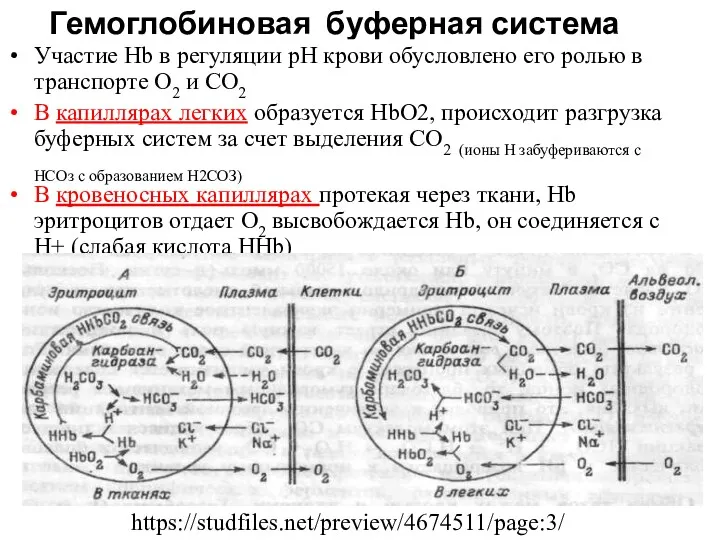
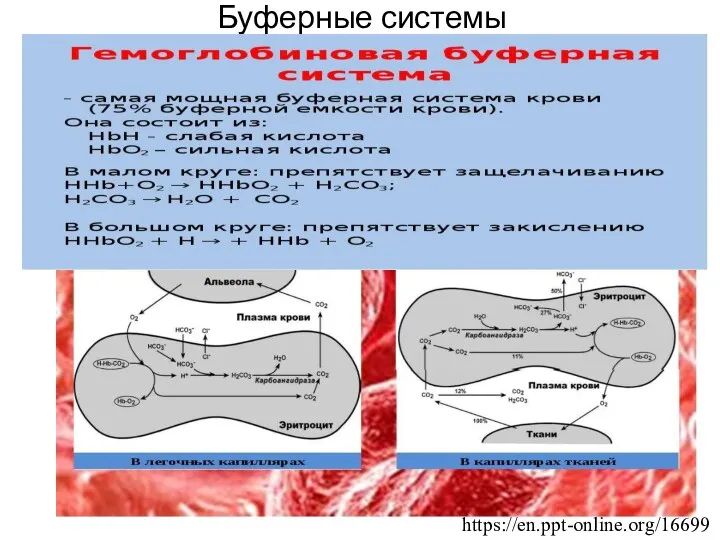
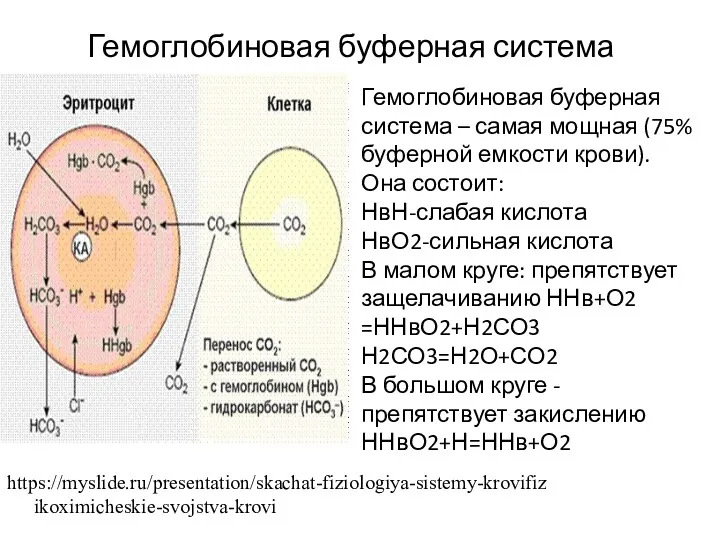
- 11. Гемоглобиновая буферная система Участие Hb в регуляции рН крови обусловлено его ролью в транспорте О2 и
- 12. https://en.ppt-online.org/16699 Буферные системы
- 13. https://myslide.ru/presentation/skachat-fiziologiya-sistemy-krovifizikoximicheskie-svojstva-krovi Гемоглобиновая буферная система Гемоглобиновая буферная система – самая мощная (75% буферной емкости крови). Она состоит:
- 14. Белковая буферная система Белки плазмы крови участвуют в регуляции рН благодаря свойствам амфотерности: с кислотами они
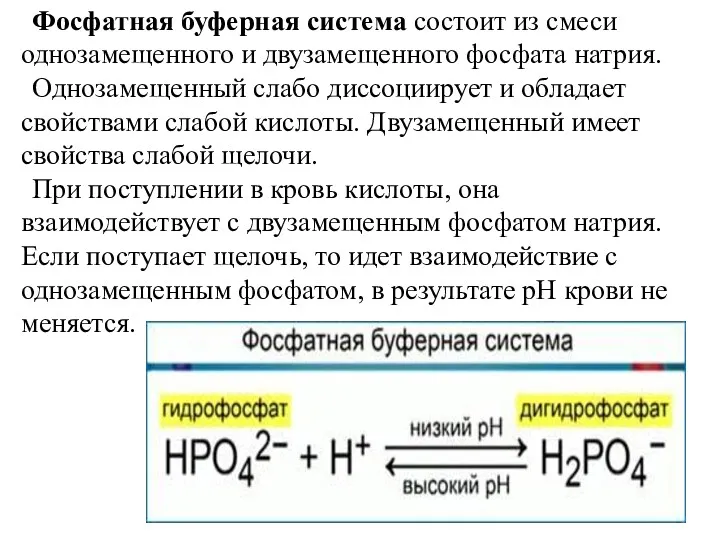
- 15. Фосфатная буферная система состоит из смеси однозамещенного и двузамещенного фосфата натрия. Однозамещенный слабо диссоциирует и обладает
- 16. Фосфатная буферная система Na2HPO4 + NaH2PO4 основание кислота Буферная емкость: 1% общей буферной емкости крови Буферное
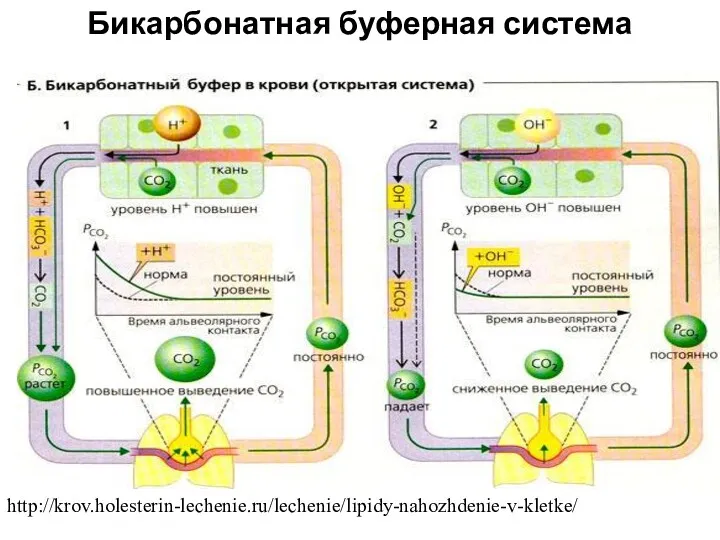
- 17. Бикарбонатная буферная система http://krov.holesterin-lechenie.ru/lechenie/lipidy-nahozhdenie-v-kletke/
- 18. Бикарбонатная буферная система Защищая организм от нарушения концентрации водородных ионов, система срабатывает практически мгновенно –за 30
- 19. Почки управляют процессом выделения ионов Н+ и сохранения оснований При ацидозе: ионы Н+ экскретируются в мочу,
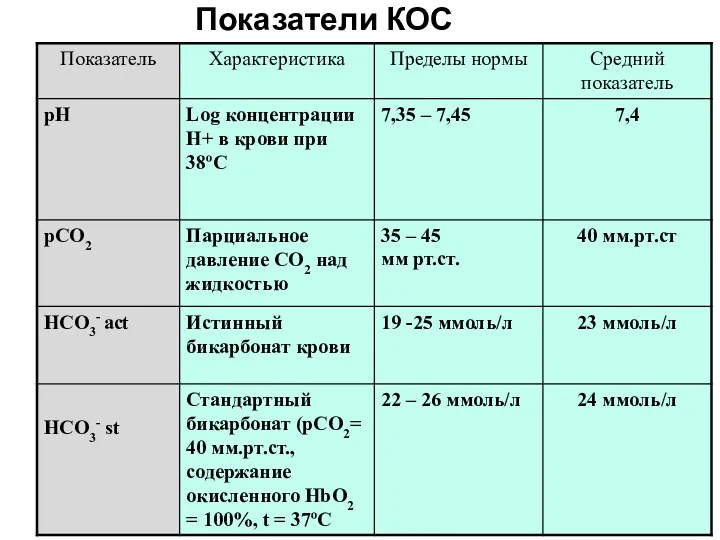
- 20. Уравнение Гендерсона-Гассельбаха рН=6,1+ log НСО3/Н2СО3 (уровень НСО3 рассчитывается по результатам анализа, а концентрация Н2СО3 нет, но
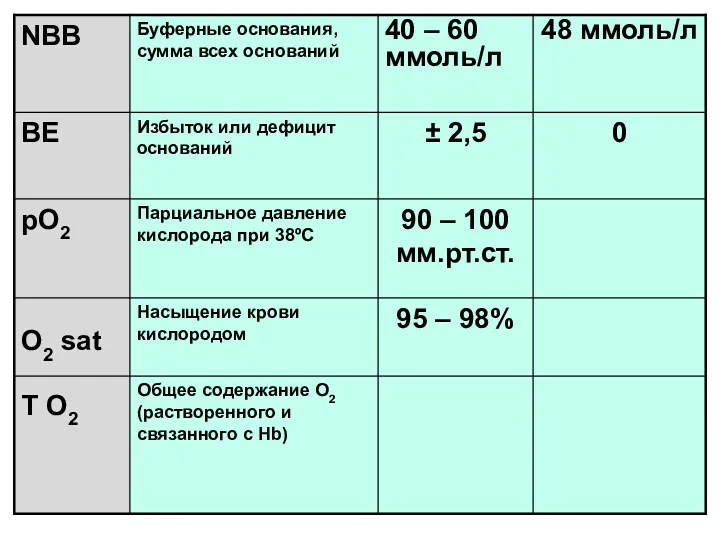
- 21. НСО3- act истинный бикарбонат непосредственно измеренные значения НСО3-st (SB) (ммоль/л) - стандартный бикарбонат - концентрация всех
- 22. ВЕ –Bases Excess Производными от концентрации буферных оснований (NВВ) является показатель избытка или недостатка буферных оснований
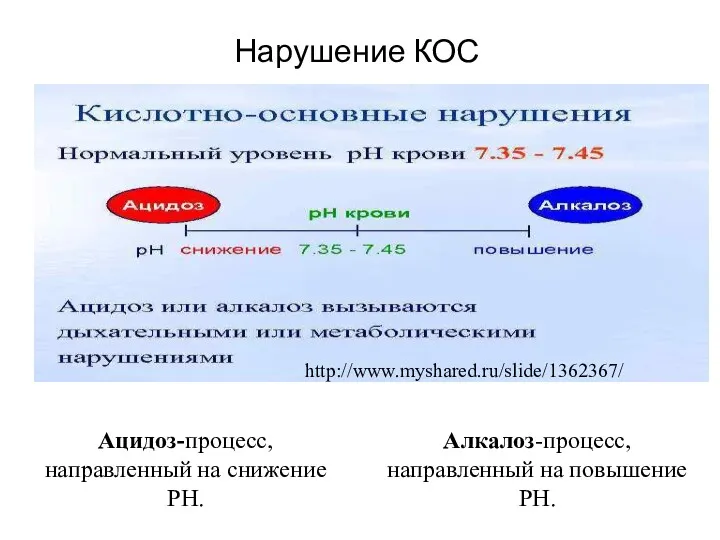
- 23. Нарушение КОС Ацидоз-процесс, направленный на снижение РН. Алкалоз-процесс, направленный на повышение РН. http://www.myshared.ru/slide/1362367/
- 24. Нарушение КОС Если это вызвано снижением РаСО2- дыхательный (респираторный) алкалоз (при усиленной частоте и глубине дыхания
- 25. Нарушение КОС Если рост РаСО2 - дыхательный (респираторный) ацидоз (снижается выведение СО2, СО2 увеличивается в легких
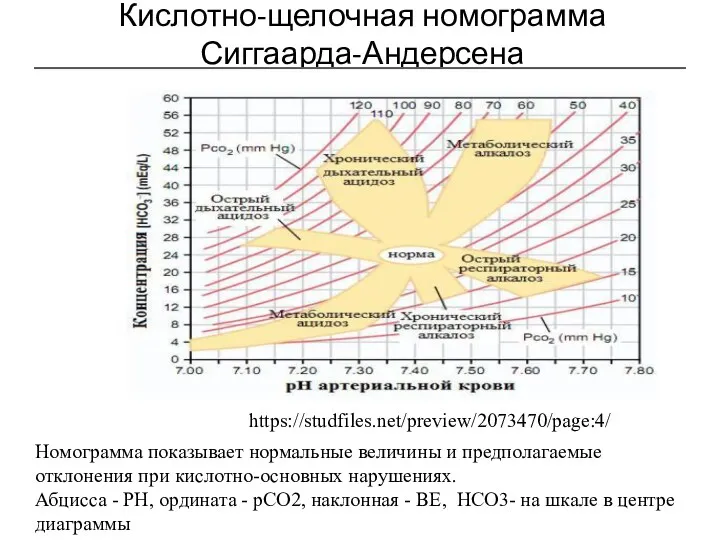
- 26. Кислотно-щелочная номограмма Сиггаарда-Андерсена Номограмма показывает нормальные величины и предполагаемые отклонения при кислотно-основных нарушениях. Абцисса - РН,
- 27. Дыхательный ацидоз- увеличение РаСО2. Поскольку СО2 растворяется с образованием Н2СО3, то это приводит к снижению РН,
- 28. Метаболический ацидоз- рост РаСО2, накопление кислот (избыточное потребление или снижение выделения почками) или избыточная потеря НСО3.
- 29. Метаболический ацидоз и нормальный анионный промежуток Вычисление анионного промежутка (АП) необходимо для выявления причины метаболического ацидоза.
- 30. Метаболический ацидоз и высокий анионный промежуток Причина с высоким анионным промежутком : потребление или избыточное образование
- 31. Лактацидоз Причина метаболического ацидоза: низкий НСО3 и повышение концентрации лактата больше 4 ммоль/л, анаэробный метаболизм, побочный
- 32. Метаболический алкалоз – любой процесс, (снижение РаСО2), направленный на повышение РН, за счет повышения концентрации НСО3.
- 33. Смешанный дыхательный и метаболический ацидоз. Опасное нарушение КОС, т.к. нет противодействия. Возникает при выраженной дыхательной недостаточности,
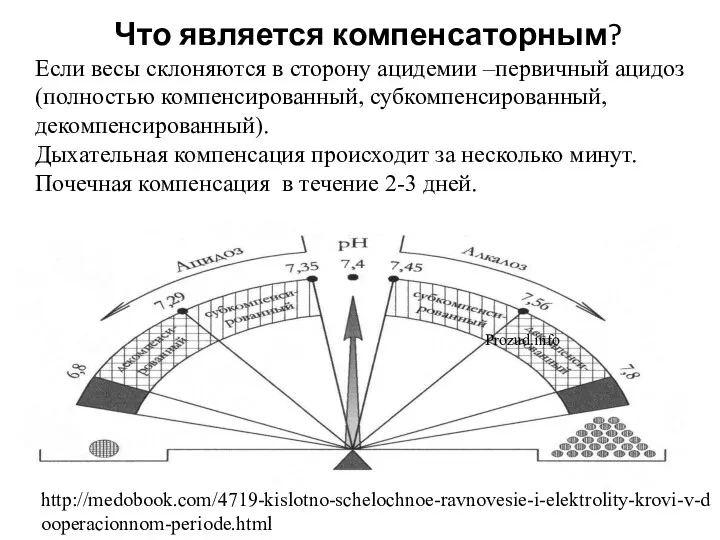
- 34. Что является компенсаторным? Если весы склоняются в сторону ацидемии –первичный ацидоз (полностью компенсированный, субкомпенсированный, декомпенсированный). Дыхательная
- 35. Метаболический ацидоз Дыхательный алкалоз Дыхательная система в ответ на первичный метаболический ацидоз реагирует увеличением альвеолярной вентиляции
- 37. Показатели КОС
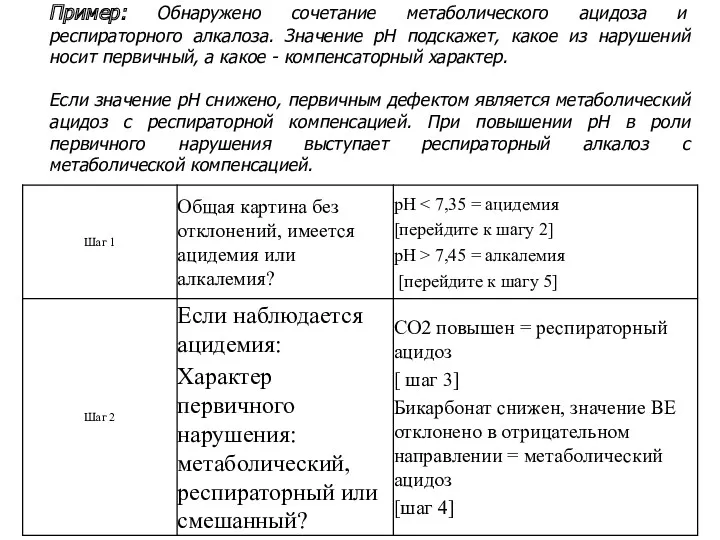
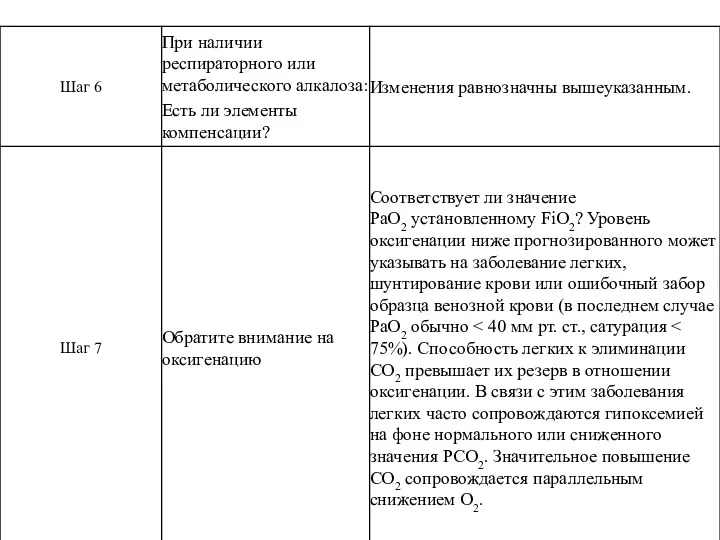
- 39. Пример: Обнаружено сочетание метаболического ацидоза и респираторного алкалоза. Значение pH подскажет, какое из нарушений носит первичный,
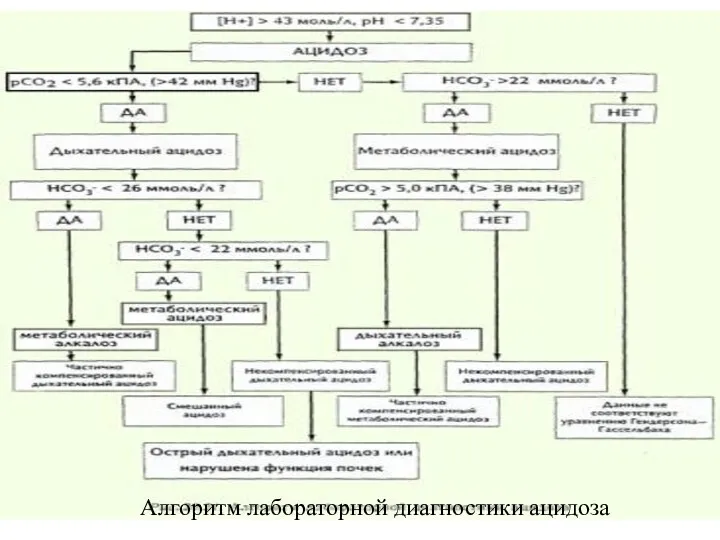
- 44. Алгоритм лабораторной диагностики ацидоза
- 46. Скачать презентацию



























 Бактериофаги. Строение бактериофага
Бактериофаги. Строение бактериофага Царства живой природы
Царства живой природы Цветок – самый красивый орган растения
Цветок – самый красивый орган растения Бактерии в жизни человека. Польза и вред
Бактерии в жизни человека. Польза и вред Ядовитые растения России
Ядовитые растения России Филогенетическое разнообразие грибоподобных организмов. Разнообразие. Систематика. Жизненные циклы
Филогенетическое разнообразие грибоподобных организмов. Разнообразие. Систематика. Жизненные циклы Значение опорно-двигательной системы. 8 класс
Значение опорно-двигательной системы. 8 класс Животные (звери)
Животные (звери) Центры происхождения культурных растений
Центры происхождения культурных растений Интересные зеленые. Игра для учащихся 6-х классов
Интересные зеленые. Игра для учащихся 6-х классов Пути и направления эволюции
Пути и направления эволюции Возрастная периодизация
Возрастная периодизация Бөлме гүлдері - адамның досы
Бөлме гүлдері - адамның досы Онтогенез. Лекция 14
Онтогенез. Лекция 14 Жәндіктер, балықтар мен адамның тыныс алу мүшелері құрылысының ерекшеліктерін зерттеу және салыстыру
Жәндіктер, балықтар мен адамның тыныс алу мүшелері құрылысының ерекшеліктерін зерттеу және салыстыру Нервная ткань
Нервная ткань Культивирование и рост микроорганизмов
Культивирование и рост микроорганизмов Путешествие по страницам Красной книги
Путешествие по страницам Красной книги Размножение живых организмов
Размножение живых организмов Комнатное растение альсобия
Комнатное растение альсобия Вода. Роль воды в жизни человека
Вода. Роль воды в жизни человека Генетика. Становление и роль в современном естествознании
Генетика. Становление и роль в современном естествознании Эндокринді бездер, қызметі. Гормондар. Гуморальдық реттелу
Эндокринді бездер, қызметі. Гормондар. Гуморальдық реттелу Витамины для зрения
Витамины для зрения Полезный мед - натуральный мед
Полезный мед - натуральный мед Эмбриональное развитие организмов
Эмбриональное развитие организмов Развитие индюка от яйца до взрослой особи
Развитие индюка от яйца до взрослой особи Универсальность строительных и функциональных блоков на молекулярном уровне организации биологических систем
Универсальность строительных и функциональных блоков на молекулярном уровне организации биологических систем