Содержание
- 2. Протеомика - это изучение белков и их взаимодействия в живых организмах, в том числе в человеческом.
- 3. Задачей протеомики является проанализировать белок, установить его последовательность, соотнести с банком данных, сделать рентген и установить
- 4. ПРОТЕОМИКА Протеомика может помочь идентифицировать и оценить новые целевые протеины гораздо эффективнее и с систематизированным подходом,
- 5. Медицинские аспекты протеомики Часто протеины требуют модификации после трансляции (т.е. после создания по плану ДНК) для
- 6. Медицинские аспекты протеомики Полиморфизм белков- еще одна причина проблем с протеинами. Это небольшие вариации ДНК, которые
- 7. Рентгеноструктурный анализ белков В настоящее время рентгеноструктурный анализ (РСА) является основным методом определения пространственной структуры биологических
- 8. Компьютерная часть является одной из составляющей процесса расшифровки структуры, т.к. данные, получен-ные в рентгеновском эксперименте, содержат
- 9. Существующие в макромолекулярной кристаллографии подходы к решению этой проблемы основаны либо на получении химическим путем изоморфных
- 10. Для выяснения механизмов биологического действия белков и их целенаправленной модификации необходимо определение их пространственного строения и
- 11. Технология Хроматография, масс-спектрометрия и программные продукты - это основные инструменты в области протеомики. В настоящее время
- 12. Система жидкостной хроматографии - масс-спектрометрии Agilent - один из основных инструментов протеомики
- 13. Масс-спектрометрия играет ключевую роль в идентификации белков и их характеризации. Большинство ученых, вовлеченных в протеомные исследования,
- 14. Прежде чем начинать анализ на ионной ловушке пептиды разделяются ВЭЖХ, что сокращает сложность смеси. В белковой
- 15. Методика скорострельного секвенирования, использованная для генома человека, включала клонирование ДНК по технологии полимеразной цепной реакции (ПЦР,
- 16. белки составляются из 20 аминокислот, а не только из четырех баз, следовательно, являются намного более сложными
- 17. Использование ловушек позволяет фрагментировать пептиды столько раз, сколько это надо для их идентификации с высокой степенью
- 18. Система высокоэффективной жидкостной хроматографии Surveyor LC, соединенная с мощнейшим программным обеспечением Xcalibur для ВЭЖХ/ MСn, создает
- 19. Автоматизированные системы анализа белков LTQ FT - самый мощный прибор для идентификации пептидов и белков LTQ
- 21. Скачать презентацию


















 презентация к уроку по теме Кровь и кровообращение. 8 класс
презентация к уроку по теме Кровь и кровообращение. 8 класс Природа человека. Теории происхождения человека
Природа человека. Теории происхождения человека Предмет и задачи микробиологии
Предмет и задачи микробиологии Водные биоресурсы и аквакультура
Водные биоресурсы и аквакультура Влияние малых доз облучения на стволовые клетки и использование облученных стволовых клеток в радиотерапии
Влияние малых доз облучения на стволовые клетки и использование облученных стволовых клеток в радиотерапии Дыхательная система человека
Дыхательная система человека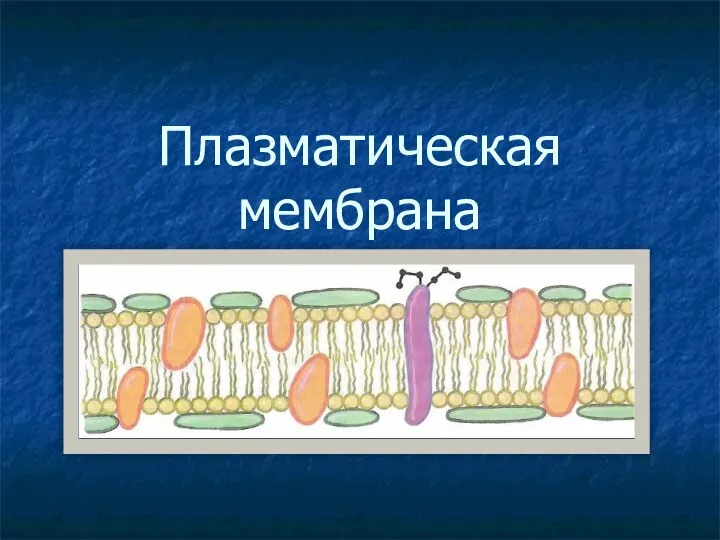 Плазматическая мембрана
Плазматическая мембрана Рефлексы
Рефлексы Tetracyclines, Chloramphenicol, Aminoglycosides
Tetracyclines, Chloramphenicol, Aminoglycosides Отряды насекомых с полным и неполным превращением
Отряды насекомых с полным и неполным превращением Физиология сенсорных систем
Физиология сенсорных систем Новые технологии
Новые технологии Как на Земле появился человек: от дриопитека к человеку прямоходящему
Как на Земле появился человек: от дриопитека к человеку прямоходящему Нормальная микрофлора человека
Нормальная микрофлора человека Злаковые
Злаковые Өсімдік текті улар
Өсімдік текті улар Лекарственные травы в домашней аптечке
Лекарственные травы в домашней аптечке Психофизиология сна
Психофизиология сна Живые клетки
Живые клетки Органы растений. Семя
Органы растений. Семя Сердечно-сосудистая система
Сердечно-сосудистая система Развитие с полным и неполным превращением. 6 класс
Развитие с полным и неполным превращением. 6 класс Презентация к уроку биологии 8 кл по теме Кожа
Презентация к уроку биологии 8 кл по теме Кожа Первый и второй законы Менделя
Первый и второй законы Менделя Лишайники, 6 класс
Лишайники, 6 класс Приспособительные способности строения и поведения животных
Приспособительные способности строения и поведения животных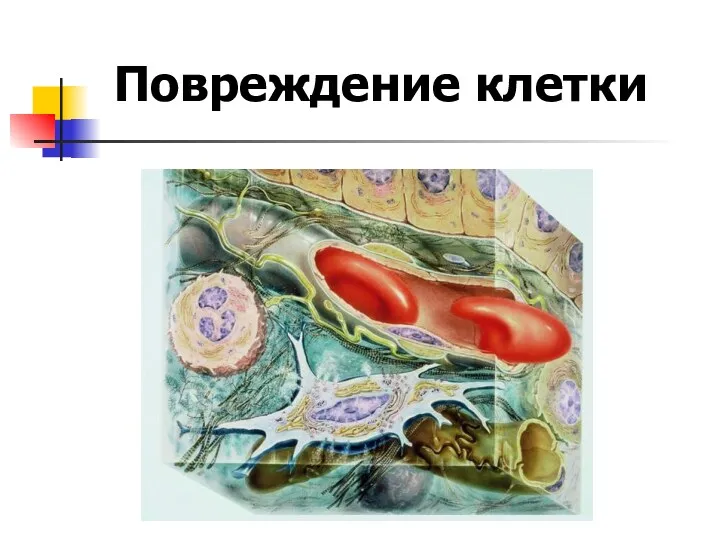 Повреждение клетки
Повреждение клетки Білки, жири і вуглеводи в їжі
Білки, жири і вуглеводи в їжі