Содержание
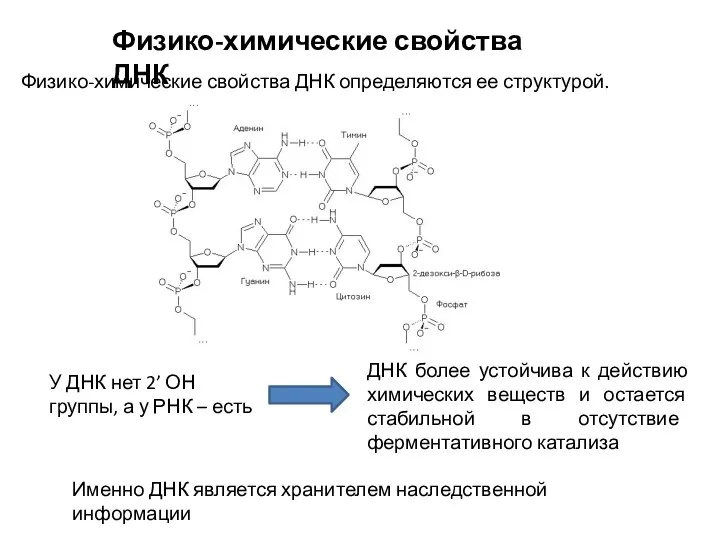
- 2. Физико-химические свойства ДНК Физико-химические свойства ДНК определяются ее структурой. У ДНК нет 2’ ОН группы, а
- 3. Оптические свойства ДНК определяются: Пуриновыми и пиримидиновыми основаниями Стэккинг-взаимодействиями между азотистыми основаниями Пурины и пиримидины поглощают
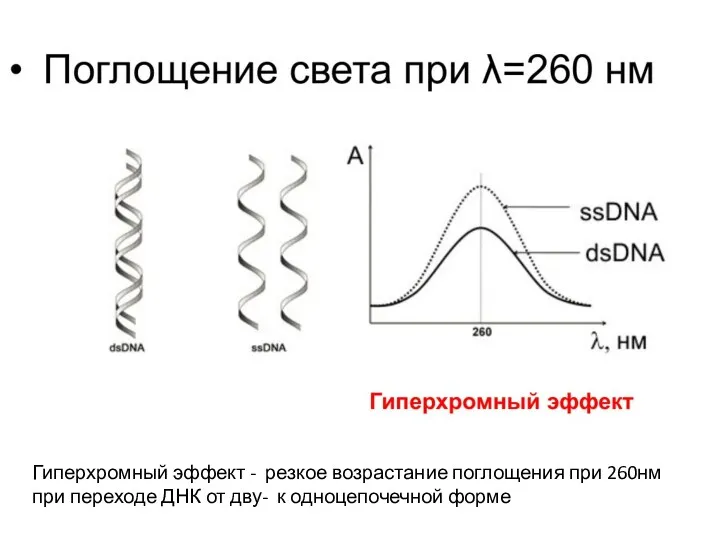
- 4. Гиперхромный эффект - резкое возрастание поглощения при 260нм при переходе ДНК от дву- к одноцепочечной форме
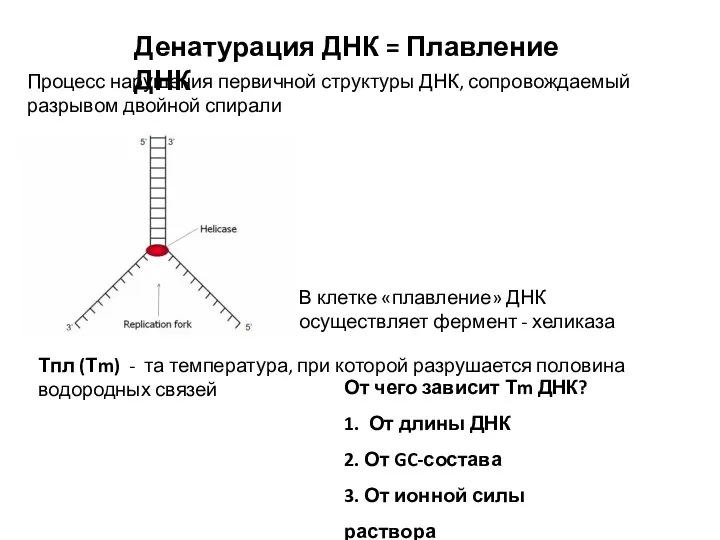
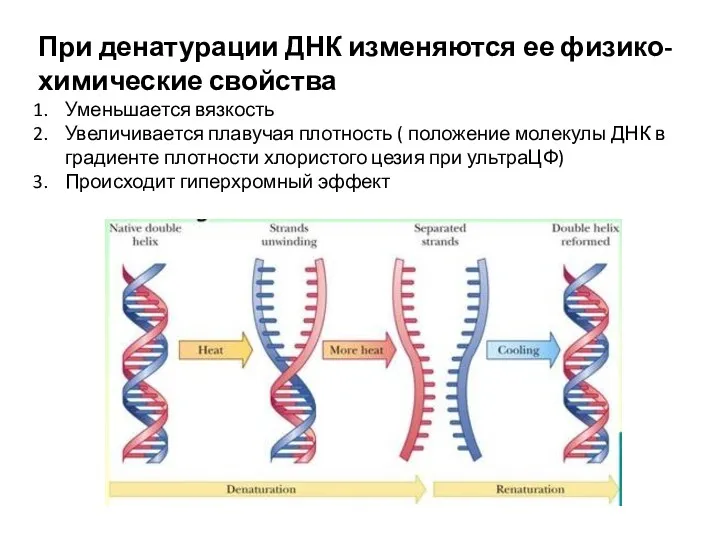
- 5. Денатурация ДНК = Плавление ДНК Процесс нарушения первичной структуры ДНК, сопровождаемый разрывом двойной спирали Тпл (Тm)
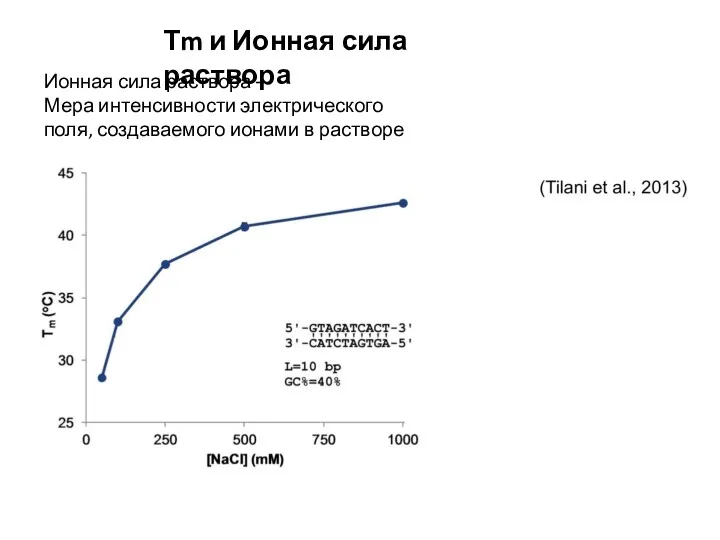
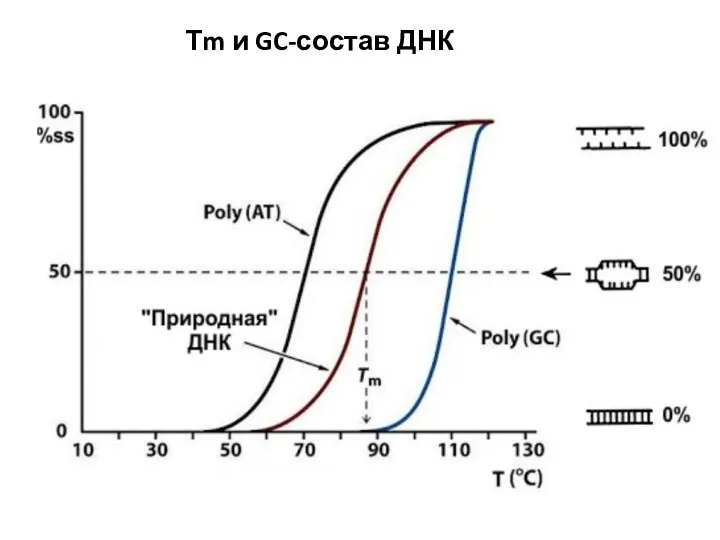
- 6. Ионная сила раствора – Мера интенсивности электрического поля, создаваемого ионами в растворе Тm и Ионная сила
- 7. Тm и GC-состав ДНК
- 8. Формула для расчета Тm
- 9. При денатурации ДНК изменяются ее физико-химические свойства Уменьшается вязкость Увеличивается плавучая плотность ( положение молекулы ДНК
- 10. Электрофорез ДНК В нейтральной и щелочной средах молекулы нуклеиновых кислот заряжены отрицательно. Отношение заряда к массе
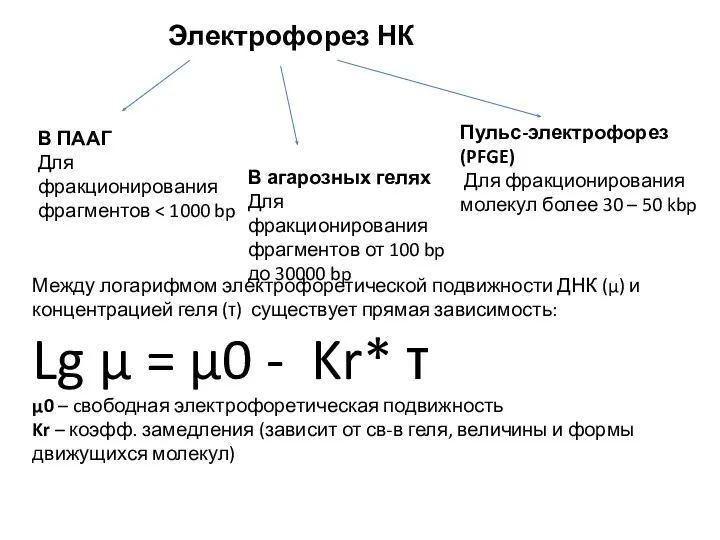
- 12. Электрофорез НК В ПААГ Для фракционирования фрагментов В агарозных гелях Для фракционирования фрагментов от 100 bp
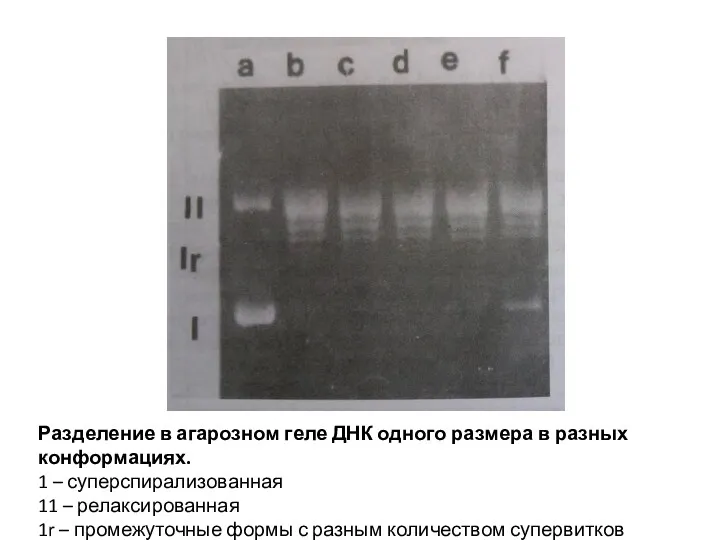
- 13. Разделение в агарозном геле ДНК одного размера в разных конформациях. 1 – суперспирализованная 11 – релаксированная
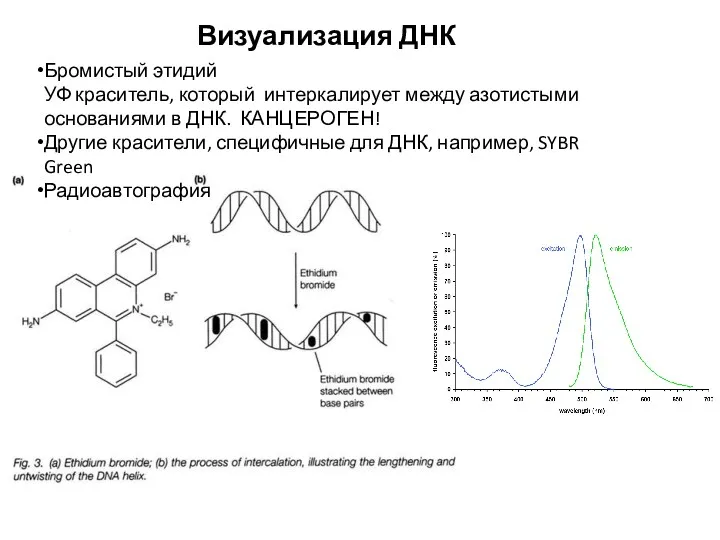
- 14. Визуализация ДНК Бромистый этидий УФ краситель, который интеркалирует между азотистыми основаниями в ДНК. КАНЦЕРОГЕН! Другие красители,
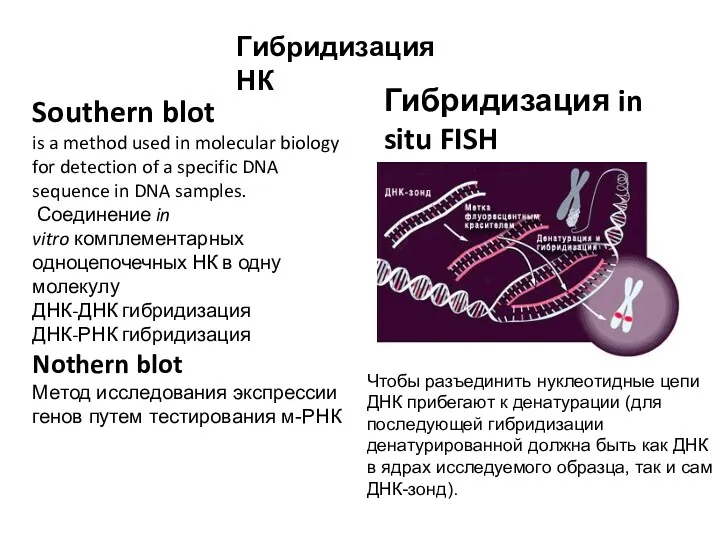
- 15. Гибридизация НК Southern blot is a method used in molecular biology for detection of a specific
- 16. Современные подходы к секвенированию ДНК Техника определения нуклеотидной последовательности ДНК и РНК для получения формального описания
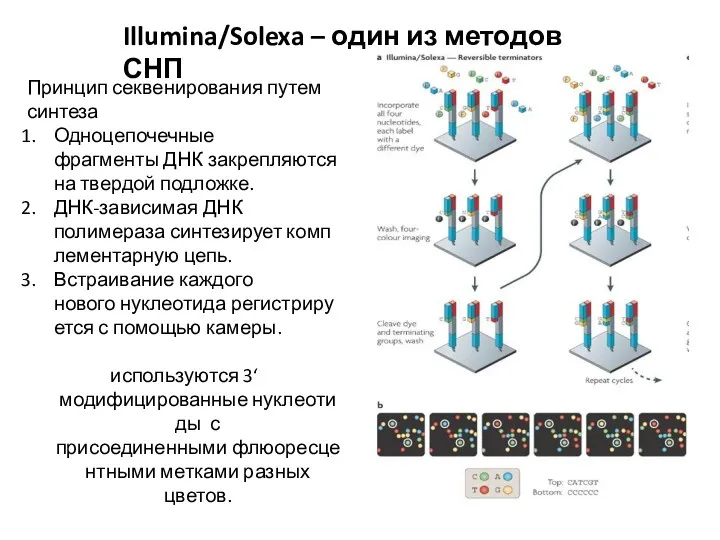
- 17. Illumina/Solexa – один из методов СНП Принцип секвенирования путем синтеза Одноцепочечные фрагменты ДНК закрепляются на твердой
- 18. Первый секвенатор Genome Analyzer 1G был представлен компанией Solexa в 2006 году. Длина прочтения составляла 30-35
- 19. РНК-секвенирование.Изучение транскриптома. Современное полногеномное РНК-секвенирование (RNA-seq) основано на прямом секвенировании фрагментов с-DNA Анализ экспрессии генов
- 20. Что мы делали на прошлом занятии и как оно связано с этим? Выделили плазмидную ДНК Определили
- 22. Скачать презентацию







 Поздняя палеозойская эра
Поздняя палеозойская эра Презентация к уроку биологии 7 класс
Презентация к уроку биологии 7 класс Урок - презентация Витамины 8 класс
Урок - презентация Витамины 8 класс Основы анатомии человека и здорового образа жизни. Тема 2
Основы анатомии человека и здорового образа жизни. Тема 2 Презентация к уроку Дыхательная система
Презентация к уроку Дыхательная система Улюблена домашня тварина
Улюблена домашня тварина Генетика - наука о закономерностях наследственности и изменчивости. Г. Мендель - основоположник генетики. Символика,
Генетика - наука о закономерностях наследственности и изменчивости. Г. Мендель - основоположник генетики. Символика, Габитоскопия. Лицо
Габитоскопия. Лицо Самые умные животные!
Самые умные животные! Презентация к уроку Размножение голосеменных растений - 6 класс
Презентация к уроку Размножение голосеменных растений - 6 класс Опасные животные Нижегородской области
Опасные животные Нижегородской области Красная книга Карелии
Красная книга Карелии Дыхание растений и животных
Дыхание растений и животных Физиология нервных волокон
Физиология нервных волокон Вступ. Короткий нарис з історії розвитку анатомії. Зміст та значення курсу. Дитина - об`єкт пізнання
Вступ. Короткий нарис з історії розвитку анатомії. Зміст та значення курсу. Дитина - об`єкт пізнання Влияние электромагнитного поля на биологические объекты
Влияние электромагнитного поля на биологические объекты Селекция микроорганизмов. Биотехнология
Селекция микроорганизмов. Биотехнология Animal life of the UK
Animal life of the UK Развитие жизни в протерозойской и палеозойской эрах
Развитие жизни в протерозойской и палеозойской эрах Чувствительная иннервация глаза. Анатомия тройничного нерва (n. V)
Чувствительная иннервация глаза. Анатомия тройничного нерва (n. V) Отдел Покрытосеменные Класс Однодольные Лилейные и Злаковые растения
Отдел Покрытосеменные Класс Однодольные Лилейные и Злаковые растения Анатомия и симптомы поражения тройничного нерва
Анатомия и симптомы поражения тройничного нерва Обучающий вебинар Как избежать ошибок при сдаче ВПР в 2020 году
Обучающий вебинар Как избежать ошибок при сдаче ВПР в 2020 году Физиология микроорганизмов. (Лекция 3)
Физиология микроорганизмов. (Лекция 3) Анатомия, физиология и методы исследования органа зрения
Анатомия, физиология и методы исследования органа зрения Беспозвоночные. Особенности строения и экологии представителей некоторых систематических групп
Беспозвоночные. Особенности строения и экологии представителей некоторых систематических групп Органоиды
Органоиды Филогенез пищеварительной системы хордовых
Филогенез пищеварительной системы хордовых