Содержание
- 2. I. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АК В ЖКТ 1) Белки пищи поэтапно гидролизуются до свободных АК
- 3. I. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АК В ЖКТ 2) Пептидазы обладают относительной субстратной специфичностью, но с
- 4. I. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АК В ЖКТ 4) От пептидаз СОЖ и кишечника защищают муцины,
- 5. II. АМИНОКИСЛОТНЫЙ ФОНД КЛЕТКИ ИСТОЧНИКИ ПОСТУПЛЕНИЯ АК: 1) белки пищи; 2) белки тканей 3) синтез заменимых
- 6. III. Метаболизм АК в тканях: общие пути обмена АК 1. ТРАНСАМИНИРОВАНИЕ – это реакции переноса аминогруппы
- 7. Рис. 1 РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ α- α- АСТ АЛТ ПФ(В6) ПФ(В6)
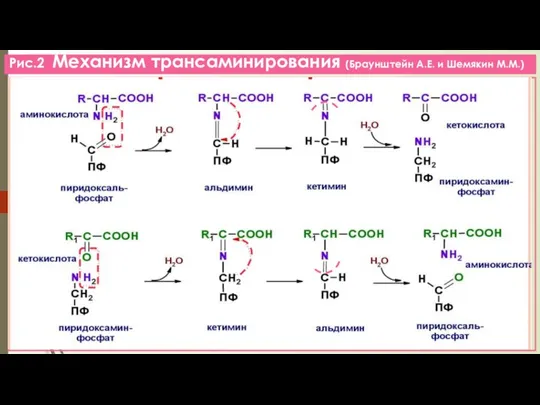
- 8. Рис.2 Механизм трансаминирования (Браунштейн А.Е. и Шемякин М.М.)
- 9. Б/РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ Образование заменимых АК из α-кетокислот (α-К - коллектор, собирает аминогруппы, а Глу- универсальный
- 10. III. Метаболизм АК в тканях: общие пути обмена АК 2. ДЕЗАМИНИРОВАНИЕ – это реакции отщеплениия α-аминогруппы
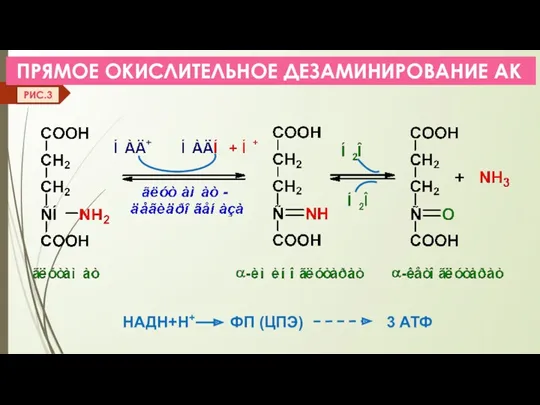
- 11. ПРЯМОЕ ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ АК НАДН+Н+ ФП (ЦПЭ) 3 АТФ РИС.3
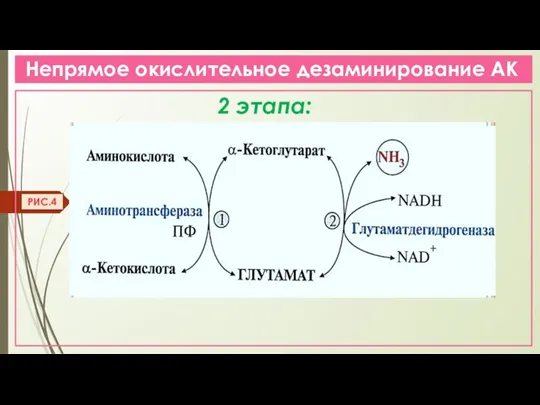
- 12. Непрямое окислительное дезаминирование АК 2 этапа: РИС.4
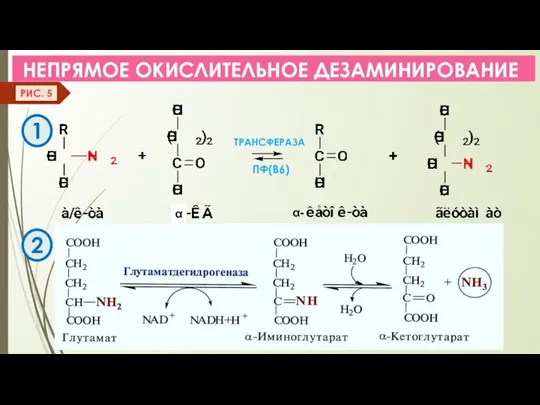
- 13. НЕПРЯМОЕ ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ ТРАНСФЕРАЗА α- ПФ(В6) РИС. 5 2 1
- 14. Биологическая РОЛЬ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ АК Реакции распада АК Образование α-кетокислот, к-е могут поступать В ЦТК (ЩУК,
- 15. III. Метаболизм АК в тканях: общие пути обмена АК 3. ДЕКАРБОКСИЛИРОВАНИЕ – это необратимые реакции отщеплениия
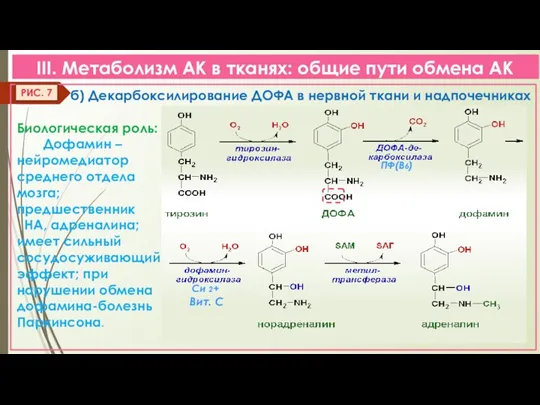
- 16. III. Метаболизм АК в тканях: общие пути обмена АК б) Декарбоксилирование ДОФА в нервной ткани и
- 17. III. Метаболизм АК в тканях: общие пути обмена АК в) Декарбоксилирование Глу: Биологическая роль ГАМК: основной
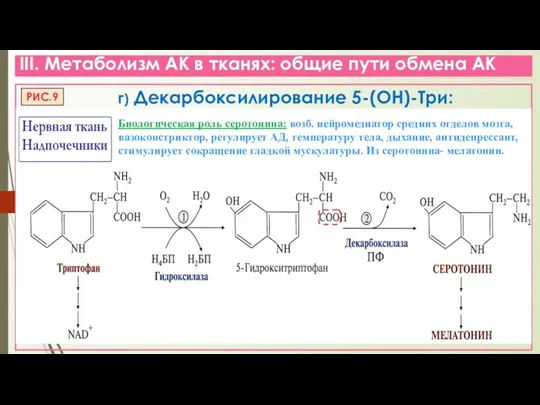
- 18. III. Метаболизм АК в тканях: общие пути обмена АК г) Декарбоксилирование 5-(ОН)-Три: Биологическая роль серотонина: возб.
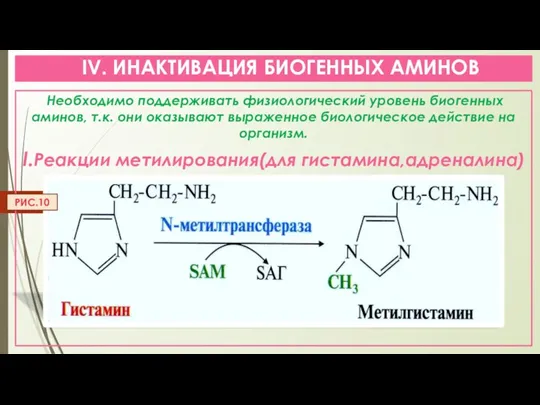
- 19. IV. ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ Необходимо поддерживать физиологический уровень биогенных аминов, т.к. они оказывают выраженное биологическое действие
- 20. IV. ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ 2. Реакции окислительного дезаминирования с участием МАО (для дофамина, НА, серотонина, ГАМК)
- 21. V. Метаболизм АК в тканях: индивидуальные пути синтеза АК РИС.12 Роль: образование Глу, к-я является источником
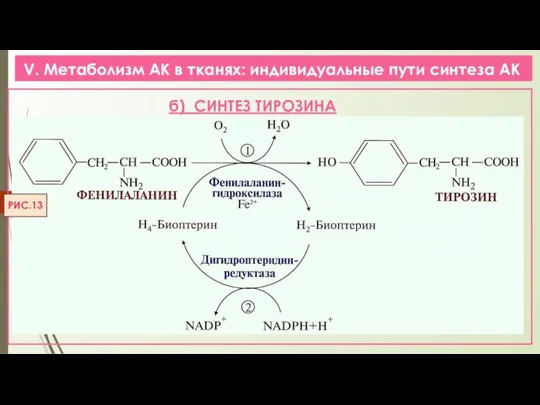
- 22. V. Метаболизм АК в тканях: индивидуальные пути синтеза АК РИС.13 б) СИНТЕЗ ТИРОЗИНА
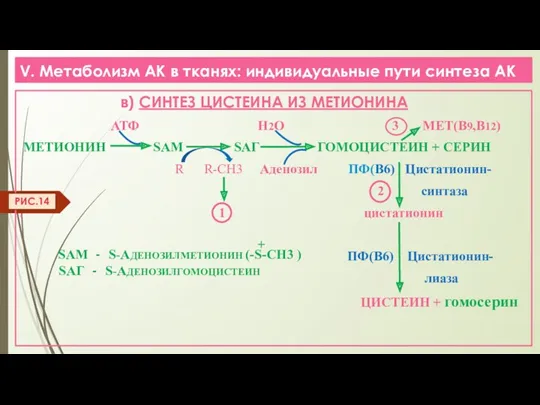
- 23. V. Метаболизм АК в тканях: индивидуальные пути синтеза АК в) СИНТЕЗ ЦИСТЕИНА ИЗ МЕТИОНИНА АТФ Н2О
- 24. V. Метаболизм АК в тканях: индивидуальные пути синтеза АК 1 ТРАНСМЕТИЛИРОВАНИЕ (R) (R-СН3) приводит К СИНТЕЗУ:
- 25. VI. ГОМОЦИСТИНУРИЯ : Цистеин входит в состав различных белков, в том числе тканей и жидкостей полости
- 26. ПРИЛОЖЕНИЕ: М.Г. Крицман (1905-1971) Окончила Одесский медицинский институт. Работала в Москве в Биохимическом институте Наркомздрава РСФСР,
- 27. ПРИЛОЖЕНИЕ РИС.2
- 28. ПРИЛОЖЕНИЕ: виды реакций дезаминирования РИС.3
- 29. ПРИЛОЖЕНИЕ : Неокислительное дезаминирование Сер, Тре (элиминирующее) РИС. 4
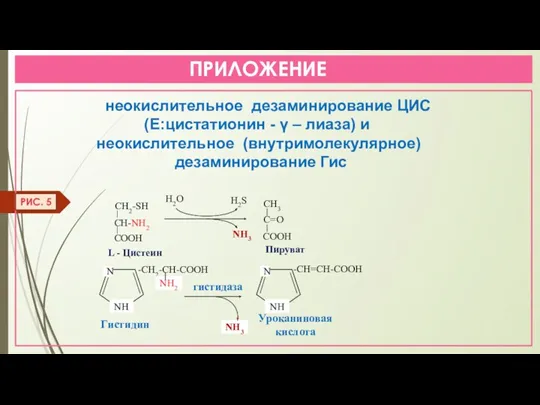
- 30. ПРИЛОЖЕНИЕ неокислительное дезаминирование ЦИС (Е:цистатионин - γ – лиаза) и неокислительное (внутримолекулярное) дезаминирование Гис H2O L
- 31. ПРИЛОЖЕНИЕ: Непрямое дезаминирование АК с участием цикла ИМФ – АМФ (для мышечной ткани и мозга) 1-трансаминазы,
- 33. Скачать презентацию




















 Функциональная анатомия вегетативной нервной системы. Парасимпатическая часть ВНС
Функциональная анатомия вегетативной нервной системы. Парасимпатическая часть ВНС Анатомо-физиологические особенности органа слуха и равновесия
Анатомо-физиологические особенности органа слуха и равновесия Вегетативные органы растений: корень
Вегетативные органы растений: корень Удивительные животные
Удивительные животные Нервная система человека
Нервная система человека Семейство Лилейные. Класс Однодольные
Семейство Лилейные. Класс Однодольные Микроорганизмдердің қореқтенуі
Микроорганизмдердің қореқтенуі МАТЕМАТИКА и БИОЛОГИЯ ... НА КУХНЕ?
МАТЕМАТИКА и БИОЛОГИЯ ... НА КУХНЕ? Закономерности изменчивости
Закономерности изменчивости Саморазвитие экосистем
Саморазвитие экосистем Строение и функции белков
Строение и функции белков Типы питания растений
Типы питания растений Покровы тела. Сравнительная характеристика
Покровы тела. Сравнительная характеристика Митоз Способы деления клетки
Митоз Способы деления клетки Клонирование и этическая проблема
Клонирование и этическая проблема Презентация педагогического опыта по теме Методологические основы интегрированных уроков
Презентация педагогического опыта по теме Методологические основы интегрированных уроков Фізіологія дихання
Фізіологія дихання Выращивание томатов
Выращивание томатов Курс подготовки к ЕГЭ по биологии
Курс подготовки к ЕГЭ по биологии Эволюция опорно- двигательной системы у животных
Эволюция опорно- двигательной системы у животных Роль витаминов в формировании потребительских свойств продовольственных товаров
Роль витаминов в формировании потребительских свойств продовольственных товаров Відходи технічних виробництв та харчові відходи
Відходи технічних виробництв та харчові відходи Ядовитые растения, произрастающие в Ленинградской области
Ядовитые растения, произрастающие в Ленинградской области Круговорот углерода в природе
Круговорот углерода в природе Технологии высокопроизводительного паралельного секвенирования (NGS)
Технологии высокопроизводительного паралельного секвенирования (NGS) История подсолнечника
История подсолнечника Генетика
Генетика Серцевий цикл. Робота серця
Серцевий цикл. Робота серця